利用D-900树脂对巴戟天多糖脱色工艺进行优化
2012-10-28陈振兴陈地灵冯学轩吴俊生
陈振兴,陈地灵,林 励*,冯学轩,梁 杏,吴俊生
(广州中医药大学中药学院,广东 广州 510006)
利用D-900树脂对巴戟天多糖脱色工艺进行优化
陈振兴,陈地灵,林 励*,冯学轩,梁 杏,吴俊生
(广州中医药大学中药学院,广东 广州 510006)
研究D-900阴离子交换树脂对巴戟天多糖的最佳脱色工艺。采用D-900阴离子交换树脂对巴戟天多糖进行静态和动态吸附试验,考察不同温度、树脂用量、流速和pH值等因素对吸附过程的影响,以脱色率和多糖保留率综合评价其脱色效果。最佳工艺参数为:采用动态吸附,柱溶液温度45℃、流速1.0BV/h、上样液pH6.0。使用D-900阴离子交换树脂对巴戟天多糖脱色可以获得较好的脱色率以及较高的多糖保留率。
巴戟天;多糖;脱色;阴离子交换树脂
巴戟天为茜草科植物巴戟天(Morinda officinalis How.)的干燥肉质根,味甘、辛,性微温,有补肾阳、强筋骨、祛风湿之功效。主要分布在福建、广东、广西、海南等省的热带和亚热带地区,是我国著名的“四大南药”之一。巴戟天中主要含有糖类、蒽醌、氨基酸、脂类、有机酸等化合物及无机元素[1]。其中,糖类物质含量最高,成分复杂,药理作用明显[2-12]。现有研究资料表明巴戟天的许多临床疗效与此类成分有关[13-16],具有十分广阔的开发应用前景。目前,由于提取工艺落后,得到的产物色泽呈棕褐色或黑色。色素的存在不仅影响多糖色泽,也阻碍了对多糖组成、结构及其生物活性关系的研究。因此,对巴戟天多糖进行脱色有很大的意义。常规脱色的方法一般有活性炭法,双氧水法等,但这些方法用于巴戟天多糖的脱色均存在缺陷,采用活性炭吸附脱色,耗时长、多糖损失率大、难以滤过;采用双氧水脱色,效果不理想,且H2O2具有氧化性,可能破坏多糖的生物活性。
D-900阴离子交换树脂主要用于糖类等食品工业中的提取、脱色。其最大优点是可在醇溶液的情况下直接上柱脱色,这样既省略了一些不必要的工序,又可以减少有效成分的损失。且该树脂具有再生效率高、交换容量大、体积变化小、洗脱效果好,抗污染能力强和机械强度好的优点。迄今,利用大孔吸附树脂对巴戟天多糖色素进行吸附研究在国内外尚无报道。
本实验采用D-900阴离子交换树脂对巴戟天多糖的静态吸附、动态吸附性能以及树脂再生效果等因素进行考察,以确定吸附及解吸附的最佳工艺参数,为巴戟天多糖的研究提供参考。
1 材料与方法
1.1 材料与仪器
巴戟天鲜品于2010年9月26日采自德庆高良镇巴戟天GAP种植基地,由广州中医药大学中药学院林励研究员鉴定为茜草科植物巴戟天(Morinda officinalis How.)的干燥肉质根,除去须根等杂质,晒焉,抽去木心,再晒干;D-900树脂 河北沧州宝恩吸附材料科技有限公司;D-葡萄糖 美国Amresco公司;苯酚、浓硫酸、浓盐酸、氢氧化钠、乙醇等试剂均为分析纯;重蒸馏水 广州中医药大学中药学院GMP实验室。
DSH-300型多用途水浴恒温振荡器;HH-S数显恒温水浴锅;Cary 50型紫外可见光分光光度计(带石英比色皿) 美国Varian公司;BP211D电子分析天平 德国Sartorius公司;KQ-500超声仪 昆明市超声仪器有限公司;层析柱(1.5cm×20cm);pH测定仪。
1.2 方法
1.2.1 巴戟天多糖测定方法
采用苯酚-硫酸法[17]测定多糖,以葡萄糖为对照品,测定巴戟天总糖含量。
1.2.2 苯酚-硫酸溶液的配制
精密称取苯酚5.0g,置100mL容量瓶中,加新鲜蒸馏水稀释至刻度,摇匀,滤过至棕色瓶,得到5%苯酚溶液,置冰箱中备用。
1.2.3 最大吸收波长的确定

图1 光谱扫描图Fig.1 UV-visible scanning spectra of glucose and polysaccharide extract from Morinda officinalis How.
分别精确取1mL葡萄糖对照品溶液和0.5mL巴戟天待测样品溶液于干燥的10mL具塞试管中,加水至总体积为1mL,加入1.0mL 5%苯酚溶液,摇匀,再加入5mL浓硫酸,摇匀,放置10min后,再在40℃水浴加热18min,取出,流水冷却至室温后,以未加待测溶液为空白,在200~800nm波长范围内进行光谱扫描。结果表明(图1)对照品和样品在490nm处有相同吸收峰,故确定以490nm为测定波长。
1.2.4 标准曲线的制备
精密称取干燥至质量恒定的葡萄糖对照品0.1235g,加水溶解并定容至100mL量瓶中,再移取10mL葡萄糖溶液于100mL量瓶中,加水定容,摇匀,即得质量浓度0.1235mg/mL的葡萄糖对照品溶液。
分别精密吸取葡萄糖对照品溶液0.0、0.2、0.4、0.6、0.8、1.0mL,按照1.2.3节方法显色,在波长490nm处分别测定吸光度,以葡萄糖量为横坐标、吸光度为纵坐标绘制回归曲线,结果表明:葡萄糖在0~0.123mg/mL范围内质量浓度与吸光度呈线性相关。标准曲线回归方程为:Y=8.7878X+0.00222,R2=0.9992。
1.2.5 巴戟多糖的提取、精制及换算因子测定
取巴戟天药材100g,粉碎过20目筛,加入500mL无水乙醇,沸水浴回流脱脂及除去醇溶性成分(经蒸发光检测其醇溶液中含葡萄糖、果糖和蔗糖),回流两次。滤渣加水400mL热回流2次,合并滤液,适当浓缩,冷却至室温,加乙醇至90%,冷藏48h,滤取沉淀,挥干,至乙醇味消失后溶于水中,用Sevag法除蛋白3次,旋转蒸发仪浓缩至稠膏状,转移至蒸发皿中60℃真空干燥箱中干燥,得巴戟多糖。
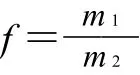
1.2.6 多糖含量测定
吸取巴戟天多糖待测液1mL,在1.2.3节确定的最大吸收波长下测定吸光度(A),由1.2.4节得到的回归方程计算待测液中葡萄糖质量浓度(C),按照下式计算样品中巴戟天多糖含量:
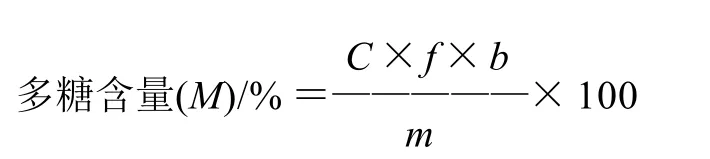
式中:C为巴戟天多糖待测液中葡萄糖的质量浓度/(mg/mL);f为换算因子;m为称取多糖的质量/mg;b表示多糖稀释倍数。
1.2.7 多糖保留率计算

式中:M前、M后分别为脱色前后的多糖含量。
1.2.8 脱色率的测定及计算方法
质量浓度0.5mg/mL巴戟天多糖溶液,在200~800nm波长范围内进行光谱扫描。结果表明在波长410nm处有最大吸收,故确定以波长410nm处的吸光度变化考察树脂的脱色效果。

式中:A脱色前、A脱色后分别为脱色前后溶液的吸光度。
1.2.9 树脂的预处理
新树脂必须经过预处理,将其中的有机物、低聚物以及有害离子等杂质除去。首先使用饱和食盐水,取其量约等于被处理树脂体积的两倍,将树脂置于食盐溶液中浸泡18~20h,然后放尽食盐水,用清水漂洗净,使排出水不带黄色;而后用5% HCl溶液浸泡4~8h,然后放尽酸液,用水清洗至中性;而后用2%~4% NaOH溶液浸泡4~8h后,放尽碱液,用清水洗至中性待用。
2 结果与分析
2.1 D-900树脂对巴戟天多糖色素的静态吸附试验
精确称量预处理好的树脂1、2、3、4、5g,转入装有10mL质量浓度1.5mg/mL巴戟天多糖溶液锥形瓶中,分别在室温(20)、25、35、45、55℃条件,以140r/ min振荡2h后,过滤,取滤液转入100mL容量瓶,加水定容,测定溶液脱色后的吸光度,并按照1.2.3节方法显色,测定溶液中多糖的吸光度[18-19]。分别计算多糖保留率和脱色率,结果见图2。

图2 各温度下树脂对多糖的脱色率(A)和保留率(B)Fig.2 Effect of static adsorption temperature on decolorization rate and polysaccharide retention rate
图2表明,不同温度下,不同树脂用量对色素的吸附能力表现各异,同时也对多糖有不同的交换吸附作用。由图2A可知,温度越高,树脂对巴戟天多糖色素的吸附作用越强,吸附效果越好,且45℃和55℃的脱色率相差不大。由图2B可知,45℃下多糖保留率达到最高,温度降低或升高均使多糖保留率降低。综合考虑选择45℃作为最佳的脱色吸附温度,达到吸附平衡的最佳树脂用量是3g(1.5mg/mL巴戟天多糖提取液10mL)。
2.2 D-900树脂对巴戟天多糖色素的动态吸附研究
将预处理好的树脂以湿法搅拌下装入层析柱中,树脂层析柱高为10cm,巴戟天多糖提取液20mL以一定流速通过交换柱,进行动态脱色试验。收集洗脱液定容至200mL容量瓶,加水稀释至刻度线。取定容后的洗脱液1.0mL,按照1.2.3节显色方法和最佳波长测定溶液吸光度,分别计算多糖保留率和脱色率。试验分别考察树脂柱高、上柱液流速、温度和pH值等因素[20-21]对洗脱效果的影响,并得出适宜的脱色条件[22]。
2.2.1 柱高对巴戟天多糖色素的吸附研究
将预处理好的树脂以湿法搅拌下装入层析柱中,柱高分别为4.5、8.0、10.0、12.5、15.0cm,巴戟天多糖提取液20mL以一定流速通过交换柱,分别计算多糖保留率和脱色率。结果见图3。

图3 不同树脂柱高对多糖提取液脱色效果的影响Fig.3 Effect of resin column height on decolorization rate and polysaccharide retention rate
由图4可知:树脂柱高对巴戟天多糖提取液的多糖吸附和脱色效果有显著效果,随着柱高的变化,多糖保留率逐渐降低,脱色率逐渐升高。本实验选取10cm树脂柱高作为脱色柱高(巴戟天多糖溶液20mL),考察在其他因素下,D-900树脂对巴戟天多糖色素的吸附影响。
2.2.2 上柱液流速对D-900树脂吸附研究
由图4可知,随着上柱液的流速加快,树脂对多糖的吸附增加,多糖保留率减少,同时,也对色素的吸附能力降低,造成脱色率降低。树脂吸附过程中,多糖提取溶液的流速慢有利于上柱液中色素在树脂床中充分扩散,使其容易充分被树脂吸附。当流速0.2BV/h时,多糖保留率和脱色效果最佳,但流速太慢又会影响生产效率,使生产周期拖长。若增加流速,多糖的吸附量也会增加,流速过高会使多糖没有足够的时间扩散到树脂内部,影响脱色效果,综合考虑,选取1BV/h的流速作为最佳流速。

图4 流速对多糖提取液脱色效果的影响Fig.4 Effect of sample loading flow rate on decolorization rate and polysaccharide retention rate
2.2.3 柱溶液的温度对D-900树脂吸附研究

图5 温度对多糖提取液脱色效果的影响Fig.5 Effect of dynamic adsorption temperature on decolorization rate and polysaccharide retention rate
由图5可知,随上柱液温度的升高,脱色率和多糖保留率也升高,并且在45℃达到最大值,55℃时吸附效果减弱,脱色率和多糖保留率稍有减少。结果得出45℃是较适宜的吸附温度,温度过低或过高,树脂对多糖的吸附增加,多糖保留率减少,同时,对色素的吸附能力也会较低,造成脱色率下降。故选取45℃作为最佳的柱溶液温度。
2.2.4 上柱液pH值对D-900树脂的吸附研究

图6 pH值对多糖脱色效果的影响Fig.6 Effect of sample pH on decolorization rate and polysaccharide retention rate
由图6可知,pH值对巴戟天多糖的脱色效果和多糖保留率均存在影响。随pH值的升高,脱色率和多糖保留率都在升高。巴戟天多糖提取液的pH值较大时,色素在弱酸性的条件下易于被吸附,吸附效果好。酸性增强,树脂对多糖的吸附能力增强,使多糖的保留率下降。当pH6时,巴戟天多糖的保留率最高,脱色效果最好,故选取pH6为上柱液的最佳pH值。
2.3 最佳工艺验证实验
按照动态试验得出的最佳工艺条件为上柱液温度45℃、流速1BV/h、pH6.0,按照最佳工艺条件吸取巴戟天多糖提取液20mL,过树脂高为10cm的树脂柱,收集洗脱液。洗脱液转至200mL容量瓶,加水定容。取定容后的洗脱液测定波长410nm处的吸光度,另取1.0mL,按照1.2.3节显色方法测定溶液吸光度,分别计算脱色率和多糖保留率。做3次平行试验,结果脱色率(70.81± 1.29)%,多糖保留率(83.35±0.39)%。
2.4 树脂的解吸及再生
树脂吸附色素后可再生重复利用,本试验用95%乙醇溶液作为洗脱剂,以一定流速通过吸附柱进行洗脱解吸试验,收集流出液,照1.2.3节分析方法测定溶液吸光度,当吸光度接近“0”时、依次用纯水、3%~5%HCl溶液、纯水(洗至pH6~7)、3%~5% NaOH溶液、纯水(洗至pH7~8),然后反洗,正洗,即可再用。
3 结 论
通过对巴戟天多糖提取液在D-900树脂上的静态吸附行为研究,发现树脂对多糖提取液的多糖成分和色素均有吸附作用,综合考虑多糖保留率和脱色率,得出D-900大孔树脂在45℃、树脂用量3.0g(1.5mg/mL多糖提取液10mL)时为最佳条件,该条件下,多糖保留率69.0%、脱色率65.7%。
通过对巴戟天多糖提取液在D-900树脂上的动态吸附行为研究,得出脱色的最佳工艺参数为流速1.0BV/h、柱溶液温度45℃、上层析柱溶液pH6,在此条件下,对巴戟天多糖提取液的多糖保留率约为83.4%,脱色率为70.9%。
综合离子交换树脂的静态吸附试验和动态吸附试验分析,动态吸附试验下,离子交换树脂对巴戟天多糖色素的吸附较多,而且多糖保留率较高。物理化学的观点认为,离子交换树脂的脱色过程既有交换过程,也有吸附过程。离子交换树脂具有一定的活性表面,当其表面与一种溶液接触时,由于表面能的作用,使溶质聚集到树脂表面上,即产生吸附作用, 吸附过程也就是表面自由焓降低的过程。离子交换树脂对多糖溶液色素的脱除是离子交换过程与吸附过程。大孔吸附树脂是一类有机高聚物吸附剂,具有大孔网状结构和较大的比表面积,可通过物理吸附从水溶液中选择性的吸附有机物,作用条件比较温和[22]。静态吸附试验下,树脂对多糖溶液色素的脱除主要为吸附过程,同时也会吸附一定的多糖成分,而动态吸附比静态吸附试验的多糖保留率和脱色率都高,原因是动态条件下,上柱液在树脂上流动,不断交换,多糖成分为大分子,能更好地洗脱出来,而色素属于小分子,经历树脂的离子交换和吸附过程,被树脂很好地吸附。动态吸附,条件易于控制,操作简便,故可作为工业生产的最佳选择。
[1] 肖新霞, 潘胜利. 巴戟天属植物化学成分, 药理活性与临床应用[J].国外医药: 植物分册, 2003, 18(6): 243-248.
[2] 徐超斗, 张永祥, 杨明, 等. 巴戟天寡糖的促免疫活性作用[J]. 解放军药学学报, 2003, 19(6): 466-467.
[3] 肖凤霞, 林励. 巴戟天补肾壮阳作用的初步研究[J]. 食品与药品, 2006 (5): 45-46.
[4] 付嘉, 熊彬, 郑冰生, 等. 巴戟天对D-半乳糖致衰老小鼠抗氧化系统作用的实验研究[J]. 中国老年学杂志, 2004, 24(12): 1206.
[5] 张有志, 李云峰, 刘刚, 等. 巴戟天寡糖对获得性无助抑郁模型大鼠行为的影响[J]. 中国行为医学科学, 2005, 14(4): 309-310.
[6] 刘艳芹, 王永安, 王伊文, 等. 巴戟天六聚糖对N-甲基-D天东氨酸损伤的大鼠大脑皮层细胞的保护作用[J]. 中国新医药, 2004, 5(3): 19-20.
[7] 李云峰, 罗质璞, 杨明, 等. 巴戟天寡糖对皮质酮损伤的PC12细胞的保护作用[J]. 中国中药杂志, 2000, 25(9): 551-552.
[8] 梁宏宇, 吴伟, 陈宏. 巴戟素对血管性痴呆大鼠的行为学影响及其机制的探讨[J]. 当代医药卫生, 2005, 2(5): 8-10.
[9] 林芳花, 林励, 肖凤霞, 等. 巴戟甲素对正常雄性小鼠交配能力和免疫器官系数的影响[J]. 中国新药杂志, 2008(22): 45-47.
[10] CHOI J W, LEE K T, CHOI M Y, et al. Antinociceptive antiinflammatory effect of monotropein isolated from the root of Morinda officinalis[J]. Biol Pharm Bull, 2005, 28(10): 1915-1918.
[11] 陈地灵, 帅欧, 林励, 等. 炮制方法对巴戟天糖类成分的影响研究[J].中国药房, 2012, 23(1): 217-220.
[12] YANG Zhenmin, YI Yongtao, GAO Chuanchuan. Isolation of inulintype oligosaccharides from Chinese traditional medicine: Morinda officinalis how and their characterization using ESI-MS/MS[J]. Journal of Separation Science, 2010, 33(1): 120-125.
[13] 陈地灵, 陈振兴, 林励, 等. 巴戟多糖在体肠吸收机制研究[J]. 中药新药与临床药理,2012, 23(1): 61-64.
[14] CHANG M S, KIM W N, YANG W M, et al. Cytoprotective effects of Morinda officinalis against hydrogen peroxide-induced oxidative stress in Leydig TM3 cells[J]. Asian J Androl, 2008, 10(4): 667-674.
[15] ZHU Mengyong, WANG Caijiao, ZHANG Husheng, et al. Protective effect of polysaccharides from Morinda officinalis on bone loss in ovariectomized rats[J]. International Journal of Biological Macromolecules, 2008, 43(3): 276-278.
[16] ZHANG Hualin, LI Jun, LI G, et al. Structural characterization and antifatigue activity of polysaccharides from the roots of Morinda officinalis [J]. International Journal of Biological Macromolecules, 2009, 44(3): 257-261.
[17] 陈红红, 黄丽玫. 德庆等地巴戟天中蒽醌及多糖含量测定[J]. 广东药学院学报, 2002, 18(2): 103-105.
[18] 刘海霞, 牛鹏飞, 王峰, 李琴梅, 等. 大孔吸附树脂对大枣多糖提取液的脱色条件研究[J]. 食品与发酵工业, 2007, 33(10): 180-184.
[19] 罗玺, 唐庆九, 张劲松, 等. 灵芝多糖树脂法脱色工艺优化[J]. 食品科学, 2011, 32(16): 5-10.
[20] 易阳, 张名, 廖森泰, 等. 龙眼多糖树脂脱色工艺优化[J]. 农业机械学报, 2010, 41(8): 146-150.
[21] 谢红旗, 周春山. 香菇多糖脱色工艺研究[J]. 离子交换与吸附, 2007, 23(2): 158-165.
[22] 王元凤, 金征宇. 茶多糖脱色的研究[J]. 食品与发酵工业, 2004, 30 (12): 60-65.
Optimization of Decolorization of Polysaccharides from Morinda officinalis How. Using D-900 Resin
CHEN Zhen-xing,CHEN Di-ling,LIN Li*,FENG Xue-xuan,LIANG Xing,WU Jun-sheng
(School of Chinese Materia Medica, Guangzhou University of Chinese Medicine, Guangzhou 510006, China)
This study was undertaken to optimize the decolorization of polysaccharides from Morinda officinalis How. using D-900 anion exchange resin. Static and dynamic adsorption experiments were carried out to study the effects of temperature, resin dose, sample loading flow rate and pH on decolorization rate and polysaccharide retention rate. The optimal process parameters were dynamic adsorption at a sample loading flow rate of 1.0 BV/h, sample pH 6.0 and 45 ℃. In conclusion, higher decolorization rate and polysaccharide retention rate could be obtained by using D-900 anion exchange resin
Morinda officinalis How.;polysaccharide;discoloration;anion exchange resin
R284.2
A
1002-6630(2012)08-0071-05
2011-03-29
海南省重点科技项目(090603);广东省科技计划项目(2011B031700062);2011年省级大学生实验创新项目(1057211018)
陈振兴(1987—),男,硕士研究生,主要从事中药资源开发利用与新药研究。E-mail:416158716@qq.com
*通信作者:林励(1954—),男,研究员,本科,主要从事中药资源开发利用与新药研究。E-mail:LL76611@yahoo.com.cn
