纤维素酶-微波辅助提取软枣猕猴桃茎黄酮的工艺优化
2012-10-28张春红刘长江
张春红,许 宁,吴 双,刘长江*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
纤维素酶-微波辅助提取软枣猕猴桃茎黄酮的工艺优化
张春红,许 宁,吴 双,刘长江*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
采用纤维素酶-微波辅助法提取软枣猕猴桃茎中的黄酮类物质。通过单因素试验确定纤维素酶的添加量、酶解时间、作用温度、pH值的适宜水平,在此基础上,采用响应曲面法,通过方差分析建立数学模型,得到软枣猕猴桃茎黄酮提取的最佳工艺条件:纤维素酶添加量438U/g、酶解时间64min、作用温度49℃、pH4.7,在此条件下软枣猕猴桃茎黄酮提取率为2.89%。
软枣猕猴桃茎;黄酮类物质;纤维素酶;微波;响应面分析
软枣猕猴桃(Actinidia arguta Sieb.et Zucc.),又名软枣子、猕猴梨、藤瓜,属于猕猴桃科(Actinidiaceae)、猕猴桃属(Actinidia)多年生落叶藤本植物[1]。国外研究表明,软枣猕猴桃茎中含有丰富的黄酮类化合物,特别是其中的(+)-儿茶素和(-)-表儿茶素具有促进骨髓细胞增殖的功能活性[2]。在冬季,软枣猕猴桃的枝条被修剪下来,很多枝条被抛弃在田间地头,造成了资源的浪费。现代药理研究表明,黄酮类化合物具有多种生物活性[3-6],如清除自由基、抗脂质过氧化、抗病毒、防衰老、抗癌、保肝护肝及防治糖尿病等作用。因此,从软枣猕猴桃茎中提取黄酮类化合物作为功能性食品或药品的原料具有较好的开发前景。
在国内对软枣猕猴桃茎中黄酮类化合物的提取尚没有较成熟的方法,而如有机溶剂浸提和热水提取等传统法不能将被包裹在植物细胞壁组织中的有效成分完全的提取出来。细胞壁的主要成分是纤维素,纤维素酶能使细胞壁疏松、破裂,减少传质阻力,从而提高提取效率[7]。在国内外对植物原料活性成分的提取方法中,微波辅助法已被广泛采用,可以降低能源消耗,节省提取时间,并且生产设备简单无污染[8-9]。为了充分利用软枣猕猴桃资源,本研究采用酶法与微波辅助法相结合,从软枣猕猴桃茎中提取黄酮类化合物,并确定最佳提取工艺条件,为今后软枣猕猴桃茎黄酮类化合物的开发利用提供理论参考。
1 材料与方法
1.1 材料与试剂
软枣猕猴桃茎产自辽宁省本溪市;芦丁标准品(分析纯) 上海源叶生物科技有限公司;纤维素酶(酶比活力≥15000.0U/g) 国药集团化学试剂有限公司;其他试剂均为分析纯。
1.2 仪器与设备
U291型紫外可见分光光度计 日本Hitachi公司;HD-5型电脑紫外检测仪 上海沪西分析仪器厂;RE-52型旋转蒸发仪 上海亚荣生化仪器厂;5805型高速冷冻离心机 德国Investment公司;PB-10型数显pH计 德国Sartorius公司;HH-4型数显恒温水浴锅 常州国华电器有限公司;YP1002N电子天平 上海舜宇恒平科学仪;DHG-90240A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;MAS-I型微波炉 上海新仪微波化学科技有限公司。
1.3 方法
1.3.1 总黄酮含量的测定
采用 Al(NO3)3-NaNO2法[10-11]。
1.3.2 脂肪、色素等杂质的脱除。
采用索氏提取法。
1.3.3 软枣猕猴桃茎样粉的制备
将软枣猕猴桃鲜茎洗净,剪成段,在40℃条件下烘干,粉碎,经石油醚脱脂脱色后烘干至无残留,得到软枣猕猴桃茎样粉,至低温避光处保存,一周内备用。
1.3.4 纤维素酶-微波提取工艺
称取1.00g样粉于锥形瓶中,加入10mL一定pH值的磷酸缓冲溶液和定量的纤维素酶,于指定温度下水浴酶解至相应时间后于沸水浴灭酶5min, 加入无水乙醇使其体积分数为70%,在料液比为1:32(g/mL)、微波功率300W的条件下,提取时间5min(每间隔1min微波1次,每次作用1min)。微波处理后所得浸提液稍冷却,然后在4℃条件下6000r/min离心10min,过滤,去除滤渣,所得滤液减压浓缩,再用体积分数6 0%乙醇定容至100mL容量瓶,所得样液待测[12-14]。
1.3.5 软枣猕猴桃茎黄酮提取率计算方法
取不同试验条件下所得的定容样液按Al(NO3)3-NaNO2法测定,用紫外-可见分光光度计在510nm处比色,得吸光度,以A510表示,根据标准曲线求得样液黄酮质量浓度,按下式计算黄酮提取率:

1.3.6 统计分析
每组单因素试验重复3次。在单因素试验基础上,采用Minitab软件进行试验设计及和显著性分析。
2 结果与分析
2.1 标准曲线的制定
采用Al(NO3)3-NaNO2法,精确称取芦丁标准品5mg,放于25mL容量瓶中,溶于体积分数60%乙醇溶液中,定溶至刻度,配成0.2mg/mL芦丁标准溶液。分别取0、1、2、3、4、5、6mL标准溶液于25mL容量瓶中,以蒸馏水补足至6mL,加质量分数5%亚硝酸钠溶液1mL,放置6min;加质量分数10%硝酸铝溶液1mL,放置6min;再加质量分数10%氢氧化钠溶液10mL,体积分数60%乙醇定容,摇匀,放置15min,于510nm下测定吸光度,以芦丁质量浓度x/(μg/mL)为横轴,以吸光度(A)为纵轴绘制标准曲线,见图1,得回归方程为A=0.0083x+0.0052,R2=0.9992。
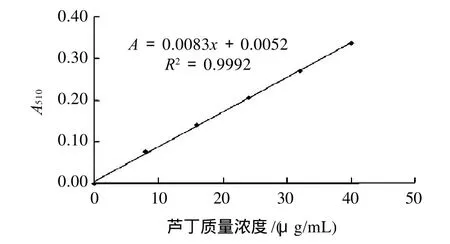
图1 芦丁标准曲线Fig.1 Standard curve of rutin
2.2 单因素试验
2.2.1 纤维素酶添加量对黄酮提取率的影响
准确称取6份1.00g软枣猕猴桃茎样粉,加入10mL pH4.0的磷酸缓冲液,分别按每克样粉100~600U的纤维素酶作为作用酶,于45℃作用1h,沸水浴灭酶后微波辅助提取,测定其中黄酮质量浓度,计算提取率,结果见图2。
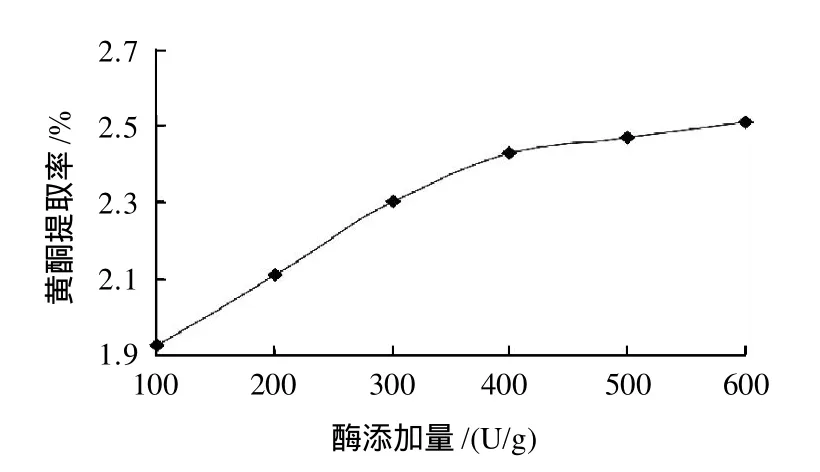
图2 加酶量对黄酮提取率的影响Fig.2 Effect of cellulose concentration on extraction rate of flavonoids
由图2可知,随着纤维素酶的添加量的增加,软枣猕猴桃茎黄酮的提取率增大,当加酶量达到400U/g后,黄酮的提取率随着加酶量的增加没有明显提高,综合经济因素考虑,选择酶的添加量为400U/g时为适宜的酶的添加量。
2.2.2 pH值和作用温度对黄酮提取率的影响
其余条件同2.2.1节,每份软枣猕猴桃茎样粉添加400U/g的纤维酶,研究不同pH值对黄酮提取率的影响,结果见图3。
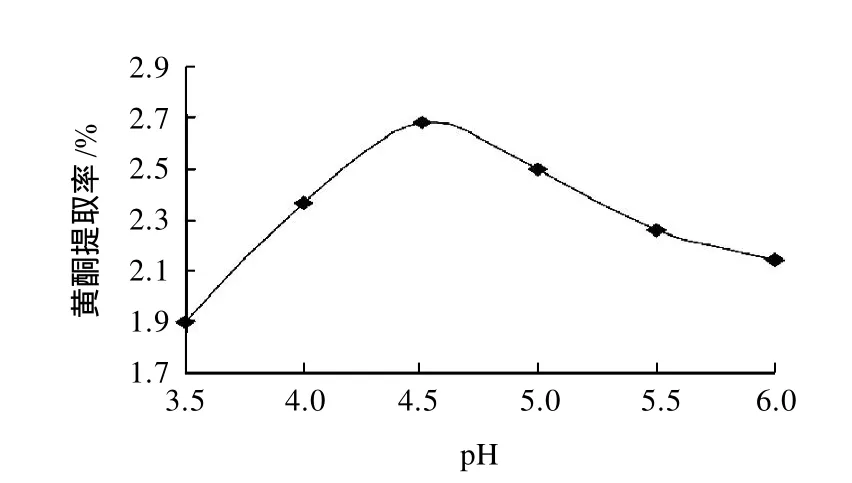
图3 pH值对黄酮提取率的影响Fig.3 Effect of pH on extraction rate of flavonoids
由图3可知,pH值和作用温度对软枣猕猴桃茎中黄酮提取率有明显影响。当pH值由3.5升到4.5时,黄酮的提取率迅速增大,而当pH值断续增大时,黄酮提取率反而开始下降,分析原因是每种酶类物质都有其最适的作用pH值,当pH值为4.5时,处于纤维素酶的最佳作用pH值区间(4.0~6.0)里,能够发挥纤维素酶的最大活力,使之最大限度作用于细胞壁纤维素;因此,纤维素酶在pH 4.5时酶解的效果较好。
2.2.3 作用温度对黄酮提取率的影响
其余条件同2.2.2节,在pH4.5的条件下,研究不同温度对黄酮提取率的影响,结果见图4。
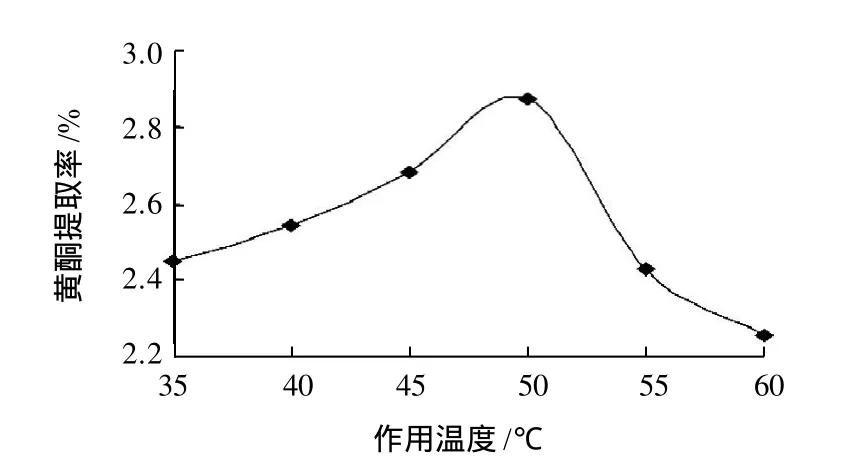
图4 作用温度对黄酮提取率的影响Fig.4 Effect of hydrolysis temperature on extraction rate of flavonoids
由图4可知,随着作用温度的提高,软枣猕猴桃茎黄酮提取率逐渐增大,但当温度高于50℃后,其提取率开始下降,这是因为当温度上升到50℃时,纤维素酶达到了最适的作用温度,而温度再高则使蛋白质变性,从而影响了酶的活性[10]。
2.2.4 酶解时间对黄酮提取率的影响
其余条件同2.2.3节,研究50℃条件下,不同酶解时间对黄酮提取率的影响,结果见图5。
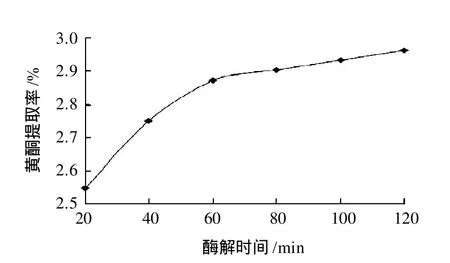
图5 酶解时间对黄酮提取率的影响Fig.5 Effect of hydrolysis time on extraction rate of flavonoids
由图5可知,随着酶解时间的延长,软枣猕猴桃茎黄酮的提取率在不断的提高,但是60min后,黄酮的提取率趋于稳定,没有显著的变化,因此从节省时间,降低成本的角度考虑,60~80min为适宜的提取时间。
2.3 响应面优化试验
2.3.1 试验设计及结果
以单因素试验结果为基础,采用Box-Behnken设计法进行试验设计[8],并以上述四个因素为自变量,软枣猕猴桃茎黄酮提取率(Y)为响应值,设计了四因素三水平共27个试验点的响应面分析试验,其因素水平编码值见表1,结果见表2。

表1 响应面试验因素和水平编码值Table 1 Coded values and corresponding real values of the optimization parameters tested in response surface analysis
将表2所得的试验数据采用Minitab统计软件进行回归分析,四个因素经过拟合得到以黄酮提取率(Y)为目标函数的二次回归方程:

表2 Box-Behnken试验设计及结果Table 2 Box-Behnken experimental design and results for response surface analysis
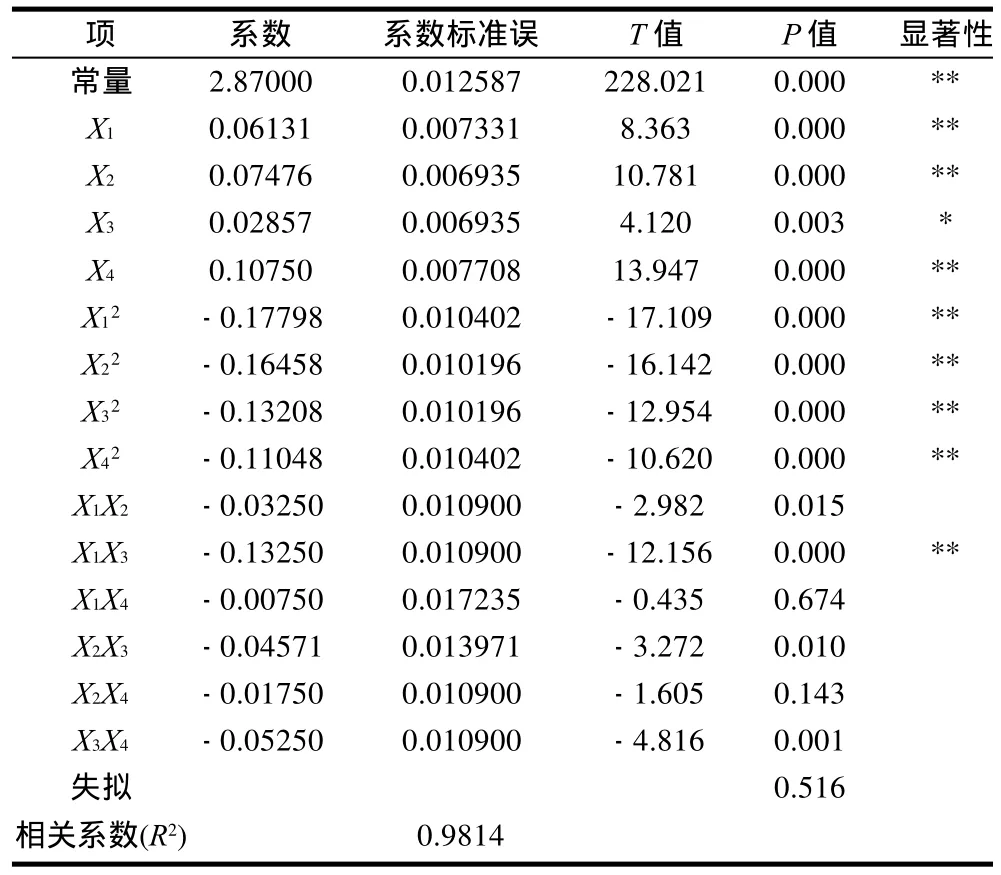
表3 回归系数及显著性检验Table 3 Regression coefficients and their significance in the fitted regression model
由表3可看出,作用温度对提取率影响显著(P<0.05),纤维素酶的添加量、酶解时间和pH值对黄酮类化合物的提取率影响极显著(P<0.001)。响应回归模型(P<0.001),达到了极显著水平,说明该方程能够正确反映软枣猕猴桃茎黄酮提取率与各因素之间的关系。失拟项P=0.516>0.05,不显著,说明本试验无其他因素的显著影响,方程对试验拟合良好,试验误差小。相关系数R2=0.9814,表明有98.14%的数据可以用此回归模型来解释。
2.3.2 响应面分析
利用Minitab软件即可以作出两因素交互作用的响应曲面图及其等高线图,见图6。


图6 各因素交互作用对黄酮提取率的影响Fig.6 Response surface and contour plots for the effects of cellulose dose, extraction temperature and bydrolysis time on extraction rate of flavonoids
从图6A可以看出,等高线沿纤维素酶的添加量轴向变化较作用温度轴向变化相对密集,曲面较陡,说明纤维素酶的添加量对黄酮提取率的影响较显著,并且在纤维素酶的添加量为300~400U/g时,黄酮的提取率受影响较敏感。从图6B可以看出,等高线沿酶解时间轴向变化相对密集,而沿作用温度轴向变化相对稀疏,说明在酶解时间与作用温度交互作用的情况下,酶解时间较作用温度对响应值的影响较大,随着酶解时间和作用温度的增大,黄酮的提取率先快速提高后又缓慢降低。从图6C可以看出,在pH值较大范围内均可以得到较大的响应值,等高线沿pH值轴向变化密集程度略大于作用温度轴向方向,说明在pH值对响应值的影响比作用温度影响显著。从图6可以看出,三组交互作用的等高线图都呈椭圆形,说明以上三组交互作用都很强,影响显著,图6A曲面最陡,说明纤维素酶的添加量与温度的交互作用对黄酮提取率的影响最显著。
2.2.3 最佳工艺条件的确定
通过软件Minitab分析,得出最优的提取工艺条件为纤维素酶的添加量438.38U/g、酶解时间63.83min、作用温度49.44℃、pH4.74,此时软枣猕猴桃茎黄酮的提取率达到极值为2.91%。为检验结果的可靠性,考虑实验室试验条件,采用纤维素酶的添加量438U/g、酶解时间64min、作用温度49℃、pH4.7的修正条件进行平行试验,结果得出软枣猕猴桃茎黄酮的实际提取率为2.89%,与理论预测值基本吻合,因此,响应面模型具有可行性。
3 结 论
在单因素试验的基础上,采用响应面法对纤维素酶-微波辅助法提取软枣猕猴桃茎黄酮类化合物的工艺条件进行了优化,研究发现作用温度对提取率影响显著,纤维素酶的添加量、酶解时间和pH值对黄酮类化合物的提取率影响极显著;在因素交互作用中,纤维素酶的添加量与温度的交互作用最显著。优化后的最佳工艺条件为纤维素酶的添加量438U/g、酶解时间64min、作用温度49℃、pH4.7,此条件下软枣猕猴桃茎黄酮提取率为2.89%。
[1] 朴一龙, 赵兰花. 软枣猕猴桃研究进展[J]. 北方园艺, 2008(3): 76-78.
[2] TAKANO F, TANAKA T, TSUKAMOTO W, et al. Isolation of (+)-catenin and (-)-epicatenin from Actinidia arguta as bone marrow cell proliferation promoting compounds[J]. Planta Med, 2003, 69 (4): 321-326.
[3] 曾佑炜, 赵金莲, 彭永宏. 黄酮的吸收和代谢研究进展[J]. 中草药,2008, 39(3): 460-464.
[4] CHOISANG W. Antioxidative activity of flavonoids in persinmon leaves[J]. Food and Biotechnololgy, 1996, 5(2): 119-123.
[5] HABTEMARIAM S. Flavonoids as inhibitors or enhancers of the cytotoxi city of tum or Necris is factwrain L~929 tum or cells[J]. Journal of Natural Products, 1997, 60(8): 775-778.
[6] HU Changqi, CHEN Ke, SHI Qian, et al. Anti-AID sagents, 10, acacetin 7-O-β-D-galactopyranoside, an anti-HIV principle from chrysanthemum morifolivm and a structure activity correlation with some related flavonoids[J]. Journal of Natural Products, 1994, 57(1): 42-51.
[7] 刘晓光, 毛波, 胡立新. 酶解法提取山楂黄酮的工艺[J]. 食品研究与开发, 2010, 31(8): 56-59.
[8] PAN Xuejun, LIU Huizhou, JIA Guanghe, et al. Microwave-assisted extraction of glycyrrhizic acid from licorice root[J]. Biochemical Engineering Journal, 2002, 5(7): 173-177.
[9] 马长雨, 杨悦武, 郭治昕, 等. 微波萃取在中药提取和分析中的应用[J]. 中草药, 2004, 35(11): 附 7-附 9.
[10] 国家药典委员会.中华人民共和国药典[M]. 北京: 化学工业出版社,2000: 553.
[11] 孙宁宁. 长白山野生软枣称猴桃的成分分析及保鲜研究[D]. 长春: 吉林农业大学, 2007.
[12] 曾柏全, 周小芹, 解西玉. 纤维素酶-微波法提取脐橙皮橙皮苷工艺优化[J]. 食品科学, 2010, 31(4): 85-89
[13] 姜国芳, 王小东, 朱霞萍, 等. 南瓜茎黄酮及多糖的微波辅助联合提取工艺[J]. 食品与发酵工业, 2009, 35(7): 171-173.
[14] 姚超, 于海宁, 阮晖, 等. 酶解结合超声波辅助技术提取纯化菊米总黄酮[J]. 食品科学, 2010, 31(6): 48-51.
[15] 杨文雄, 高彦祥. 响应面法及其在食品工业中的应用[J]. 中国食品添加剂, 2005(2): 68-71.
Optimization of Cellulase Pretreatment for Microwave-Assisted Extraction of Flavonoids from Actinidia arguta Stem
ZHANG Chun-hong,XU Ning,WU Shuang,LIU Chang-jiang*
(College of Food, Shenyang Agricultural University, Shenyang 110866, China)
Cellulase pretreatment before microwave-assisted extraction of flavonoids from Actinidia arguta stem was optimized by response surface methodology. One-factor-at-a-time experiments were performed to select appropriate levels of enzyme dose, hydrolysis time, temperature and pH. Further, a mathematical model was built and subjected to variance analysis. The optimal cellulase hydrolysis conditions were determined as follows: the optimal enzyme dose was 438 U/g for 64 min of hydrolysis at 49 ℃ and pH 4.7. Under these conditions, the extraction rate of flavonoids was up to 2.89%.
Actinidia arguta stem;flavonids;cellulose;microwave;response surface methodology
R284.2
A
1002-6630(2012)08-0024-05
2011-04-11
农业部公益性行业科研专项(200903013)
张春红(1968—),女,副教授,博士,主要从事植物蛋白质、酶工程研究。E-mail:helloxuning@sina.com
*通信作者:刘长江(1955—),男,教授,博士,主要从事食品生物技术研究。E-mail:liucj597@sohu.com
