乙型肝炎卡介苗联合疫苗免疫豚鼠及小鼠的病理学研究
2012-10-25赵晓青李继宏周长军赵亚力
蔡 岩,赵晓青,李继宏,周 捷,周长军,赵亚力,惠 琦*
(1.长春生物制品研究所有限责任公司,吉林 长春 130062;2.吉林亚泰生物药业股份有限责任公司,吉林 长春 130033)
据卫生部公布的我国法定传染病疫情概况显示,近十年乙型肝炎和肺结核的发病数一直位居乙类传染病之首,是长期以来严重影响国民公共健康的传染病。因此,预防乙型肝炎和结核病,仍是我国一项长期而艰巨的任务。卡介苗优化乙型肝炎疫苗的免疫应答作用已见报道[1-2]。为检查乙型肝炎卡介苗联合疫苗(简称HBV-BCG联合疫苗)中乙肝表面抗原(简称HBsAg)是否存在促使卡介苗(简称BCG)毒力增强的潜在因素,即HBsAg能否使BCG引起的良性免疫病理反应,演变为恶性化的结核性病变,本文系统观察了皮内注射用HBV-BCG联合疫苗皮下免疫豚鼠的毒性病理损伤,并比较了HBV-BCG联合疫苗与单价BCG接种小鼠局部皮肤的毒性反应及可逆性变化,为HBV-BCG联合疫苗临床前安全性评价提供病理资料。
1 材料与方法
1.1 材料
1.1.1 疫苗 BCG:批号 20021225,规格 10人份/支;HBV-BCG联合疫苗:批号20021208,规格HBsAg 10 μg 和 BCG 0.05 mg/人份;冻干保护剂0.2 mL/支。保存条件4℃,均为长春生物制品研究所试制。
1.1.2 豚鼠 18只,体重350~400 g,雌雄各半。长春生物制品研究所实验动物室提供,试验前每只豚鼠的PPD试验结果均为阴性。
1.1.3 BALB/c小鼠 60 只,体重 14 ~15 g,雌雄各半,长春生物制品研究所实验动物室提供,试验前所有小鼠的PPD试验结果均为阴性。
1.2 方法
1.2.1 动物分组与处理 18只豚鼠分为3组,每组6只。设空白对照组、BCG免疫组和HBV-BCG联合疫苗组,空白对照组未接种任何材料;BCG组于腹部左侧腹股沟皮下接种BCG 50人份/只(1 mL),HBV-BCG联合疫苗组于腹部左侧腹股沟皮下接种 HBV-BCG联合疫苗 50人份/只(1.25 mL),上述3组动物观察至42天全部活杀。60只小鼠分为3组。设对照组6只、BCG组和HBVBCG联合疫苗组各27只。对照组于腹部皮内接种冻干保护剂0.2 mL/只,1次;BCG免疫组于腹部皮内接种BCG 0.1 mL/只,1次;HBV-BCG联合疫苗组于腹部皮内接种HBV-BCG联合疫苗0.1 mL/只,1次。上述3组小鼠分别于接种后观察至第 3、5、7、9、11、15、20、25、30 天各活杀 3 只。
1.2.2 大体剖检及病理组织学观察 各组动物按计划系统解剖,经肉眼检查胸腔、胸膜、双肺各叶、心包膜、心、腹腔、腹膜、大网膜、肝、脾、胰、肾、肾上腺、颈淋巴结、肺门淋巴结、肠系膜淋巴结、接种局部皮肤及左右侧鼠蹊部淋巴结、生殖器、胃、肠和脑等。豚鼠从肺、肺门淋巴结、肝、脾、接种局部皮肤、左右侧蹊部淋巴结、肠系膜淋巴结等部位取材。小鼠从接种局部皮肤取材。将上述选取的组织块固定于4%中性甲醛液中,常规病理制片,HE染色,病理组织学观察和显微照相。
2 结果与分析
2.1 豚鼠大体剖检
空白对照组豚鼠体表和各脏器组织均未见异常。BCG组有4只豚鼠(4/6)接种局部皮肤可见脓疡,HBV-BCG联合疫苗组有3只豚鼠(3/6)接种局部皮肤可见脓疡,BCG组和HBV-BCG联合疫苗组大体剖检各脏器组织经肉眼检查均未见明显异常及差异,也未见结核性病灶。
2.2 豚鼠病理组织学观察
2.2.1 空白对照组 肺、肺门淋巴结、肝、脾、左右侧鼠蹊部皮肤、左右侧鼠蹊部淋巴结及肠系膜淋巴结等脏器组织结构均未见异常。
2.2.2 BCG组与HBV-BCG联合疫苗组 其接种疫苗局部及各脏器的病理改变相似,未见明显差异,故合并描述。
①接种局部皮肤:主要表现以增生为主的炎症改变,形成以巨噬细胞和类上皮细胞增生为主的肉芽肿。在接种局部的真皮层、皮下组织乃至肌层,可见大量密集的巨噬细胞及多少不等的类上皮细胞增生,形成特征性肉芽肿,在肉芽肿内可散在多少不等的嗜中性粒细胞、单核细胞及淋巴细胞浸润。肉芽肿的周边部也见上述相同的炎性细胞浸润及大量纤维组织增生包绕。在上述巨噬细胞、类上皮细胞肉芽肿内可见由嗜中性粒细胞形成的小脓肿;或者由郎罕氏巨细胞、巨噬细胞及类上皮细胞构成的小肉芽肿(图1)。上述肉芽肿内未见干酪样坏死,或者转向恶性化的结核性病变。在上述肉芽肿表面的表皮可呈现局灶性增生,或者坏死脱落形成局灶性小溃疡,溃疡边缘表皮增生明显。
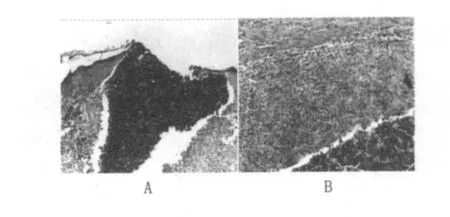
图1 豚鼠皮肤肉芽肿(HE×50)Fig.1 Guinea pig skin granuloma
②左、右侧蹊部淋巴结:淋巴结皮质内可见多少不等巨噬细胞增生,有的形成以巨噬细胞为主的肉芽肿,肉芽肿内可见郎罕氏巨细胞(图2)。有的巨噬细胞肉芽肿可互相融合形成大片肉芽肿。除上述之外,皮质内的淋巴滤泡有不同程度增生,生发中心活跃、扩大,尤其副皮质区T淋巴细胞增生明显,使副皮质区增宽。

图2 豚鼠蹊部淋巴结皮质肉芽肿(HE×50)Fig.2 Guinea pig lymph node granuloma
③肺门淋巴结和肠系膜淋巴结:皮质内的淋巴滤泡及副皮质区也见与蹊部淋巴结相似的改变,但改变程度轻于后者。皮质内巨噬细胞轻度增生(图3)。

图3 豚鼠肺门淋巴结皮质内巨噬细胞轻度增生(HE×50)Fig.3 Guinea pig pulmonary hilar lymph node cortex in mild hyperplasia macrophage
④其他脏器改变:肺内可见非特异性局限性慢性炎症细胞浸润,这种改变也见于对照组豚鼠,故它与疫苗的相关性尚不清楚;肝、脾及其余各脏器均未见与疫苗相关的病理改变。
2.3 小鼠大体剖检
对照组小鼠体表和各脏器组织均未见异常。BCG组有1只小鼠(1/27)接种局部皮肤可见脓疡,其余小鼠体表均未见异常;HBV-BCG联合疫苗组有6只小鼠(6/27)接种局部皮肤可见脓疡,其余小鼠体表均未见异常;BCG免疫组和HBVBCG联合疫苗组小鼠各脏器组织未见明显异常及差异,均未见结核性病灶。
2.4 小鼠病理组织学观察
2.4.1 对照组 6只小鼠接种局部皮肤组织均未见异常。
2.4.2 BCG组及 HBV-BCG联合疫苗组 该2组在接种局部皮肤的病变相似,故合并描述。
①早期局部皮肤病变(接种BCG、HBV-BCG联合疫苗3~9 d):真皮层、皮下组织及肌层均呈现明显非特异性炎症反应,表现以嗜中性粒细胞和单核细胞为主炎性细胞浸润,其间尚见嗜中性粒细胞性小脓肿形成,此种非特异性炎症反应在7 d以后逐渐吸收,趋向减弱。此期有部分小鼠表皮、真皮层乃至皮下组织可见局灶性坏死,坏死的表皮或真皮浅层脱失形成溃疡,溃疡面可见脓性渗出物;溃疡边缘的表皮增生(图4)。
②中期局部皮肤病变(接种BCG、HBV-BCG联合疫苗11~25 d):真皮层、皮下组织及肌层的非特异性炎症逐渐被吸收减轻,病灶趋于局限化。此期在接种局部皮肤表现以增生为主的病变,形成特异性巨噬细胞及类上皮细胞肉芽肿。在真皮层、皮下组织及肌层可见成片的巨噬细胞及类上皮细胞增生,形成类上皮细胞肉芽肿,在类上皮细胞肉芽肿中散在较多中性粒细胞及多少不等的单核细胞和淋巴细胞浸润(图5)。
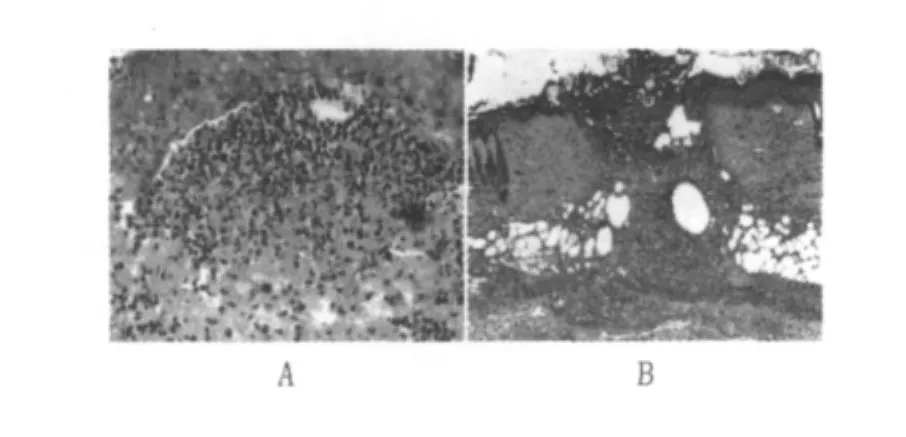
图4 小鼠皮肤非特异性炎症(5 d)(HE×50)Fig.4 Non-specific inflammation of mouse skin
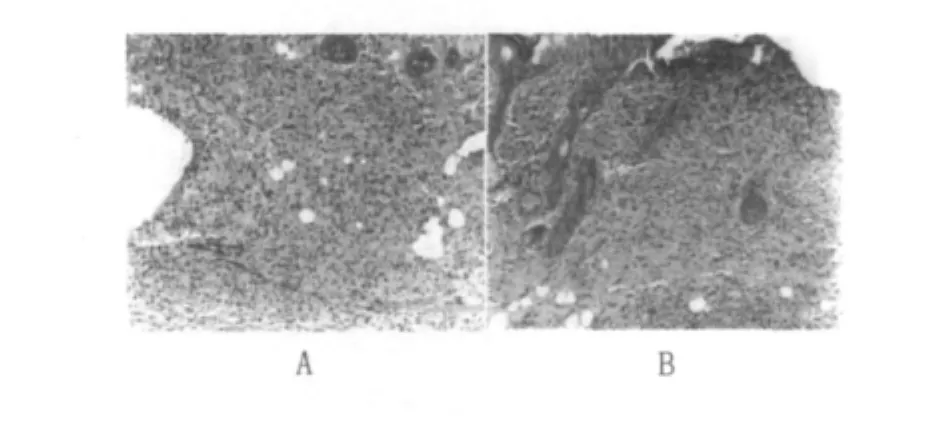
图5 小鼠皮肤特异性类上皮细胞肉芽肿(20 d)(HE×50)Fig.5 Specific epithelioid cell granuloma of mouse
③中期末局部皮肤病变(接种BCG、HBVBCG联合疫苗30 d):类上皮细胞肉芽肿内炎性细胞浸润明显消退,肉芽肿的范围也明显缩小(图6)。
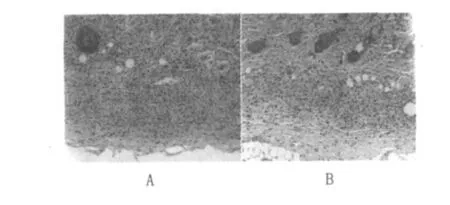
图6 小鼠皮肤肉芽肿内炎性细胞浸润明显消退(30 d)(HE×50)Fig.6 Mouse skin within the granulomatous inflammatory cell infiltration obviously extinction
3 讨论
由试验结果证实,空白对照组豚鼠及小鼠局部皮肤组织皆未见异常。豚鼠全身各脏器也未见异常。与空白对照组相比,BCG组和HBV-BCG联合疫苗组豚鼠及小鼠,在接种局部皮肤均发生非特异性炎症反应,以及由BCG引起的特异性巨噬细胞类上皮细胞肉芽肿。并且豚鼠局部淋巴结也见上述改变。
BCG组和HBV-BCG联合疫苗组,该2组在接种局部皮肤及局部淋巴结的病变完全相似,未见明显差异。在接种局部皮肤真皮层、皮下组织及更深层部位可见以巨噬细胞、类上皮细胞或者朗罕氏巨噬细胞增生形成肉芽肿。在该肉芽肿内可见多少不等的嗜中性粒细胞、单核细胞及淋巴细胞浸润,以及由嗜中性粒细胞形成的小脓肿。在上述肉芽肿内均未见干酪样坏死或者转向恶性化的结核性病变。在肉芽肿表面可见表皮呈现局灶性增生或坏死形成局灶性溃疡;肺门和肠系膜淋巴结皮质内的淋巴滤泡及副皮质区也见与接种局部淋巴结相似的改变,但改变程度轻于后者;肺内可见非特异性局限性慢性炎症细胞浸润(这种改变也见于对照组豚鼠);肝、脾及其余各脏器均未见与疫苗相关的病理改变。
BCG组和HBV-BCG联合疫苗组小鼠,该2组接种局部皮肤的病理改变相似,未见明显差异。即在接种疫苗的早期(3~9 d),接种局部皮肤产生非特异性炎症,在真皮深层、皮下组织及肌层表现嗜中性粒细胞和单核细胞浸润,部分小鼠可见嗜中性粒细胞性小脓肿形成及局灶性表皮坏死溃疡等改变;中期(11~25 d)接种局部皮肤表现以增生为主的特异性类上皮细胞肉芽肿形成;中期末(30 d)类上皮细胞肉芽肿内炎性细胞浸润明显消退,肉芽肿的范围也明显缩小。肉芽肿中心均未见干酪样坏死,或转向恶性化的结核性病变。这与Wilson Mayrink等[3]以卡介苗为佐剂给狗接种利什曼虫疫苗的结果类似。
BCG接种人体也会产生接种局部化脓性反应,此为卡介苗正常的接种反应,当皮内接种时形成的溃疡较浅,脓液容易排除体外,不会形成深部脓疡,当接种误入皮下或深处,脓液受皮肤阻拦,不易排出,会形成深部脓疡。人体接种卡介苗后2周左右局部出现红肿浸润,可随后化脓形成小溃疡,一般8 ~12周结痂[4]。
BCG或HBV-BCG联合疫苗免疫豚鼠及小鼠,在局部皮肤,以及豚鼠蹊部、肺门和肠系膜淋巴结所产生的病理改变,符合BCG引起的病变特点,具有BCG原发性病变特征。与结核性病变有本质区别。均未见干酪样坏死或转向恶性化的结核性病变[5-7]。
病理结果证实,HBsAg没有使BCG引起的良性免疫病理反应,演变为恶性化的结核性病变。说明HBsAg不具有促使BCG毒力增强的潜在危险,证实HBV-BCG联合疫苗与对照单价BCG相同具有可靠的安全性。
[1]崔玉梅,白新卿,裴晓春,等.卡介苗优化乙型肝炎疫苗、白百破三联疫苗的免疫应答作用[J].中国生物制品杂志,1994,7(2):80-81.
[2]金立杰,赵小琳,方艳秋,等.乙型肝炎疫苗-卡介苗联合疫苗细胞免疫的研究[J].中国生物制品杂志,2006,19(2):171-173.
[3]Mayrink W,Genaro O,Silva JC,et al.Phase I and II Open Clinical Trials of a Vaccine Against Leishmania chagasi Infection in Dogs[J].Mem Inst Oswaldo Cruz,1996,91(6):695-697.
[4]卢锦汉,章以浩,赵铠,等.医学生物制品学[M].北京:人民卫生出版社,1995:386-405.
[5]王志,于爱东,王春鹏,等.致敏豚鼠接种卡介苗后的临床反应及病理变化[J].中国生物制品学杂志,2000,13(3):183-184.
[6]Murray EH,John MK,Alan JH.Mycobacterial infections of animals:pathology and pathogenesis[J].Laboratory Animal Science,1995,45(4):334-351.
[7]国家药典委员会.中华人民共和国药典二部(2005版)[S].北京:化学工业出版社,2005:49-50.
