降雨过程中岩溶地下河微生物污染及其指示意义
2012-10-22贺秋芳邱述兰张兴波
贺秋芳,邱述兰,张兴波
(1.国土资源部、广西壮族自治区岩溶动力学重点实验室(中国地质科学院岩溶地质研究所),广西 桂林 541004;2.西南大学三峡库区生态环境教育部重点实验室,地理科学学院,西南大学,重庆 400715)
岩溶水资源是解决西南地区人民群众饮水问题的重要来源,但近现代以来不合理的人类工农业活动带来的污染对西南岩溶地区的生态环境造成了不可估量的破坏。如何将地下水的勘察与污染防治相结合,需要国家和众多科学研究者共同努力,解决人类活动影响下的岩溶水系统演变规律,解决岩溶地下水勘查、试验、监测以及地下水污染治理的新技术和新方法。国外研究者专注于岩溶地下水微生物的运移和示踪研究,对地下水中的微生物群落进行选择性培养计数,根据其时空变化规律分析外来污染物的来源[1-2]及其对地下水生态系统的影响[3],并建立以微生物为指标的地下水生态评价体系[4-5]。原位或外来添加的微生物数量监测与高精度地下水化学示踪相结合,可了解微生物在地下水中的运移特征[6-7],从而推断微生物和其他污染物在地下水中的传播过 程[8],并据此选用相应的防护措施[9-10]。 基于16Sr DNA的地下水微生物基因图谱分析对比[11]和FISH[12]可以直接了解地下水水系之间的联系,并确定污染物的来源。底物添加和相应的微生物活性监测可了解不同微生物在地下水中的活性,从而确定污染物对微生物和地下水生态系统的影响[13],以及微生物对污染物的降解过程[14]。作为地下水污染物,地下水中有害或潜在有害微生物[15]和SIP微生物[16]的直接监测可以直接了解地下水中的微生物和污染物的运移/降解过程。但国内对岩溶地下水的微生物研究仅停留在卫生学普查的层面,缺乏系统研究。本文以重庆青木关为例,高密度检测暴雨过程中地下河微生物的动态变化过程,结合地下水水化学指标和岩溶水系统运移特征,分析微生物在岩溶地下河中的污染和运移过程,了解岩溶地下水的微生物污染状况及运移特征,为修复岩溶地下水环境提供科学依据。
1 研究区概况
青木关岩溶槽谷区为典型的岩溶槽谷区,区内岩溶管道和裂隙发育,地表水通过岩溶管道和裂隙进入青木关地下河,纵向穿过整个岩溶槽谷,从南端姜家泉排泄出来,汇入青木河。区内主要为农业污染、人类生活污水及牲畜粪便污染。最近几年的监测表明,由于人类活动的加剧,地下水污染从以化肥污染为主向化肥和粪便复合污染转变,地下水水质恶化加剧。按照青木关槽谷区的土地利用情况(图1),水田和旱田中均使用化肥和农家肥,在岩溶水系统中通过落水洞和裂隙进入地下河造成地下河污染。2010年以后,地下河中游大木水窝洼地简称跑马场,产生的粪便可能引起地下河中粪便污染。
2 取样与检测方法
本研究于2011年5月初在青木关暴雨期间对青木关地下河出口的水化学和微生物指标进行取样。其中5月1日至5月6日每2 h取样1次,其后每6 h取样1次。

图1 青木关地质简图
(1)野外监测:p H、电导率、水温采用德国 WTW公司或美国HACH公司生产的全自动水质分析仪检测采用野外便携式试剂盒检测,水位使用。
(3)金属离子:Na+、K+、Mg2+使用洁净采样瓶,润洗2次后不留空气,采集足量样品,加适量1∶1 HNO3溶液,调水样p H值<2,以防止金属离子吸附。所有金属离子采用PE公司2100DV型号的ICP-OES检测(精度0.001 mg/L)。
(4)微生物:微生物采样使用专用微生物采样袋(美国,Brand),采集样品后4~8℃低温保藏,24 h内使用滤膜法检测微生物指标(滤膜为美国Millipore生产的灭菌一次性滤膜,0.45μm)。其中总细菌(Total coliform)数使用PCA培养基,总大肠菌群(Total e.coli)使用品红亚硫酸钠培养基,粪大肠菌群(Fecal coliform)使用 MFC培养基,所有培养基均使用青岛日水生产的干粉培养基。
3 研究结果与分析
3.1 暴雨过程分析
本次监测暴雨在2011年5月1日晚21:00左右开始,至次日中午12:00左右结束,其中降雨量最大发生于凌晨4:00至5:00之间,总计降水量为35.4 mm。根据降雨开始和结束时间,地下河出口姜家泉流量必将与滞后4~5 h,流量从38 L/s上升至197 L/s,最后回落至39 L/s。青木关岩溶地下河为管道型地下含水介质,地下流体为紊流流态。在暴雨期间,由于地表水经落水洞迅速进入地下河,并从出口排泄,造成暴雨期间地下河出口处流量发生暴起暴落。降雨开始6 h左右,地下河流量开始迅速上升,经2 h左右流量从38 L/s上升至峰值197 L/s。随后迅速衰减至138 L/s,而后缓慢回落,时间持续40 h以上,于5月4日凌晨回落至40 L/s左右。至5月8日,地下河出口流量维持于40 L/s左右不变。
3.2 离子动态变化过程
暴雨过程中,由于暴雨期间“活塞”效应、降雨稀释作用及人类活动污染,地下河中离子含量发生变化(图2、3)。5月1日至2日凌晨期间,首先由于“活塞”效应,从地表经落水洞进入地下河,将地下河中平水期储存的“老水”推出地下河出口。由于地下河中“老水”循环时间较长,各种离子和污染物在地下河水中滞留,因此水中离子含量略偏高。随着降雨量的增大,通过落水洞进入的地表水,带来大量污染物,进入地下河致使水中弹道率及阴阳离子含量大幅增加,电导率及阴阳离子的反应时间略滞后于流量达到峰值的时间。而后,流量仍处于较高水平,由于降雨的稀释效应,地下水中的离子含量出现下降,而后缓慢上升。但与以往研究中的降雨过程有所不同,本文监测中流量回落至40 L/s左右时,与降雨前基本一致,但地下水中的离子含量并持续增加,并超过暴雨过程中的最高含量。除Cl-、Na+、SO42-以外,其他所有离子含量均高于降雨过程中的最高浓度。
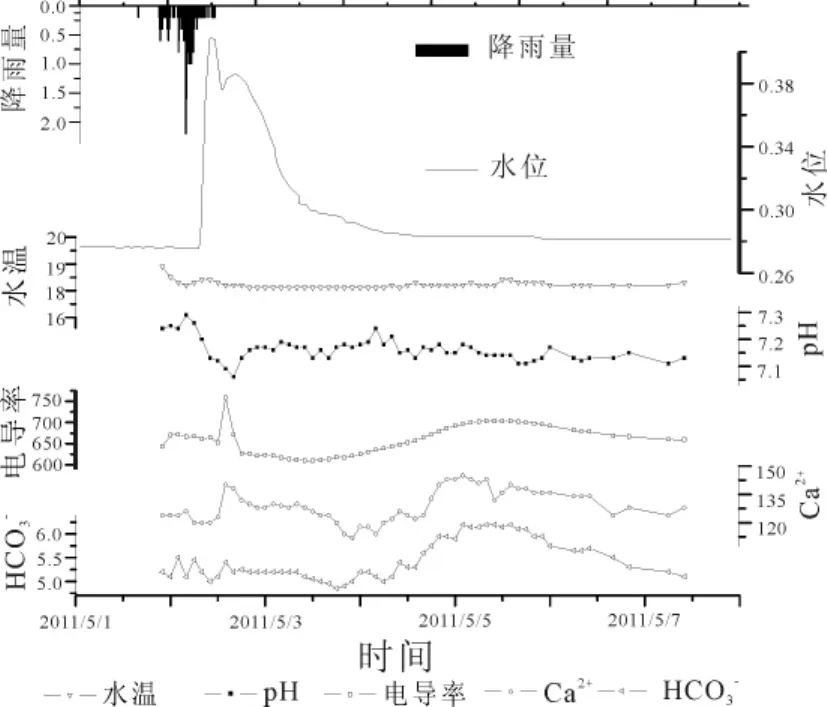
图2 地下河降雨期间相关水化学指标
3.3 微生物污染

图3 地下河降雨期间离子含量
3种微生物指标的监测表明,青木关地下河微生物含量偏高,其含量远高于WHO和《中国生活饮用水标准》中对饮用水源的规定。其中总细菌数的含量最高达到104cfu/m L,大肠菌群达到800 cfu/mL,粪大肠菌群含量也接近200 cfu/mL,见图4。远高于WHO和《中国生活饮用水标准》中规定的Ⅱ类水标准,即总细菌数不超过100 cfu/100 mL、大肠菌群和粪大肠菌群检出的标准。按照微生物数量,青木关地下河中的微生物数量已经超过《中国地下水水质标准》中规定的Ⅴ类水,青木关地下河存在严重的微生物污染和动物粪便污染,不应作为饮用和生活用水水源,但当地仍作为生活用水使用。

图4 地下河中微生物及相关指标含量变化
在降雨过程中,地下河中3种微生物数量都存在不同程度的增加,但不同阶段增加幅度有所不同。降雨初期,地下水水位尚未发生变化,但水中粪大肠菌群和总大肠菌群出现显著上升,达到100 cfu/m L以上,而总细菌数增加不多。而后随着水位上升,3种微生物指标数量显著增加,其中总细菌数含量增加甚至达10倍左右,而与其他水化学指标相比,微生物指标的上升变化早于其他阴阳离子,这与Laroche等[12]的研究结果一致,说明微生物指示因子对地下水污染的指示作用更及时。在降雨结束后,3种微生物指标都短暂地回复到较低水平。随后,与地下水中多数离子浓度变化类似,粪大肠菌群和总大肠菌群又出现上升过程,且总量超过降雨过程中的最高含量,而总细菌数则基本不变。
此外,DO和TOC的变化,某种程度上也能体现地下河中的微生物水平。DO含量越低说明水中好氧微生物和有机污染物含量越高,TOC则代表地下水中的总有机物含量。降雨过程中,TOC的变化与离子变化一致,说明降雨导致的地下河流量将地下河中储存和从落水洞进入地下的有机物冲出地下河出口。但DO变化不大,说明地下水流速较大,微生物在地下水中滞留时间较短,对水中的DO消耗较少。而降雨过后,因为微生物污染物仍然存在,而且微生物在地下水中停留时间较长,将水中DO消耗较多,由于大肠菌群对DO的消耗,使之出现明显的先下降后上升。
3.4 微生物污染的来源分析
大肠菌群主要来自动物粪便,但不同来源的大肠菌群生长温度不同,自然界中大肠菌群最适生长温度为25℃,37℃时仍可生长,44℃时不会生长。而来自人类肠道的粪大肠菌群最适生长温度37℃左右,如将培养温度升高至44.5℃仍可继续生长。在37℃培养生长的大肠菌群,包括在粪便内生长的大肠菌群称为“总大肠菌群”(Total coliform);在44.5℃仍能生长的大肠菌群称为“粪大肠菌群”(Fecal coliform)。大肠菌群和粪大肠菌群被统称为粪源微生物,通常作为粪便污染的微生物指示菌指示水体中粪便污染程度,结合其他相关数据指标可以指示水体中粪便污染的来源和途径。
在本研究中,降雨开始时,地下水水位并未增长,但微生物尤其粪源微生物数量大量增加,而其他阴阳离子及p H、TOC、DO等都未出现明显变化。结合地下河出口姜家泉附近居民有放养家禽的习惯,可推测此粪源微生物来自于周围居民蓄养的家禽,动物粪便极有可能分布于出口附近,在降雨开始便进入姜家泉。随后,降雨带来的流量使姜家泉3种微生物数量大大增加。与此同时,除外,所有水化学指标都随之发生较大变化。p H、温度等指标的变化如前所述完全符合降雨稀释效应带来的变化。而伴随地表水进入落水洞中的还有大量的污染物和土壤颗粒等,其中携带的各类细菌造成3种细菌数量都有大幅度提高。因此其主要来源为土壤微生物,总细菌数的增加远高于粪源微生物,而且粪大肠菌的数量增加并不如大肠菌群那么明显。
当流量恢复至降雨前的水平时,地下水粪源微生物及与微生物含量相关的DO、TOC都发生了改变,说明此时地下水中存在严重的粪便污染。同时,由于粪源污染物的数量在地下水总细菌所占比例极小,因此粪源微生物的增加未能对总细菌数量产生很大影响。Vanderhoff[17]研究发现,大肠杆菌进入土壤后在土壤中滞留休眠,并在一次较强的降雨过程下渗入洞穴和地下河中,且在土壤中滞留半年以上仍有活性。青木关大木水窝洼地于2011年初建成跑马场,产生的马粪集中填埋于当地土壤中,粪源微生物因此滞留于岩溶区土壤中。由于岩溶区土层薄对微生物及其他污染物的截留降解不充分,且青木关区域岩溶非常发育,存在大量管道裂隙,因此粪便污染物被雨水驱动进入地下河造成地下水污染。地下河中其他指标的变化也能印证这一分析。降雨结束后,来自于落水洞的流量减少,出口的大部分流量来自土壤渗透水,而且流速减缓,粪源微生物在土壤及地下河中的停留时间更长,因此地下水中DO消耗更多。粪便中K、P及有机物等含量丰富,因此地下水中TOC含量迅速增加。此外,粪源微生物生长分解有机物需要消耗N源,因此地下水中减少,而分解有机物产生的CO2有利于岩溶作用,因此地下水中Ca2+和都有不同程度增加。
4 结论
由于当地农业生产和人类活动,青木关岩溶地下河水质恶化,大肠杆菌超过国家水质标准1 000以上,造成了严重的污染。降雨期间对岩溶地下河中的水化学与微生物指标监测相结合,可以分析不同阶段地下水中微生物污染物的主要来源,对地下水污染的来源和过程进行示踪。
[1]Pronk M,Goldscheider N,ZopfiJ.Dynamics and interaction of organic carbon,turbidity and bacteria in a karst aquifer system[J].Hydrogeology Journal,2006,14(256):473-484.
[2]Neill H,Gutiérrez M,Aley T.Influences of agricultural practices on water quality of Tumbling Creek cave stream in Taney County,Missouri[J].Environmental Geology,2004,45(4):550-559.
[3]Stein H,Kellermann C,Schmidt SI,et al.The potential use of fauna and bacteria as ecological indicators for the assessment of groundwater quality[J].Journal of Environmental Monitoring,2010,12:242-254.
[4]Steube C,Richter S,Griebler C.First attempts towards an integrative concept for the ecological assessment of groundwater ecosystems[J].Hydrogeology Journal,2009,17:23-35.
[5]Grieblera C,Stein H,Kellermann C,et al.Ecological assessment of groundwater ecosystems-Vision or illusion?[J].Ecological Engineering,2010,36(9):1174-1179.
[6]Pronk M,Goldscheider N,ZopfiJ.Dynamics and interaction of organic carbon,turbidity and bacteria in a karst aquifer system[J].Hydrogeology Journal,2006,14(256):473-484.
[7]Becker MW,Metge DW,Samatha AC,et al.Bacterial transport experimants in fractured crystalline bedrock[J].Ground Water,2003,41(5):682-689.
[8]Maurice L,Atkinson TC,Williams AT,et al.Catchment scale tracer testing from karstic features in a porous limestone[J].Journal of Hydrology,2010,389(1-2):31-41.
[9]Maxwell RM,Welty C,Harvey RW.Revisiting the Cape Cod Bacteria Injection Experiment Using a Stochastic Modeling Approach[J].Environ Sci Technol,2007,41(15):5548-5558.
[10]Harvey RW,Metge DW,Barber LB,et al.Effects of altered groundwater chemistry upon the p H-dependency and magnitude of bacterial attachment during transport within an organically contaminated sandy aquifer[J].Water Research,2010,44(4):1062-1071.
[11]Pronk M,Goldscheider N,ZopfiJ.Microbial communities in karst groundwater and their potential use for biomonitoring[J].Hydrogeology Journal,2009,17:37-48.
[12]Laroche E,Petit F,Fournier M,et al.Transport of antibiotic-resistant Escherichia coli in a public rural karst water supply[J].Journal of Hydrology,2010,392(1-2):12-21.
[13]Marxsen J.Measurement of bacterial production in streambed sediments via leucine incorporation[J].FEMS Microbiology Ecology,1996,21(4):313-325.
[14]Istok JD,Humphrey MD,Schroth MH,et al.Single-well,push-pull test for in situ dermination of microbial activities[J].Ground Water,1997,35(4):619-631.
[15]Kelly WR,Panno SV,Hackley KC,et al.Bacteria contamination of groundwater in a mixed land-use karst region[J].Water Qual Expo Health,2009,1:69-78.
[16]Dumont MG,Murrell JC.Stable isotope probing linking microbial identity to function[J].Nat Re Microbiol,2005,3(6):499-504.
[17]Vanderhoff,Sean M,Multiple Storm Event Impacts on Epikarst Storage and Transport of Organic Soil Amendments in South-Central Kentucky[EB/OL].Masters Theses &Specialist Projects.2011,Paper 1128.http://digitalcommons.wku.edu/theses/1128.
