格列美脲盐酸二甲双胍复方片中格列美脲有关物质研究
2012-10-22尹静文宋丽明王杏林
尹静文 ,宋丽明 ,王杏林
(1.天津医科大学研究生院,天津300070;2.天津药物研究院,释药技术与药代动力学国家重点实验室,天津300193)
格列美脲盐酸二甲双胍复方片属于固定剂量组成的复方制剂,目前国内尚无上市品。临床研究证实,盐酸二甲双胍与格列美脲联合用药能有效控制血糖,并能分别降低盐酸二甲双胍与格列美脲的毒副作用[1-5]。因此开发该复方制剂对提供一种疗效确切、安全方便且副作用小的治疗糖尿病的药物显得十分重要。现有的国家药品标准[6-7],《美国药典》第34版[8]及文献报道[9-10]中,仅有对盐酸二甲双胍或格列美脲单一成分的质量控制方法。在格列美脲盐酸二甲双胍复方片有关物质研究中发现,由于盐酸二甲双胍量占比例较大,其色谱峰拖尾严重;且除由原料中引入的杂质外,还会产生一种特定杂质(本文中称为杂质X)。经试验验证,已有文献方法均不适合格列美脲盐酸二甲双胍复方片中格列美脲杂质的检测。鉴于此,有必要对格列美脲盐酸二甲双胍复方片中有关物质进行研究,以制定严格的质量控制标准,保证新研发的复方制剂质量的可控性,从而确保用药安全。
1 材料与方法
1.1 仪器 安捷伦1200高效液相色谱仪(美国安捷伦公司),Thermo Fishier LCQAdvantage Max离子阱液质联用仪,XS205型电子分析天平(梅特勒-托利多仪器有限公司),Anke TGL-16C离心机(上海安亭科学仪器厂),SK5200H超声波清洗器(上海科导超声仪器有限公司),FE20/EL20实验室pH计(梅特勒-托利多仪器有限公司)。
1.2 试药 格列美脲对照品(批号:100674-200901中国药品生物制品检定所);4-[2-[3-乙基-4-甲基-2-2氧-3-吡咯啉-1-甲酰氨基]乙基]苯磺酰胺基甲酸乙酯(命名为杂质1,批号:100781-200901中国药品生物制品检定所);4-[2-[3-乙基-4-甲基-2-2氧-3-吡咯啉-1-甲酰氨基]乙基]苯磺酰胺(命名为杂质2,批号:100675-200901中国药品生物制品检定所);格列美脲原料(含量:99.97%批号:GL2011021重庆赛维药业有限公司);格列美脲盐酸二甲双胍复方片(自制,规格:格列美脲1mg-盐酸二甲双胍 400mg,批号:GR-1,GR-2,GR-3);乙腈(色谱纯,天津市康科德色谱试剂公司);氨水(分析纯,天津市凯信化学工业有限公司);磷酸二氢钠(分析纯,天津市冈船化学试剂科技有限公司);纯净水(娃哈哈纯净水)。
1.3 方法
1.3.1 色谱条件 色谱柱:Agilent XDB C18column(4.6mm×250mm,5μm);流动相:磷酸盐缓冲液为6.4mmol/L磷酸二氢钠,用氨试液调pH至6.8,A相为乙腈-磷酸盐缓冲液=35∶65,B相为乙腈-磷酸盐缓冲液=65∶35,梯度洗脱条件见表1;柱温:35℃;流速:1.0mL/min;检测波长:228 nm;进样量:20μL。
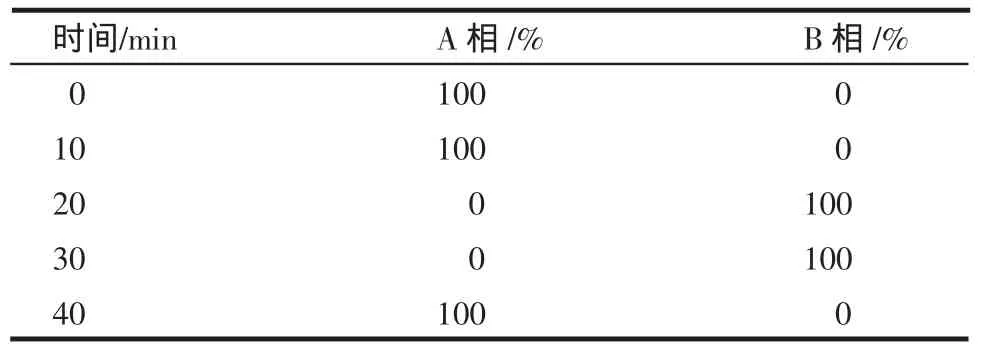
表1 HPLC梯度洗脱程序Tab1 Procedureof gradientelution by HPLC
1.3.2 溶液的配制
1.3.2.1 格列美脲对照溶液:取格列美脲对照品适量,精密称定,加乙腈溶解并定容,配成浓度为0.2mg/mL的溶液。
1.3.2.2 杂质贮备液:取杂质1、杂质2对照品适量,精密称定,加乙腈溶解并定容,配制成浓度均为0.2mg/mL的溶液。
1.3.2.3 杂质对照溶液:精密量取杂质贮备液,用乙腈稀释200倍,配制成杂质1、杂质2浓度均为1μg/mL的溶液。
1.3.2.4 供试品溶液:取供试品20片,精密称定,研细,精密称取适量(约相当于格列美脲1mg),置离心管中,精密加入5mL乙腈,15~20℃水温下,超声,摇匀,离心,取上清液作为供试品溶液。
1.3.2.5 格列美脲自身对照溶液:取供试品溶液用乙腈稀释200倍,配制成格列美脲浓度约为1μg/mL的溶液。
1.3.2.6 空白溶液:按处方量,取全辅料及盐酸二甲双胍粉末置离心管中,精密加入5mL乙腈,15~20℃水温下,超声,摇匀,离心,取上清液作为空白溶液。
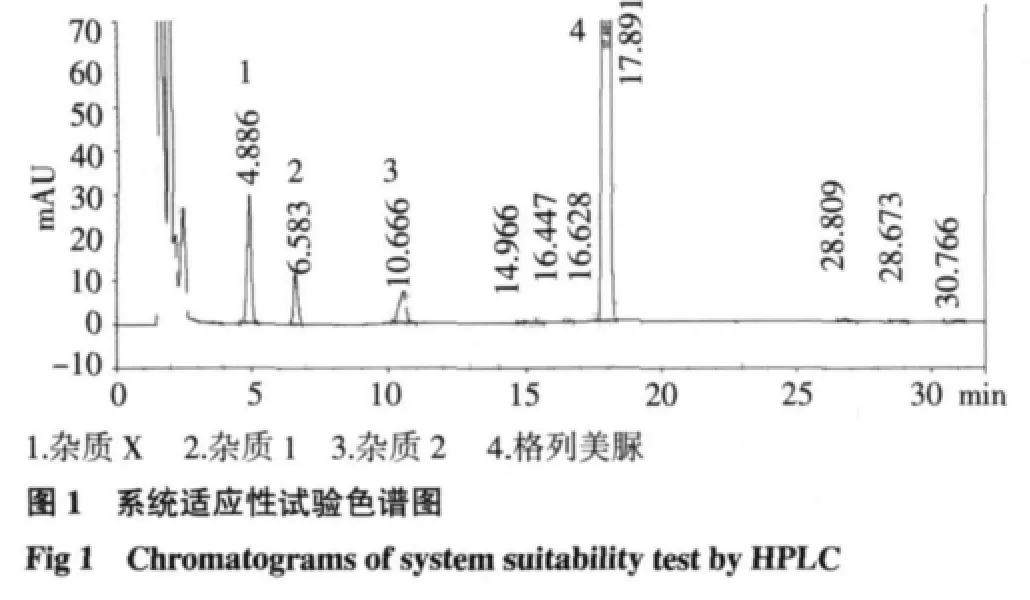
1.3.3 系统适应性试验 取供试品粉末适量(约相当于格列美脲10mg),加入25mL乙腈,15~20℃水温下超声,摇匀,离心,取上清液,60℃加热放置1 h后,取5mL置10mL容量瓶中,另加入杂质贮备液50μL,用乙腈稀释至刻度,作为系统适应性试验溶液,按“1.3.1”项下方法测定,记录色谱图。
1.3.4 方法学实验
1.3.4.1 强制降解试验及溶液稳定性试验:取供试品粉末适量,按“1.3.2.4”项方法配制成供试品溶液。将供试品溶液经以下条件处理:(1)酸:加0.1moL/L盐酸溶液适量,摇匀,放置0.5 h,用0.1moL/L氢氧化钠溶液中和,离心,取上清液测定。(2)碱:加0.1moL/L氢氧化钠溶液适量,摇匀,放置0.5 h,用0.1moL/L盐酸溶液中和,离心,取上清液测定。(3)氧化:加30%双氧水适量,摇匀,放置0.5 h,离心,取上清液测定。(4)光照:于4 000 Lx强度下照射3 h后测定。(5)加热:于60℃烘箱中放置0.5 h、1 h后取出,放至室温测定。(6)避光室温下放置1 h、3 h后测定。(7)避光冷藏放置3 h后测定。
1.3.4.2 标准曲线绘制:精密移取“1.3.2.1”项下格列美脲对照溶液 20、30、40、50、60、80、100 μL,至10mL量瓶中,用乙腈稀释至刻度,摇匀,制成格列美脲线性系列溶液。另精密移取“1.3.2.2”项下杂质贮备液 20、30、40、50、60、80、100 μL,至 10mL 容量瓶中,用乙腈稀释至刻度,摇匀,制成杂质线性系列溶液,按“1.3.1”项方法测定,记录色谱图及峰面积。
1.3.4.3 定量限及最小检出限试验:分别将格列美脲对照溶液和杂质贮备液稀释,在上述色谱条件下,按信噪比(S/N)为10∶1计算定量限,按信噪比(S/N)为3∶1计算最小检出限。
1.3.4.4 重复性试验:取供试品粉末适量6份(约相当于格列美脲 1mg),照“1.3.2.4”和“1.3.2.5”项下方法分别平行配制格列美脲供试品溶液和自身对照溶液各6份,另取“1.3.2.3”项下杂质对照溶液,按“1.3.1”项方法测定。按外标法计算已知杂质含量,按自身对照法计算未知杂质含量。
1.3.4.5 回收率试验:取供试品粉末适量(约相当于格列美脲10mg),加入25mL乙腈,15~20℃水温下超声,摇匀,离心,取上清液作为供试品贮备液。分别移取“1.3.2.2”项下杂质贮备液 40、50、60 μL 各3份到10mL量瓶中,分别加5mL供试品贮备液,用乙腈稀释至刻度,作为回收率溶液;按“1.3.1”项法测定。按外标法计算。
1.3.5 供试品测定 取GR-1、GR-2、GR-3批供试品,照“1.3.2.4”和“1.3.2.5”项下方法分别配制格列美脲供试品溶液和自身对照溶液,另取“1.3.2.3”项下杂质对照溶液,按“1.3.1”项下方法测定,按外标法计算已知杂质含量,按自身对照法计算未知杂质含量。
1.3.6 杂质X归属研究 将强制降解试验中热破坏1 h供试品溶液进行HPLC-MS检测,HPLC-MS条件为:流动相:0.1%醋酸缓冲液,用氨试液调pH至 4.0,A 相为乙腈-醋酸缓冲液=40∶60,B 相为乙腈-醋酸缓冲液=70∶30,梯度洗脱条件见表2;柱温:30 ℃;流速:0.4mL/min;离子化模式:ESI,分析模式:正离子模式;毛细管温度:250℃;喷雾电压:4.5 KV,毛细管电压:25 V;鞘气流速:35 arb,辅助气流速:20 arb。

表2 HPLC-MS梯度洗脱程序Tab2 Procedureof gradientelution by HPLC-MS
2 结果
2.1 系统适应性试验 系统适应性试验色谱图见图1,结果显示,格列美脲、杂质1、杂质2、杂质X分离度均大于2.0,按格列美脲峰计算理论塔板数不低于5 000,符合要求。
2.2 强制降解试验及溶液稳定性试验 试验结果见表3。结果表明,供试品溶液在酸、碱、氧化条件下基本稳定,在加热及长时间放置后杂质2、杂质X有较大程度增长。
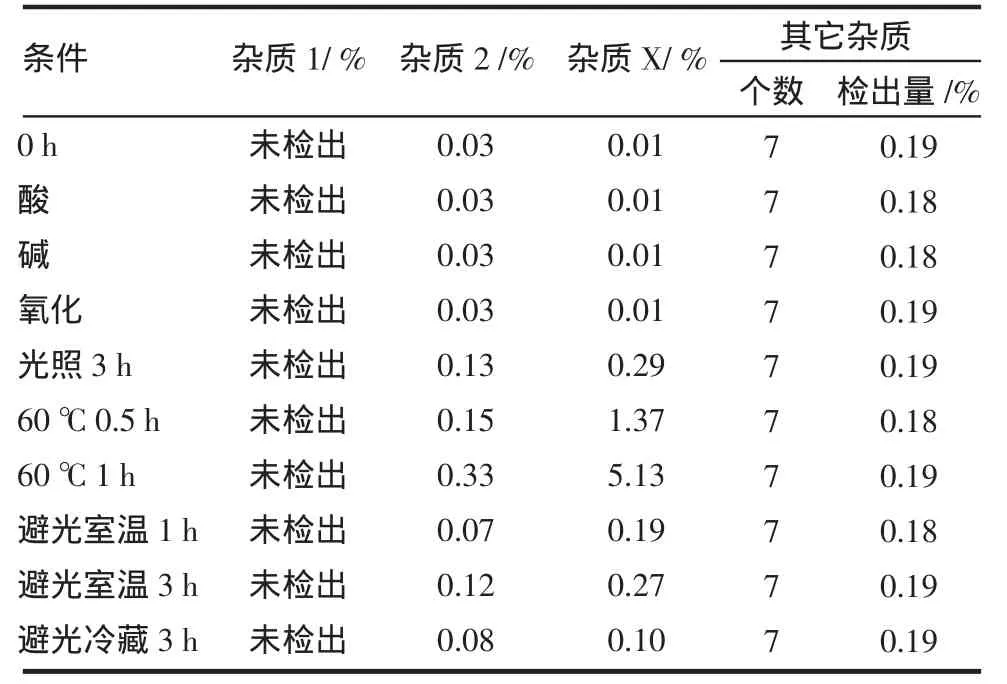
表3 强制降解试验及溶液稳定性试验结果Tab3 Forced degradation testing and solution stability testing results
2.3 标准曲线绘制 以峰面积A为纵坐标,以浓度C为横坐标(μg/mL),绘制标准曲线,得到格列美脲、杂质1、杂质2的线性回归方程(n=7):格列美脲:A=65 064 c+3 130.9 r=0.999 8 ;杂质 1:A=85 937 c-1 988.9 r=0.999 7;杂质 2:A=100 235 c-2 609.5 r=0.999 8。结果表明,格列美脲在0.41~2.22μg/mL,杂质1在0.42~2.51μg/mL,杂质2在0.45~2.04μg/mL的浓度范围内呈现良好的线性关系。
2.4 定量限及最小检出限试验 格列美脲、杂质1和杂质2的定量限分别为3.18、2.05和2.04 ng。格列美脲、杂质1和杂质2的最小检出限分别为0.955 、0.615 、0.612 ng。
2.5 重复性试验 杂质1未检出;杂质2含量为0.03%,RSD为0.55%;杂质X含量为0.01%,RSD为0.31%;其它杂质总和为0.19%,RSD为0.41%。符合药典规定,重复性良好。
2.6 回收率试验 杂质1、杂质2回收率分别为99.75%和99.81%,RSD分别为0.43%和0.61%(n=9)。
2.7 供试品测定 测定结果见表4。
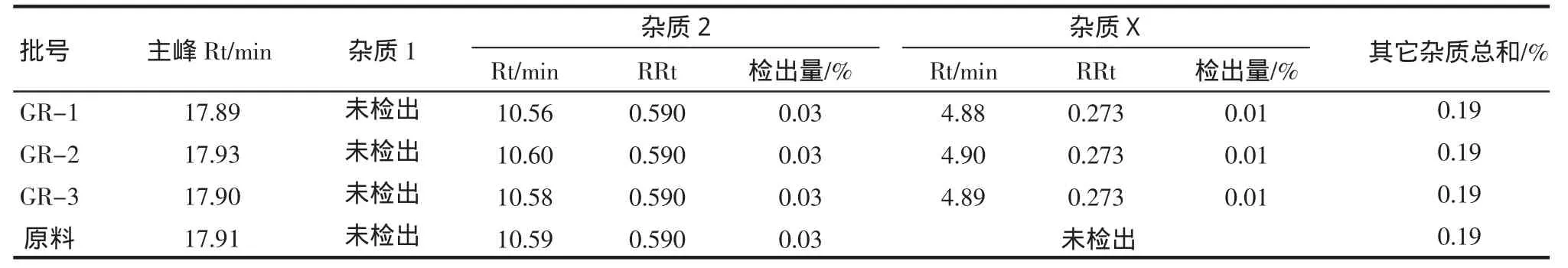
表4 供试品与格列美脲原料中格列美脲有关物质检查结果Tab4 Testing results for related substance
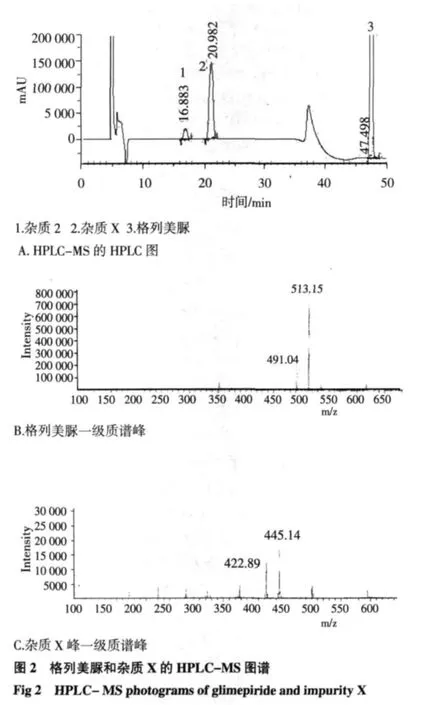
2.8 杂质X归属研究 格列美脲和杂质X的HPLC-MS图见图2。格列美脲分子量为491.04,杂质X分子量为422.89。
3 讨论
提取溶剂及提取条件的选择:格列美脲在乙腈中溶解性较好,在水中溶解性差,而盐酸二甲双胍在水中易溶,在乙腈中溶解性较差,为减少盐酸二甲双胍对测定的干扰,选择乙腈作为提取溶剂。经试验验证,乙腈作为溶剂,不干扰测定。由于格列美脲对热不稳定,故需控制超声温度,经试验验证,超声温度在15~20℃条件下,可控制杂质增长。
流动相的选择:根据《美国药典》(第34版)[8]格列美脲有关物质检测方法,流动相为6.4mmol/L磷酸二氢钠,用稀磷酸调pH至2.5~3.0,乙腈-磷酸盐缓冲液=50∶50。按该条件测定,格列美脲、杂质1和杂质2保留时间分别为28.12min、5.35min和4.16 min,但本复方制剂中由于盐酸二甲双胍量过大,色谱峰拖尾严重,保留时间为0~3.4min,且试验中发现,本复方制剂的新增杂质X,保留时间为3.68min,与杂质2无法达到基线分离,干扰杂质2的测定。故考虑通过改变缓冲液pH值和流动相比例,解决上述问题。通过试验发现:当缓冲液pH值调整至6.0~7.0 时,杂质 2 保留时间为 8.25~8.35min,杂质X保留时间为3.78~3.85min,杂质X与杂质2分离良好;当pH=6.8时,主峰对称性最好。当缓冲液pH=6.8,比例提高到65%时,杂质X保留时间为4.88min,杂质2保留时间为10.54min,盐酸二甲双胍及辅料峰保留时间为0~3.58min,三者达到良好分离。但该条件下,格列美脲保留时间过长,通过试验发现,随乙腈比例增加,主峰出峰时间明显缩短,当乙腈比例大于60%时,主峰出峰时间较适宜。因此考虑采用梯度洗脱方法解决此问题。经试验验证在“1.3.1”项色谱条件下,各杂质峰均能达到良好分离,主峰出峰时间适宜,杂质洗脱完全。
杂质X归属研究:复方制剂中新生杂质的来源可能为:(1)原料之间相互作用。(2)原辅料间相互作用。(3)制剂工艺及储存过程引发的降解产物。要对新生杂质进行归属和限度测定,需进行原料相容性试验、原辅料相容性试验、制剂工艺考察和稳定性考察[11]。本试验中分别按处方量将格列美脲原料药、格列美脲和盐酸二甲双胍原料混合物、格列美脲与辅料、供试品(GR1,GR2,GR3)放置于高温、高湿、强光下考察。结果发现,格列美脲与盐酸二甲双胍原料混合物,在高温条件下不稳定,除杂质2外,新增杂质X约为1.0%。而供试品在高温条件下放置后,杂质X增长远小于原料混合物。推测杂质X可能由格列美脲和盐酸二甲双胍原料间相互作用而产生,当通过制剂工艺减少两种原料的直接接触后,杂质X增长很小。根据HPLC/MS一级质谱检测的分子离子峰及碎片信息(图2),杂质X分子量为423。格列美脲酰胺键易断裂,断裂后分子量为352,而盐酸二甲双胍胍基易与其它部分断裂[12],胍基断裂后剩余部分分子量为71,由此进一步推测杂质X可能为格列美脲与盐酸二甲双胍原料相互作用结果。
综上所述,采用该色谱条件,复方制剂中各杂质均能有效分离,可用于复方格列美脲盐酸二甲双胍片中格列美脲有关物质,特别是杂质X,杂质2的控制。通过HPLC-MC检测,推测杂质X可能为格列美脲与盐酸二甲双胍原料相互作用的产物。
[1]徐秋,李生兵.格列美脲联合盐酸二甲双胍治疗初诊2型糖尿病 68例临床分析[J].检验医学与临床,2010,7(9):858
[2]姚晔.格列美脲联合盐酸二甲双胍对2型糖尿病疗效分析[J].药物与临床,2012,2(2):110
[3]王慧娟,张秉戟.格列美脲或瑞格列奈与二甲双胍联合治疗初发2型糖尿病 58例临床观察[J].中国社区医师,2011,13(24):45
[4]汪敏,高方,薛耀明,等.格列美脲联合二甲双胍短期内强化治疗对初诊2型糖尿病疗效的观察[J].南方医科大学学报,2011,31(3):564
[5]谭世平.格列美脲联合二甲双胍治疗2型糖尿病的成本-效果分析[J].中国药房,2012,23(4):351
[6]国家食品药品监督管理局.格列美脲[S].国家药品标准新药转正标准(第51册),2010:210-211
[7]国家食品药品监督管理局.格列美脲片[S].国家药品标准新药转正标准(第51册),2010:177-178
[8]美国药典委员会.格列美脲[S].美国药典(第34版),2011:2498-2498
[9]王维贤,高立军,魏君,等.高效液相色谱法测定格列美脲片含量及有关物质[J].科学技术与工程,2003,3(5):431
[10]魏君,王维贤,高立军,等.格列美脲原料药中有关物质及降解产物的研究[J].药物分析杂志,2003,23(3):207
[11]张震,张玉琥.化学药品复方制剂中有关物质的定性归属方法[J].中国新药杂志,2008,17(21):1898
[12]钟丽红,凌霄,孙华.HPLC-MS法检测某些降糖中药制剂中的双胍类及磺酰脲类化学药 [J].药物分析杂志,2008,28(10):1683
