临床化学体外诊断试剂(盒)产品命名现状及规范化研究
2012-10-19北京市药品监督管理局医疗器械技术审评中心100061赵阳张宏薛玲
北京市药品监督管理局医疗器械技术审评中心(100061)赵阳 张宏 薛玲
1 课题背景和目的
临床化学体外诊断试剂(盒)是指在全自动生化分析仪、半自动生化分析仪或分光光度计上检测人体液中与生命活动相关的化学物质,向临床提供有关诊断、治疗、病情观察、健康评估等信息的诊断试剂盒[1]。
随着近20年来,临床检验工作的全面开展,体外诊断试剂经历了快速发展的20年。尤其是临床化学体外诊断试剂,已经打破进口试剂产品的垄断局面,逐步进入了国内主流医院市场。全国临床化学体外诊断试剂的厂商已有近百家。随着“十二五”规划和“新医改”的推进,国产临床化学诊断试剂产品将进一步进入快速发展周期。与此同时,市售产品的规范化问题却突显出来,其中一个主要特征就是命名混乱。目前,不同厂商对产品的命名千差万别,相同产品在市面上可能出现几种名称,给监管和使用带来了极大的不便,也不利于行业的发展。
2007年,国家食品药品监督管理局发布了“体外诊断试剂注册管理办法(试行)”(以下简称“办法”)[2],其中规定了体外诊断试剂的产品名称一般可以由三部分组成:
第一部分:被测物质名称。
第二部分:用途,如诊断血清、测定试剂盒、质控品等。
第三部分:方法或原理,如酶联免疫方法、胶体金方法等。
但是,由于“办法”仅对命名的基本原则做出了比较笼统的规定,未对被测物名称、用途、方法(原理)分别针对性的给出具体的编写指南或规范,在“办法”颁布以后,还是出现了产品名称混乱的现象。特别是临床化学体外诊断试剂产品,由于检测项目众多、相同检测项目所使用的方法不一、新的检测项目和方法层出不穷、不同地区和医生的习惯存在差异等方面的原因,造成目前市场上的临床化学体外诊断产品在命名上混乱的问题相对比较突出,尤其针对方法学的命名,不同厂商对相同产品的命名存在差异的现象非常普遍(见表一)。对监督管理、临床使用等方面造成诸多的困扰和不便。
为了规范临床化学体外诊断试剂产品的名称和方法学,为临床化学体外诊断试剂产品的命名提供依据,特开展本课题研究。本课题研究通过调查研究14家国内外厂商的近千种产品的产品名称、预期用途和方法学,概括总结了名称命名不一致的现状,并初步分析了原因。在此基础上,结合国内外法规、标准、规范性文件等提出了规范临床化学体外诊断试剂名称的方法,并依据该方法给出了最常见产品的名称命名实例。本研究的最终目的是根据调研情况确定相应对策,从而促进行业内部相同产品名称的协调统一,进而促进整个行业的健康发展。
2 现状分析
本课题在调研之初收集到8家国内企业、6家外资企业共14家厂商的上千种产品的试剂盒名称、方法学、预期用途、反应原理等信息。最终,通过整理整合选取了临床常用的、4家以上厂家同时具备的产品进行统计分析,共涉及约100种项目。其中名称组成三部分(被测物、用途和方法)中第一部分(被测物)描述不一致的产品约有17种,占所分析产品数目的17%;第二部分(用途)描述不一致的情况较少,在统计的14家厂商中,只有两家不一致;第三部分(方法)不一致的情况较多,约有90项,占所分析产品数目的90%。
2.1 名称第一部分 被测物质名称存在不一致的产品共约17个。主要存在以下几方面不一致的情况:
2.1.1 产品名称描述不完全。如:核糖核苷酶、核糖核苷水解酶、核糖核苷酸水解酶。
2.1.2 被测物为离子的情况。如:氯(氯离子)镁(镁离子)钠 (钠离子)。
教师要想在大学思想政治教育中顺利引入“中国梦”思想教育,就需要不断完善思想政治教学的实践工作:一方面,定期组织大学生到革命圣地、爱国教育纪念馆等地方进行参观,让大学生在参观这些地方的过程中,对我国共产党有更深入的了解,进而提高自身民族责任感和爱国心〔14〕。另一方面,教师需要积极展开大学生社会调查工作,了解每一位大学生的具体情况,然后针对性为大学生安排社会实践课,让大学生在社会实践课中了解党的各项政策,从而在潜移默化中提高自身思想政治觉悟,养成为人民服务的观念。
2.1.3 其他(使用习惯原因)。如:D-3羟丁酸、β-羟丁酸。
2.2 名称第二部分 用途:不一致的情况较少。在调研的14家厂商中,有12家均以“测定试剂盒”命名,只有两家以“检测试剂盒”命名。
2.3 名称第三部分 方法或原理:这部分不一致的情况非常多,共约90个,占所分析产品数目的90%。通过进一步分析发现,方法学部分出现如此多不一致的情况主要有以下几个原因:
2.3.1 由于方法或原理的层次不同而造成不一致 临床化学体外诊断产品所有测定的原理都可以归结于使用基于朗伯-比尔定律的比色法。而对于酶类的测定大部分又是通过在340nm处连续监测紫外吸收光的速率变化进行测定的[3]。所以又出现了以连续监测法、速率法、酶法进行命名的产品。此外,每一个具体的测试项目的核心,都是由一组或多组底物与酶或与显色剂的发生生物化学反应而产生某种信号,从而进行监测,计算出待测物的浓度。所以,又出现了以具体反应物进行命名的方式。
由于法规中只要求以方法或原理命名,并未说明是什么层次的方法或原理,从而造成目前的现状是,同一款产品不同的厂家可能采用不同的层次的方法学和原理进行命名。比如碱性磷酸酶测定试剂盒,不同厂家的方法学名称就有连续监测法、比色法、酶法、速率法等等。由于命名方法学的层次不同而造成不一致的情况共有27项,约占所分析产品数目的30%。
2.3.2 由于使用国际组织的名称进行命名而造成的不一致 近年来,出于产品宣传等方面的考虑,一些厂商选择国际组织的名称对试剂盒进行命名,比如:IFCC法、DGKC法、JSCC法、SFBC法(IFCC:国际临床化学和实验室医学学会;DGKC:德国临床化学和检验医学学会;JSCC:日本临床化学学会;SFBC:法国临床检验学会)。在所统计的100种产品中,存在以国际组织命名的产品共有10种,均为以酶类为被测物的产品,如:α-淀粉酶测定试剂盒(IFCC法)、α-羟丁酸脱氢酶测定试剂盒(DGKC法)、γ—谷氨酰转肽酶检测试剂(IFCC法)、丙氨酸氨基转移酶测定试剂盒(IFCC速率法)等。
对以国际组织命名试剂盒的测量原理进行分析,以碱性磷酸酶测定试剂盒为例:无论是宣称采用IFCC法或是采用SFBC法,其试剂盒描述的测量原理均为在碱性磷酸酶的作用下,将对硝基苯磷酸盐上的磷酸集团转移,生成对硝基苯酚,通过测量在405nm处吸光度的变化计算碱性磷酸酶的活性。与普通宣称采用速率法的试剂盒并无明显的差异。
2.3.3 采用免疫比浊法的产品命名不一致的情况 临床化学体外诊断试剂一大类产品,就是采用测量抗原抗体反应产生浊度变化而计算出待测物浓度的免疫比浊法。这类产品共有23项,约占所分析产品数目的20%。虽然均采用的是抗原抗体结合改变浊度的方法对待测物进行测定,但不同厂家的命名方式并不完全一致,比如:免疫比浊法、透射比浊法、胶乳凝集法、胶乳增强比浊法、颗粒增强免疫比浊法等等。
2.3.4 其他由于使用习惯造成的不一致 除了上述3种情况以外,还存在其他方法学名称不一致的现象,比如胆固醇测定试剂盒的方法学名称不同厂家有:氧化酶法、胆固醇氧化酶-过氧化物酶法、CHOD-PAP、胆固醇氧化酶法等,这些方法学所指的测量原理均为同一种方法学,其方法学命名的本质是相同的,只是由于习惯不同造成了表述的不同。这类不一致约占所统计项目的30%。
3 规范化措施研究
考虑到临床化学体外诊断试剂产品的复杂性和多样性,为了更好地方便企业、监管机构和临床使用者的使用,同时考虑到该类产品不断发展的特性,该标准采用命名原则和命名实例相结合的方式,标准正文为试剂盒产品的命名原则,标准附录为近百种最常见临床化学试剂产品的命名规范实例。已在附录中的产品可根据命名实例命名,未在附录中列出的产品,可根据正文中的原则,自行命名。
3.1 命名第一部分 根据法规要求为“被测物”。根据调查分析结果,主要的不一致是被测物名称描述不完整、被测物为离子的情况描述不一致和使用习惯等原因造成的不一致,所以原则中部分规范为“应完整、正确书写被测物中文名称”。
3.2 命名第二部分 在调研的14家厂商中,有12家均以“测定试剂盒”命名,只有两家以“检测试剂盒”命名。对于临床化学体外诊断试剂而言,试剂盒均为定量测定试剂,所以命名第二部分规范为“测定试剂盒”。

表1 不同厂家α-羟丁酸脱氢酶试剂盒产品名称
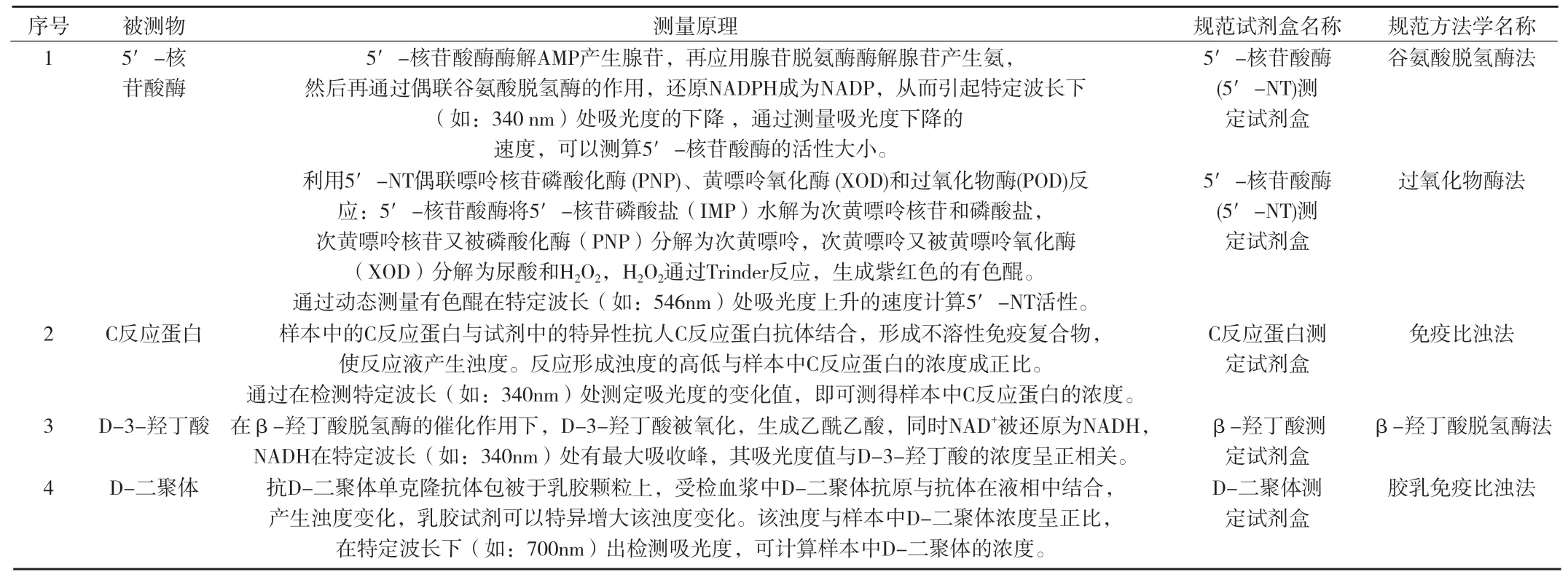
附录 临床化学体外诊断试剂具体产品命名规范实例
3.3 命名第三部分 命名第三部分为方法学规范,这部分是目前最为混乱的部分。根据上述的分析结果,从以下几个方面对其进行了规范。
3.3.1 统一方法学命名的原则 根据前文的分析,目前市场上临床化学试剂产品的方法学命名有的以反应成分命名,有的以检测方法命名,有的以反应特点命名,由此造成了混乱和不一致。经过与相关专家反复讨论研究,为了更好的统一,并体现试剂反应的原理,建议统一使用“具体试剂反应原理”进行方法学命名,并根据临床化学产品的特点,按照“酶类”和“非酶类”对产品进行了分类,分别具体描述了其命名原则。其中酶类,应主要以反应底物命名,部分底物无法进行有效区分的可以反应中的其他酶或反应产物命名;非酶类,应主要以反应中的酶或其他底物命名。
3.3.2 统一不使用国际组织或机构的名称作为方法学名称 如前文所述,出于产品宣传等方面的考虑,一些厂商选择国际组织的名称对试剂盒进行命名,比如:IFCC法、DGKC法、JSCC法、SFBC法等。研究这些试剂盒的测量原理发现,其作用原理与普通试剂盒无显著差异,与相关国际组织推荐的方法并不完全一致。且采用这些组织的名称命名并不能直观的反映试剂的作用原理。经过反复讨论研究,不建议使用国际组织的名称对试剂盒进行命名。
3.3.3 统一采用免疫比浊测定原理的产品命名 虽然目前存在免疫比浊法、透射比浊法、胶乳凝集法、胶乳增强比浊法和颗粒增强免疫比浊法等命名方式。但从反应原理而言,只存在两种方式,即一种是抗原抗体结合产生浊度进行测定,另一种是通过欧联胶乳的试剂,增强浊度的方式。所以分别以“免疫比浊法”和“胶乳免疫比浊法”命名。此外考虑到一种新的临床化学检测方法:采用胶体金颗粒偶联抗体(或抗原)发生免疫反应,导致金颗粒凝集增大,进而导致胶体溶液的颜色发生变化,使特定波长(如:546nm)下的吸光度发生改变。为了与免疫比浊法加以区分,增加“胶乳免疫比色法”命名。
3.3.4 统一其他由于使用习惯造成的不一致 这类不一致由于情况各异,无法制定统一的原则。考虑到每一个临床化学体外诊断试剂产品都有自己的特点,为了更好的规范产品的命名,特制定了命名附录(见附录)。
4 课题意义
综上,本课题从临床化学体外诊断试剂名称的现状入手,收集整理了14家国内外企业的上千种产品信息,概括分析了目前市场上产品名称不一致现象的类型和特点,并以此为基础,依据已发布的法规,提出了试剂盒产品名称规范化的方法。该课题的研究成果,已转化为行业标准报批稿,经过TC136标委会的反复讨论,于2011年11月的年会上通过了委员的审定,已上报国家药品监督管理局标准管理中心审批,制定行业标准。
该标准中命名原则和产品命名实例的制定为更好的规范临床化学体外诊断试剂(盒)产品的名称提供了方法和依据,便于不同生产企业对试剂盒进行命名,促进行业内部相同产品名称的协调统一,进而监管和临床使用,最终促进临床化学体外诊断试剂行业的健康发展。
