生物油萃取分离技术的研究进展
2012-10-19吕东灿刘运权
吕东灿,刘运权,王 夺,袁 亮
(厦门大学能源研究院,福建 厦门 361005)
进展与述评
生物油萃取分离技术的研究进展
吕东灿,刘运权,王 夺,袁 亮
(厦门大学能源研究院,福建 厦门 361005)
综述了国内外采用萃取技术分离生物油的研究进展,包括水萃取、有机溶剂萃取、络合萃取、超临界萃取、柱层析萃取等,总结了这些萃取方法的优点和缺点。指出可通过对生物质热解过程本身进行改进,如对原料进行预处理、引入催化剂进行催化热解、对热解蒸汽进行分级冷凝等,以获得富含目的产物组成的生物油,为萃取分离提供便利。最后,建议尝试一些新的萃取分离方法,如微波萃取和超声波萃取等,考察对生物油萃取分离的有效性。
生物油;萃取;分离;生物质
近年来,随着煤炭、石油、天然气的日益紧张以及由化石燃料引发的一系列环境问题逐日凸显,开发新的可再生能源以及保护环境成为当代科学家甚至每个人关注的焦点。生物质作为一种大有前途的绿色、可持续发展的战略能源,在探索新能源的开发和利用中正扮演越来越重要的角色。生物质具有来源广泛、CO2零排放、环境友好、价廉易得、可再生性强等优点,目前主要可以通过糖化学平台和热化学平台实现其能量及形式的转化。根据反应条件不同,热化学转化平台又分为快速热解、慢速热解、高压液化、高温气化、催化液化等。其中快速热解以其设备简单、操作方便、热转化效率高、投资小成为较有前景的生物质利用途径之一。
生物油是生物质在无氧或者缺氧条件下、采用中等温度(450~550 ℃)、极高升温速率(500~1000 ℃/s)、极短留时间(1~2 s)、经快速冷却浓缩得到的暗棕色黏稠液体[1]。生物油的产率受热解温度、加热速率、停留时间和进料颗粒大小等操作参数的影响[2],生物油的组成与性质也与所采用的原料有关。图 1给出了典型的热解生物油的组成[2];表1是生物油与重油的理化性质比较[3]。
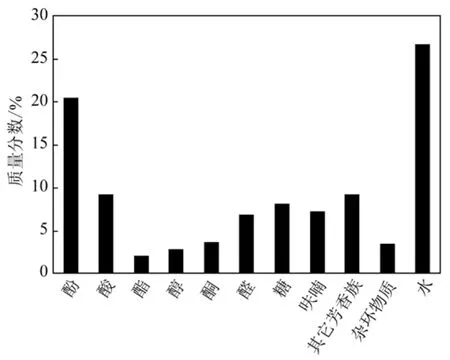
图 1 典型生物油的化学组成

表1 典型的生物油和重油的理化性质比较
由图1可见,快速热解所得的生物油中主要含有水、羧酸、呋喃、醛类和酚类等化合物,因此生物油具有黏度高、热值低、可燃性差、腐蚀性强等缺点(表1),限制了其作为运输燃料直接使用。王贤华[4]综述了提高生物油稳定性的方法,另外,生物油经过催化裂解[5-6]、催化加氢[7]、催化酯化[8]、水蒸气重整[9]等精制后可进一步转化为烃类或其它含氧燃料,具有替代传统化石燃料的潜力。但目前这些精制过程一般需要消耗大量的氢气或能量,导致其成本太高,从而降低了其商业化的可行性。因此,就目前来说,对生物油进行提质改性,然后用作运输燃料替代品并不是一种最理想的选择。作者认为,生物油的产业化关键在于短期内能够利用它制造出高附加值的产品,而通过分离技术从中提取高附加值化学品则是生物油高效利用的一种有效途径[10]。至今,人们对生物油的分离已做了一定的研究工作,陶书伟等[11]、王景华等[12]、陈尔旺等[13]、武景丽等[14]综述了热解生物油的分离方法,Cooney等[15]对藻类生物油的萃取分离进行了详细的评述。然而,迄今专门关于热解生物油萃取分离方面的综述还几乎没有,为此本文拟对热解生物油萃取分离的研究进展做一综述,并对未来的发展趋势加以分析。
萃取又称溶剂萃取,亦称抽提,是一种用液态萃取剂处理与之不互溶的双组分或多组分溶液,实现组分分离的传质过程。萃取是一种广泛应用的单元操作,其原理是利用化合物在两种互不相溶(或微溶)的溶剂中的溶解度或分配系数的差异,使化合物从一种溶剂转移到另外一种溶剂中,将绝大部分目标化合物提取分离出来。分配定律是萃取方法的主要理论依据。萃取分离的优点是常温操作,节省能源,操作方便,不会对生物油成分有较大影响。随着现代工业的发展和分离目标要求的提高,萃取技术不再局限于萃取单元操作,往往是多种单元操作的联合使用[16]。目前,对于快速热解生物油的萃取,其萃取剂的选择主要有水、二氯甲烷、环己烷、乙酸乙酯和三辛胺(TOA)等。下文对各种萃取技术做一详细评述。
1 水萃取
水作为一种极性溶剂能够溶解很多极性小分子,是分离生物油最简单的方法。Bennett等[17]以水为萃取剂结合左旋葡聚糖水解过程萃取松木热解生物油中的左旋葡聚糖,并采用响应面实验设计研究了萃取温度、水油比等对萃取效率的影响。左旋葡聚糖被转化为左旋葡聚糖乙酰化醛腈衍生物后,进行GC-FID检测得到其浓度。酸浓度则用强碱弱酸滴定模型得到。实验结果表明,在 34 ℃,加入水的质量分数为62%的条件下,得到的水相中左旋葡聚糖含量为87 g/L,约占原生物油总量的7.8%(质量分数,下同)。Song等[18]通过加盐(3%)或把相应的水溶性盐溶液(浓度为10%)加到稻壳热解产生的生物油中,实现了生物油的分相。上层为40%~80%水相,下层为 20%~60%油相。使用的盐可以为LiCl、CaCl2、FeCl3、(NH4)2SO4、K2CO3和Fe(NO3)3等。结果表明,萃取后上层含有大量的水、乙酸和其它水溶性化合物,其密度较低,同时黏度和热值也较低,高沸点物质达65%;下层则含水量较少、但木质素类热解化合物较多,故黏度和热值也相对较高。两相的性质和分配比例取决于加入盐的种类和质量。Chen等[19]根据盐溶液对生物油分相的影响解释了生物油分相的3个可能原因为:盐溶液增加了生物油系统离子强度;盐溶液通过破坏整个生物油的网状结构打破了其平衡体系;某些金属离子能够与生物油中的酚类形成化合物,影响了相分离平衡。
直接用水萃取成本低廉、操作简单、前期几乎不需要能量,主要用于将生物油中的水溶性和水不溶性物质的分开,形成两相系统。不过,得到的水溶相和水不溶相是两类不同的混合物,故仅靠水萃取达不到获得纯度较高的单一化合物的目的,一般需要结合其它手段再去精制以提取有价值化合物。由于回收水溶性物质需要通过旋转蒸发或者减压蒸馏等手段除去其中的水分,也即需要有能量输入,因此,将水或盐离子溶液萃取与其它分离方式结合是分离提取生物油中有用成分的必不可少的方法。
2 有机溶剂萃取
有机溶剂萃取是利用相似相溶的原理,根据所选择有机溶剂极性的不同提取性质相似的化合物。常用的强极性溶剂为用于重油提取的甲醇、丙酮、乙酸乙酯和四氢呋喃等;弱极性溶剂为用于轻油提取的乙醚、正己烷、戊烷、二氯甲烷和氯仿等。
Garcia-Pereza等[20]通过萃取将真空热解得到的生物油成功地分为6个组分,并利用GC-MS、DTG、GPC等检测技术对生物油成分进行分析。实验中用到的有机溶剂包括甲苯、甲醇、二乙醚、二氯甲烷等,具体操作流程如图2所示。组分分析表明:生物油主要由8类物质(挥发性非极性化合物、挥发性极性化合物、木质素单体、中等挥发度极性化合物、糖类、可萃取的衍生化合物、大相对分子质量非极性化合物、大相对分子质量极性化合物)组成。
Moens等[21]利用水和有机溶剂从纤维素热解所得的生物油中获得了纯度较高的左旋葡聚糖。其方法是:将纤维素热解生物油稀释在水中,加入Ca(OH)2固体粉末调节pH=12,混合物通过与M IBK共沸蒸馏除去水分,固体通过蒸发回收M IBK后碾碎成为粉末状,在索式提取器中用乙酸乙酯萃取后即得到高纯度的白色晶体——左旋葡聚糖。
Chum 等[22-23]报道了快速热解生物油的萃取分离、酚醛树脂合成方面的研究。首先用乙酸乙酯与生物油按1∶1(质量比)混合,过滤出不溶相,乙酸乙酯可溶相再用水萃取得到水相和有机相,有机相用5%的NaHCO3萃取,由此得到的水相主要是酸类物质,有机相则主要是酚类和中性物质即木质素组分(P/N)。蒸发溶剂后得到酸和P/N的质量分别占生物油干重的7%和31%。木质素组分可以用作酚醛树脂的原料,部分替代苯酚,在强碱性溶剂中溶解P/N和苯酚后,加入甲醛并在加热条件下不断搅拌一定时间,再加入强碱如NaOH即可制得可熔性酚醛树脂。
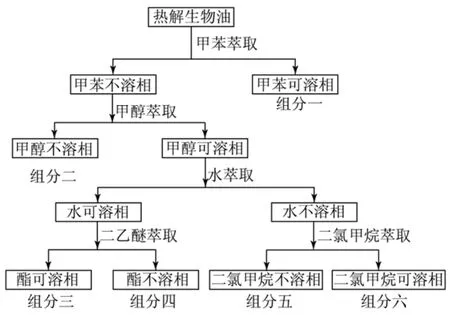
图2 有机溶剂萃取分离生物油流程图
Das等[24]通过调节 pH 值和加入二氯甲烷(CH2Cl2)将鸡粪快速热解所得生物油分离为酸碱性质不同的4种组分,并用元素分析仪、FTIR、NMR和ESI-MS检测手段进行组分分析。将鸡粪热解生物油溶解于二氯甲烷中,然后用NaHCO3萃取并用水洗脱,水溶相调节pH值至4,再用CH2Cl2萃取,蒸发得到强酸性的组分A(3%),为含大量的酚类物质和碳原子数小于 12的饱和脂肪酸;有机相用NaOH萃取并用水洗脱,得到的水相也调节pH值至 4,再用 CH2Cl2萃取的到弱酸性的组分 B(21.3%),获得主要含有碳原子数大于 12的饱和脂肪酸和固醇类物质。第二步的有机相用HCl萃取并用水洗脱得到的水溶相调节pH=9,再用CH2Cl2萃取蒸发得到碱性组分 C(2.4%),获得主要是含有含氮化合物和少量的酚类;有机相蒸发得到中性组分D(32.4%),主要是含有一个或两个双键的不饱和脂肪酸和碳原子数大于20的饱和脂肪酸,醛类和醇类。
Chen等[25]通过对桉树木焦油真空蒸馏得到富含酚类的组分,并研究了反萃取次数和萃取pH值对萃取效果的影响。对木焦油进行液-液萃取,将乙酸乙酯与油相按质量比1∶1混合,溶解后加入与有机相等质量的NaOH溶液,溶液分层后弃去有机相,水相用H2SO4酸化至pH=6,用水相质量一半的乙酸乙酯萃取,得到的乙酸乙酯相即为酚类组分。结果表明,碱萃取次数越多,酚类萃取得就越完全。pH=12~13时才能把所有酚类萃取出来;当pH=10.5时,邻苯二酚能够完全被萃取出来,但是其它酚类,如苯酚、愈创木酚、4-甲基愈创木酚、二甲氧基苯酚等不能完全被萃取出来。
Murwanashyaka等[26]研究了用蒸汽蒸馏桦木生物油并进行酚类的回收,通过有机溶剂的萃取回收单一酚类 ——二甲氧基苯酚。将分段蒸汽蒸馏得到的含目的产物较多的组分进行萃取,首先用正戊烷进行萃取,其不溶相溶解在甲苯中并用水萃取,得到的水溶性组分再用乙酸乙酯萃取,得到乙酸乙酯相,最终获得了纯度为92.3%的二甲氧基苯酚。
有机溶剂萃取是生物油分离最常用的方法,其萃取过程一般不需要能量供给,带入的水分也较少,故适合实验室研究。生物油成分复杂,数百种化合物必定有些与一些溶剂之间性质相近,所以萃取的目的产物往往是利用不同的萃取剂进行多步萃取和反萃取而得到;但目前还存在溶剂消耗量大、价格昂贵、易造成污染、回收困难等问题,这些都是阻碍工业化生产的关键问题。因此,寻找高效、价廉、专一性强、绿色环保、特别是容易回收的萃取剂应是今后努力的主要方向。
3 络合萃取
络合萃取又称为化学萃取,是指萃取剂选择性地与生物油中的某些物质以化学键的形式结合在一起。络合萃取为可逆反应,通过反萃取即得到目的产物。杨义燕等[27]研究了以三辛胺(TOA)为络合萃取剂萃取邻苯二酚、间苯三酚的萃取相平衡,并讨论了稀释剂、萃取液pH值以及硫酸钠浓度对分配系数的影响,研究结果表明三辛胺与酚类的萃取同时还存在氢键缔合溶剂化和离子缔合成盐的过程。Kyuchoukov等[28]研究了三正辛胺和一种季铵盐A liquat 336溶解于正癸醇形成的混合物对乳酸络合萃取的效果,并考察了不同萃取剂比例对萃取效果的影响。结果表明:混合萃取剂的效果优于采用单一的萃取剂,且萃取后的溶液pH值略有上升。Morales等[29]研究了络合萃取剂(如磷酸三丁酯TBP和三正辛胺 TOA)、稀释剂、萃取助剂对几种一元羧酸进行萃取的平衡关系,并根据不同的萃取剂组成做出了每种一元酸的对应等温线,所使用的一元羧酸主要有甲酸、乙酸、丙酸、丁酸和乳酸等。Wasewar等[30]采用 alamine 336为络合萃取剂、M IBK为助溶剂萃取发酵液中的乳酸,并根据实验结果对乳酸萃取的动力学进行了研究。
以上5个水平,在进行量化过程中,依次赋0~4分,最后采用定性分析的方法,从认知错误、数学推理等方面,分析职前教师对问题1的答题情况.
尽管络合萃取在其它领域的物质分离方面,比如废水的处理和发酵液成分分离研究得较多,但在成分复杂的生物油萃取方面应用还较少。Mahfud等[31]利用胺与乙酸的络合反应研究了三辛胺、三月桂胺(TDDA)作为萃取剂对生物油中醋酸的萃取效果,并对影响萃取效率的因素如萃取剂、助溶剂的选择以及它们之间的比例关系进行了研究。为了减少胺进入生物油相的比例,选择了一系列的稀释剂对生物油进行处理。实验结果表明,生物油被四氢呋喃(THF)稀释后(含26%生物油),TOA能够萃取生物油中90%以上的乙酸,但TOA在回收过程中存在一定损失,有10%溶解在生物油油相中。不过,用 TOA萃取热处理过的生物油水相,几乎没有TOA的损失,但乙酸的萃取率稍低,为75%。对比实验结果发现萃取剂 TDDA的萃取效果比TOA好,但是价格高出TOA十多倍,故从经济性方面考虑不合适。
虽然络合萃取还没有在生物油成分分离中获得广泛应用,但由文献资料可知,络合萃取分离生物油的方法萃取效率高,用量少,不会造成大量废水和污染;设备占地面积小,连续操作与间歇操作均可;此外,还具有流程简单,操作方便,具有规模化生产的广阔前景。不过,目前可以使用的络合萃取剂价格高、反萃取时萃取剂的回收率也有待进一步提高。因此,寻找价格低廉、回收率高的络合萃取剂应成为将来生物油萃取分离的主攻方向之一。
4 超临界萃取
超临界流体是一种介于气液之间的既非气体又非液体的物态。其流体密度较大,与液体相仿,但是黏度又接近于气体,因此,超临界流体是一种较理想的萃取剂。萃取原理是利用超临界流体的溶解能力与密度的关系,即利用压力和温度对超临界流体溶解能力的影响进行操作。在超临界状态下,将溶剂与待分离物质接触,能够有选择地把极性、沸点和相对分子质量大小存在差异的成分依次萃取出来。目前常用的超临界流体主要有甲醇、乙醇、乙烷、氧化亚氮、正丁烷、戊烷、六氟化硫、水和二氧化碳等[32]。
超临界萃取已在化工、食品等行业应用多年,目前将超临界萃取应用于生物油的分离,尤其是藻类生物油的萃取方面正逐渐增多。超临界萃取用于生物油分离过程的优势主要有:操作温度较低,可以有效防止生物油中物质发生聚合反应;萃取与分离合二为一,降低了生产成本,提高了萃取效率;能够解决生物油黏度高和不稳定等问题,彻底除去生物油中的低聚物和多羟基化合物。
彭军[33]以正己烷、乙酸乙酯、丙酮、异丙醇、乙醇和甲醇作为反应介质在超临界状态下研究了生物油的精制提质效果。并选择乙醇和甲醇作为超临界流体进行了更细致的研究。结果表明:在超临界乙醇中生物油提质催化剂具有较好的稳定性,酸、酚、糖、醛类物质极大降低,酯类物质由6.85%提高到69.57%。导致生物油酸度、黏度明显降低,热值增加,生物油性质获得明显改善,因此,很具有前景。不过,在采用超临界甲醇时,其效果稍差。
超临界二氧化碳萃取为绿色萃取方式,避免了常规溶剂分离带来的环境污染或者加热蒸馏的结焦老化等问题;此外,CO2容易制取,价格便宜,不可燃,可以循环使用,安全性好。Rout等[34]研究了超临界CO2萃取对小麦和锯末混合物热解所得生物油提纯的效果。结果表明,超临界CO2能够有效地分离生物油的水分,使生物油热值提高到30~44.5 MJ/kg。超临界萃取先得到的组分中含有呋喃类(9.9%)、吡喃类(9.0%)、含氧苯环物质(39.3%)等,随后得到的组分中含有大量的脂肪酸(44.0%)和大相对分子质量化合物(5.3%)。与传统的有机溶剂萃取相比,超临界萃取得到的产品产量更高。Naik等[35]分析麦秆热裂解获得的生物油,得知这种生物油是烃类、吡喃类、呋喃类、苯环物质、脂肪酸和与有机极性化合物能形成共沸物的水等组成的混合物,用超临界CO2萃取技术分离有机相,在10 MPa和25 MPa获得的超临界组分富含呋喃类、吡喃类和苯环化合物。
熊万明[36]利用超临界 CO2萃取将稻壳和锯末快速热解得到的生物油中绝大部分的有机小分子萃取出来(萃取相),并利用单因素分析研究了萃取参数包括萃取时间、压力、温度等对萃取相的质量和产率的影响。确定最佳萃取条件为萃取压力 13 MPa,萃取温度42 ℃,萃取时间约4 h。萃取相在刚分离出时出现上层为淡黄色下层为橙黄色两相,随后变为深红色的均相,萃取釜中残留物为棕黑色黏稠的液体。萃取后生物油的物理性质获得较大改善,如黏度从13.03 mm2/s降低到2.67 mm2/s,密度降低至0.98 g/m L。不过,由于含水量增加,其热值稍有降低,但生物油的稳定性得到极大提高。GC-MS分析获知多羟基化合物如左旋葡聚糖并未被萃取出来,但极性化合物如羟基丙酮、极性较低的酯类和烃类如乙酸乙酯和 2,4-二甲基呋喃等可以被萃取出来。
除了超临界流体萃取技术,目前也有亚临界水萃取技术。Eikani等[37]用亚临界水从胡荽种子中萃取香精油,通过考察不同温度、颗粒大小、水流速对萃取效率的影响得到了最优萃取条件。与蒸馏、索式提取法相比,亚临界水萃取能得到纯度更高的高附加值含氧精油。
超临界萃取技术虽具有其无可比拟的优势,比如通过改变萃取压力和萃取温度可以有选择地获得一些有价值的产品——如精细化工产品等,但它也存在一些缺点:超临界萃取是最近几十年才发展起来的一项新的分离技术,理论上还不够成熟。此外,它必须在高压下进行,对设备要求和系统耐压程度要求高,故萃取装置制造价格昂贵,仅适合实验室小规模应用研究。最后,工业化生产要考虑到超临界萃取装置的放大,以及投资成本过高等问题。故如果不能在技术上获得进一步突破,目前看来它还不具备规模化生产的潜力。
5 柱层析萃取
柱层析分离也叫柱色谱分离,是一种以分配平衡为机理的分离方法,色谱体系包含固定相和流动相两相,当两相相对运动时反复多次利用混合物中所含各组分分配平衡性质的差异达到彼此分离的目的。整个层析过程即是吸附、解吸、再吸附、再解吸过程。常用的固定相是A l2O3、硅胶、聚酰胺和活性炭等。一般认为,将柱层析与萃取方法结合起来能够取得更好的分离效果。目前用于分离生物油的主要是硅胶柱层析法和A l2O3柱层析。
Cao等[38]将加入 NH3和丙酮的污泥样品在500 ℃的沉降炉中进行热解反应,热解生物油经GC-MS检测发现产生了三丙酮胺;以不同浓度的丙酮-正己烷为洗脱剂的柱层析方法可以分离得到纯度为80.4%的三丙酮胺。
Zeng等[39]利用柱层析技术分离了稻壳热解过程中由小分子物质经过一系列复杂化学反应形成的邻苯二甲酸酯类。生物油经碱化-酸化处理后,以乙酸乙酯和乙醇为洗脱剂对酸化后成分进行多步柱层析分离,得到几种不同的组分,其中组分一和组分二中邻苯二甲酸酯类物质含量大于 80%,实现了对邻苯二甲酸酯类的富集过程。
徐绍平等[40]采用萃取与硅胶柱层析结合的方法对杏核慢速热解得到的生物油的性质和组成进行了研究。首先过滤生物油以除去残渣,用二氯甲烷萃取滤液,可溶相用盐酸萃取,然后用氢氧化钠调节pH值至强碱性,二氯甲烷层用柱层析分离得到三种馏分,碱层用二氯甲烷萃取,可以得到酚类化合物。实验结果表明表明,生物油主要由酸性组分和中性油组成,酸性组分主要由酚类化合物和有机羧酸组成。中性油经层析分离获得 3个馏分:环己烷洗脱馏分(C1)——主要为四环以下纯缩合化合物;苯洗脱馏分(C2) ——主要由单环烷基芳烃和多酚组成;甲醇洗脱馏分(C3) ——主要是酯类极性化合物,总共获得了38种有价值的组分。
张素萍等[41]通过正庚烷萃取和 A l2O3柱层析分离结合的方法分析了木屑快速热解生物油的成分。生物油首先用正庚烷溶解,正庚烷不溶物为难挥发性组分,正庚烷可溶相再进行柱层析萃取,用正庚烷、苯、甲醇冲洗分别得到脂肪烃、芳香烃、极性组分3种组分。并用GC、GC-MS和NMR对4种组分进行分析表征发现,正庚烷可溶相中脂肪烃、芳香烃含量较少,极性组分含量较高,难挥发组分中烷氧基碳含量较高,脂化度远大于芳香度。
有机溶剂萃取与柱层析相结合是富集和纯化生物油产品的一种新方法,整个过程不需要能耗,极性不同的物质间易分离,且得到的物质纯度高。不足的是洗脱剂用量大、回收困难,洗脱时间较长,洗脱溶液彼此分离较困难,且不能连续操作,因此要扩大工业化生产必须寻找分离工艺简单、分离时间短和溶剂回收较易的洗脱溶剂。
6 结 语
生物油分离近年来已成为生物油研究的主要方向之一,而萃取作为分离生物油的一种手段正受到越来越广泛的关注。由于生物油成分复杂,目前各种萃取方法均有其局限性:水萃取操作方便、价廉,不会引起环境污染和溶剂回收问题,但是萃取后水溶性部分脱水需要消耗较多的能量;有机溶剂萃取不会引起含水量的增加,但是专一性低,溶剂价格高,消耗量大,回收较困难;络合萃取专一性强,萃取率高,但是价格昂贵,溶剂回收困难,难以大规模生产;超临界萃取所需温度低,生物油不会产生结焦等问题,但设备昂贵,所需压力高,暂时难以工业化;柱层析萃取产物纯度高,但是所需溶剂量大,溶剂回收困难,不能连续操作,规模化生产困难。其它一些萃取技术,比如萃取精馏、微波萃取和超声波萃取至今还没有发现在生物油分离方面的应用研究,或许可以作为新的分离方法进行尝试。
总之,要解决生物油萃取分离上的难题,建议从以下几个方面努力。
(1)寻找或开发新型、价廉、有效、容易回收和无污染的萃取剂。
(2)充分利用现有的萃取手段和先进工艺,将以上多种方法结合起来进行生物油的萃取。
(3)从生物质原料的选材方面考虑,结合原料所富含的有经济价值的物质性质和热解条件有目的地获得富含目标产物的生物油,然后再进行萃取。
(4)从生物质的热解过程着手,对过程进行改进,包括对生物质进行预处理、引入催化剂、对热解蒸汽进行分级冷凝,以提高生物油的质量或获得不同沸点范围的生物油再进行萃取。
(5)尝试一些新的分离方法,比如微波萃取或超声波萃取等,考察是否会有新的突破。
[1] Bridgwater A V.Review of fast pyrolysis of biomass and product upgrading[J].Biomass and Bioenergy,2012,38:68-94.
[2] 刘运权,龙敏南.几种不同生物质的快速热解[J].化工进展, 2010,29(s1):126-132.
[3] Czernik S,Bridgwater A V.Overview of applications of biomass fast pyrolysis oil[J].Energy & Fuels,2004,18(2):590-598.
[4] 王贤华,陈汉平,罗凯,等.提高生物油稳定性的方法[J].化工进展,2006,25(7):765-769.
[5] Tang Zhe,Zhang Ying,Guo Qingxiang.Catalytic hydrocracking of pyrolytic to liquid fuel in supercritical ethanol[J].Ind. Eng.Chem.Res.,2010,49(5):2040-2046.
[6] Zhang Qi,Chang Jie,Wang Tiejun.Upgrading bio-oil over different solid catalysts[J].Energy & Fuels,2006,20(6):2717-2720.
[7] Karim i Elham,Briens Cedric,Berruti Franco,et al.Red mud as a catalyst for the upgrading of hemp-seed pyrolysis bio-oil[J].Energy & Fuels,2010,24:6586-6600.
[8] Wang Jin-jiang,Chang Jie,Fan Juan.Upgrading of bio-oil by catalytic esterification and determ ination of acid number for evaluating esterification degree[J].Energy & Fuels,2010,24:3251-3255.
[9] Gormay Julien,Coniglio Lucie,Billaud Francis,et al.Steam cracking and steam reform ing of waste cooking oil in a tubular stainless steel reactor w ith wall effects[J].Energy & Fuels,2009,23:5663-5676.
[10] Wang Shurong,Gu Yueling,Liu Qian,et al.Separation of bio-oil by molecular distillation[J].Fuel Processing Technology,2009,90:738-745.
[11] 陶书伟,杨松,宋宝安,等.生物质热解液化制备生物基化学品[J].贵州大学学报,2008,25(3):299-303.
[12] 王景华,崔洪友,李志和,等.生物油的性质及其分离研究进展[J].化工进展,2009,28(12):2099-2104.
[13] 陈尔旺,陈明强,王君,等.生物油分离技术的研究进展[J].广州化工,2011,39(3):3-5.
[14] 武景丽,汪丛伟,阴秀丽,等.生物油分离方法的研究进展[J].石油化工,2008,37(1):95-99.
[15] Cooney M ichael,Yong Greg,Nagle Nick.Extraction of bio-oils from m icroalgae[J].Separation and Purification Reviews,2009,38(4):291-325.
[16] 戴猷元.有机物络合萃取化学[M].北京:化学工业出版社,2008.
[17] Bennett M Nicole,Helle S Steve,Duff JB Sheldon.Extraction and hydrolysis of levoglucosan from pyrolysis oil[J].Bioresource Technology,2009,100(23):6059–6063.
[18] Song Qin Hua,Nie Jun Qi,Ren M ing Guang,et al.Effective phase separation of biomass pyrolysis oils by adding aqueous salt solutions[J].Energy & Fuels,2009,23:3307-3312.
[19] Chen Hong Wei,Song Qin Hua,Liao Bing,et al.Further separation,characterization,and upgrading for upper and bottom layers from phase separation of biomass pyrolysis oils[J].Energy & Fuels,2011,25:4655-4661.
[20] Garcia-Pereza M,Chaalac A,Pakdela H,et al.Characterization of bio-oils in chem ical fam ilies[J].Biomass and Bioenergy,2007,31:222–242.
[21] Moens Lus,Lakewood,Colo.Isolation of levoglucosan from pyrolysis oil derived from cellulose:US,5371212A[P]. 1994.
[22] Chum L Helena,Arvada,Black K Stuart,et al.Process for fractionating fast-pyrolysis oils,and products derived therefrom:US ,4942269[P].1990.
[23] Chum L Helena,Arvada,Colo,et al.Process for preparing phenolic formaldehyde resole resin products derived from fractionated fast-pyrolysis oils:US,5091499[P].1992.
[24] Das D Dharani,Schnitzer I Morris,Monreal M Carlos,et al. Chemical composition of acid-base fractions separated from biooil derived by fast pyrolysis of chicken manure[J].Bioresource Technology,2009,100:6524-6532.
[25] Chen A Carlos,Pakdel Hooshang,Roy Christian. Separation of phenols fromEucalyptuswood tar[J].Biomass and Bioenergy,1997,13( l-2):25-37.
[26] Murwanashyaka Népo Jean,Pakdel Hooshang,Roy Christian. Separation of syringol from birch wood-derived vacuum pyrolysis oil [J].Separation and Purification Technology,2001,24(1):155-165.
[27] 杨义燕,冯颖,戴猷元.三辛胺萃取多元酚的研究[J].应用化学,1995,12(1):55-58.
[28] Kyuchoukov George,Marinova Maria,Molinier Jacques,et al. Extraction of lactic acid by means of a m ixed extractant[J].Ind. Eng. Chem.Res., 2001,40 (23):5635-5639.
[29] Morales Flores Arali,Albet Joel,Kyuchoukov George,et al.Influence of extractant(TBP and TOA) diluent,and modifier on extraction equilibrium of monocarboxylic acids[J].J.Chem.Eng.Data, 2003,48(4):874-886
[30] Wasewar L Kailas,Heesink M Abert,Versteeg Geert F,et al. Reactive extraction of lactic acid using alam ine 336 in M IBK:Equilibria and kinetics[J].Journal of Biotechnology,2002,97:59-68.
[31] Mahfud F H,van Geel F P,Venderbosch R H,et al.Acetic acid recovery from fast pyrolysis oil.An exploratory study on liquid-liquid reactive extraction using aliphatic tertiary am ines[J].Separation Science and Technology,2008,43(11-12): 3056-3074.
[32] Herrero M iguel,Ibanez Elena,Senorans Javier,et al.Pressurized liquid extracts fromSpirulina platensism icroalga:Determ ination of their antioxidant activity and prelim inary analysis by m icellar electrokinetic chromatography[J].Journal of Chromatography A,2004,1047(2):195-203.
[33] 彭军.超临界流体中生物油提质的研究[D].杭州:浙江大学,2009.
[34] Rout P K,Naik M K,Naik S N,et al.Supercritical CO2fractionation of bio-oil produced from mixed biomass of wheat and wood sawdust[J].Energy & Fuels,2009,23:6181-6188.
[35] Naik Satyanarayan,Goud V Vaibhav,Rout K Prasant,et al. Supercritical CO2fractionation of bio-oil produced from wheat-hem lock biomass[J].Bioresource Technology,2010,101(19):7605-7613.
[36] 熊万明. 生物油的分离与精制研究[D]. 合肥:中国科学技术大学,2010.
[37] Eikani H Mohammad,Golmohammad Fereshteh, Rowshanzam ir Soosan.Subcritical water extraction of essential oils from coriander seeds(Coriandrum sativumL.)[J].Journal of Food Engineering,2007,80(2):735-740.
[38] Cao Jing Pei,Zhao Xiao Yan,Morishita Kayoko,et al. Triacetonam ine formation in a bio-oil from fast pyrolysis of sewage sludge using acetone as the absorption solvent[J].Bioresource Technology,2010,101(11):4242-4245.
[39] Zeng Fanxin,Liu Wujun,Jiang Hong,et al. Separation of phthalate esters from bio-oil derived from rice husk by a basification-acidification process and column chromatography[J].Bioresource Technology,2011,102(2):1982-1987.
[40] 徐绍平,刘娟,李四光,等.杏核热解生物油萃取-柱层析分离分析和制备工艺[J]. 大连理工大学学报,2005,45(4):505-510.
[41] 张素萍,颜涌捷,任铮伟,等. 生物质快速裂解产物的分析[J].华东理工大学学报,2001,27(6):666 -668.
Research progress in separation of bio-oils by extraction methods
LÜ Dongcan,LIU Yunquan,WANG Duo,YUAN Liang
(School of Energy Research,Xiamen University,Xiamen 361005,Fujian,China)
The recent progress in separation of bio-oils by extraction worldw ide was reviewed,and specifically,the extraction w ith water,extraction w ith organic solvents,reactive extraction,supercritical extraction,and extraction-column chromatography were discussed. The advantages and drawbacks of aforementioned extraction methods were summarized. Improvements in biomass fast pyrolysis itself,such as pre-treatment of feedstocks,pryolysis w ith catalysts,or multi-stage condensation of pyrolysis-vapor should be attempted to obtain bio-oils rich in target components to facilitate separation of bio-oils by extraction. New extraction methods,such as m icrowave extraction and ultrasonic extraction may be investigated to exam ine their effectiveness for bio-oils separation.
bio-oil; extraction; separation;biomass
TK 6
A
1000–6613(2012)07–1425–07
2012-02-01;修改稿日期:2012-03-20。
吕东灿(1988—),女,博士研究生。 E-mail lvdongcan0118@163.com 。联系人:刘运权,博士,教授。长期从事生物质热化学转化的研究。E-mail yq_liu@xmu.edu.cn。
