外源性瘦素对硫代乙酰胺致急性肝损伤保护机制的研究
2012-10-17黄国荣丁忠阳张家明
黄国荣 丁忠阳 张家明
南京医科大学附属无锡市人民医院,江苏无锡 214023
肝损伤是由各种原因引起的肝脏功能的异常,严重或持续的肝损伤最终导致肝功能衰竭。临床上造成的急性肝损伤原因主要有病毒感染、服药不当、乙醇摄入过量、误服有毒食物等。目前肝损伤的防治在国内外是个严峻的课题。通过建立急性肝损伤动物模型,研究其发生机制,筛选保肝药物及其原理,具有重要的现实意义。最近研究表明,瘦素对胃,小肠、肺、肾、胰腺、心脏等器官的损伤具有保护作用[1]。但在硫代乙酰胺(Thioactitmide,TAA)所致急性肝损伤中作用如何,目前研究较少。本实验旨在探讨外源性瘦素在TAA所致急性肝损伤中的作用及机制。
1 材料及方法
1.1 主要试剂
肿瘤坏死因子α(TNF-α)放射免疫试剂盒购于北京尚柏生物医学技术有限公司。Trizol试剂购自Sigma公司。逆转录试剂盒购自上海生物科技公司。PCR引物基因序列通过GeneBank获得,设计通过Primor 5.0软件完成,上海生物工程公司合成。硫代乙酰胺院国药集团化学试剂有限公司生产。
1.2 动物分组及模型制备
36只雄性Wistar大鼠,体重230~250 g,清洁级,由吉林大学医学实验动物中心提供。大鼠分为正常组、TAA造模组及外源性瘦素预处理组,每组12只。TAA造模组予TAA 200 mg/kg腹腔注射,外源性瘦素预处理组于建立急性肝损伤模型前1 h腹腔内注射瘦素 200 mg/kg,造模步骤同TAA造模组;正常组不造模。予同等剂量0.9%氯化钠溶液腹腔注射。三组大鼠分别于造模后24 h处死。
1.3 血清丙氨酸氨基转移酶(ALT)、血清天门冬氨酸氨基转移酶(AST)和肿瘤坏死因子(TNF)水平检测
血浆标本采用Olympus AU2700生化仪测定ALT和AST浓度,TNF的检测采用放射免疫法。
1.4 核因子-κB(NF-κB)和 TNF-αmRNA 表达检测
采用RT-PCR法检测NF-κB、TNF-αmRNA表达:提取移植肝组织总RNA,取2 μL用于逆转录,反应体积为50 μL。PCR 扩增 NF-κB,TNF-αmRNA,以 β-actin作为内参照。引物由上海生工生物制品公司合成。NF-κB,TNF-α mRNA和 β-actin引 物 序 列 分 别 为 :TNF-α 上 游 5'-CCACGCTCTTCTGTCTACTGT-3',下游 3'-GCTACGGGCTTGTCACTC-5',NF-κB 上游 5'-CCAGGCGGACATCATCAA-3',下游 3'-AGGAAAGTAAACCGGAAC-5',β -actin: 上 游 5'-GAGGGAAATCGTGCGTGAC-3',下游 3'-CTGGAAGGTGGACAGTGAGG-5'。 反应条件为: 94℃变性 5 min, 94℃ 30 s,54℃ 30 s,72℃ 45 s, 共扩增 35 个循环,72℃延伸 10 min。PCR产物经1.2%琼脂糖凝胶电泳观察,凝胶成像系统进行扫描,进行半定量分析,以各基因与相应β-actin的PCR产物积分光密度的比值代表半定量值。
1.5 统计学方法
数据采用统计软件SPSS 13.0进行处理。计量资料采用均数±标准差(±s)表示,组间比较采用 t检验,以 P<0.05 为差异有统计学意义。
2 结果
2.1 外源性瘦素对肝功能的影响
外源性瘦素预处理组ALT、AST水平较TAA造模组降低(P<0.01),较正常组增加,差异有高度统计学意义(P<0.01)。 见表1。
表1 造模后24 h各组小鼠ALT、AST水平比较(±s,U/L)
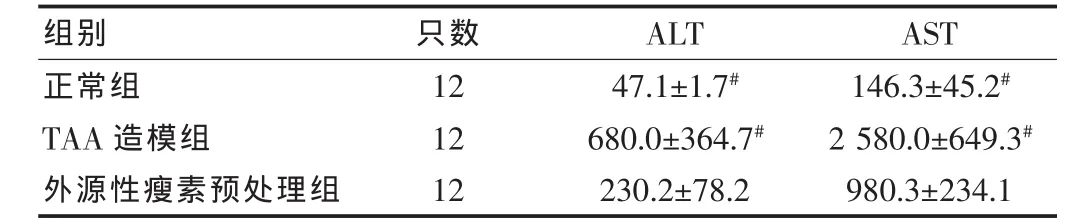
表1 造模后24 h各组小鼠ALT、AST水平比较(±s,U/L)
注:与外源性瘦素预处理组比较,#P<0.01
组别 只数 ALT AST正常组TAA造模组外源性瘦素预处理组12 12 12 47.1±1.7#680.0±364.7#230.2±78.2 146.3±45.2#2 580.0±649.3#980.3±234.1
2.2 各组血浆肿瘤坏死因子α水平比较
瘦素预处理组TNF-α较TAA造模组降低(P<0.01),较正常组增加,差异有高度统计学意义(P<0.01)。见表2。
表2 造模后24 h各组小鼠血浆TNF-α浓度比较(±s,ng/mL)
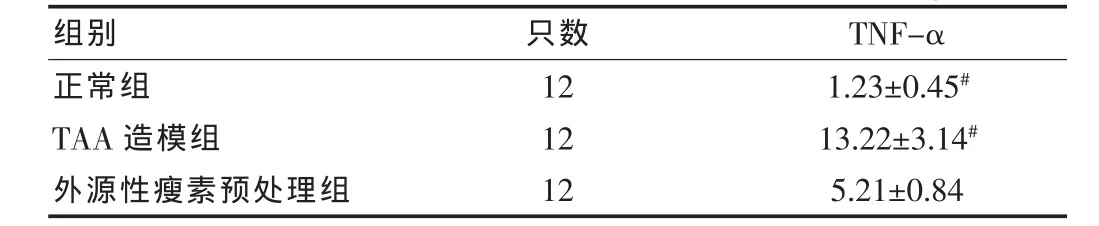
表2 造模后24 h各组小鼠血浆TNF-α浓度比较(±s,ng/mL)
注:与外源性瘦素预处理组比较,#P<0.01
组别 只数 TNF-α正常组TAA造模组外源性瘦素预处理组12 12 12 1.23±0.45#13.22±3.14#5.21±0.84
2.3 各组肝组织肿瘤坏死因子α、NF-κBmRNA表达变化的比较
外源性瘦素预处理组肝组织TNF-α、NF-κB mRNA表达较TAA造模组明显降低(P<0.01);但较正常组增加,差异有高度统计学意义(P<0.01)。见表3。
3 讨论
瘦素是一种主要由脂肪组织分泌的相对分子质量为16 kDa的蛋白活性因子,含167个氨基酸,由肥胖基因ob编码,通过下丘脑内的特异受体,受神经-内分泌和能量代谢状况的反馈调节而表达。正常情况下,瘦素在脂肪组织中维持一定的水平,通过与下丘脑内的特异受体结合参与调节机体摄食、体质量平衡、新陈代谢和生育功能,还参与了机体应激后内环境稳定的过程,具有广泛的生物学意义[2]。研究发现,瘦素在急性炎症造成的组织损伤中发挥重要的作用,可能是炎症反应时细胞因子网络的组成部分[3]。
表3 造模后24h各组小鼠肝组织TNF-α、NF-κBmRNA的表达变化(±s)

表3 造模后24h各组小鼠肝组织TNF-α、NF-κBmRNA的表达变化(±s)
注:与外源性瘦素预处理组比较,#P<0.01
组别 只数 TNF-α NF-κB正常组TAA处理组外源性瘦素预处理组12 12 12 16.4±3.2#159.23±5.4#48.1±3.8 0.32±0.03#1.5±0.34#0.68±0.11
TAA所致的急性肝损伤,与人类肝损伤的特点最为接近,能较好地反映人类肝损伤的实际情况,是研究急性肝损伤发生机制最佳的动物模型[4]。NF-κB是一种能与多种细胞基因的κB位点发生特异性结合并启动基因转录的蛋白质,能够调控多种与炎性反应有关的细胞因子[5]。TNF-α作为NF-κB的下游基因,在其启动子上存在着NF-κB的结合位点。TNF-α是炎症反应中最关键的促炎性介质,在急性肝损伤病情进展中起着最关键的作用[6]。
本实验结果表明TAA处理后大鼠肝功能明显受损,而血浆TNF-α水平明显升高,与之对应的肝组织中TNF-α和NF-κB的表达明显增强,外源性瘦素预处理则各组指标明显较TAA造模组低,但较正常组高。表明外源预处理减轻TAA所致急性肝损伤的机制可能为:急性肝损伤伴发内毒素血症[7],血浆内毒素水平升高,刺激细胞内的转录因子NF-κB,使之活化。活化后的NF-κB可增强TNF-α等炎性因子的转录,促进TNF-α生成和释放增多。引起组织内炎性细胞反复浸润及炎症反应,造成组织器官损害。瘦素作为一种抗氧化剂,对NF-κB的活化有明显的抑制作用[8]。用瘦素抑制NF-κB的活性后,直接减少了血浆及肝组织中TNF-α生成,进而减轻了肝损伤,但这种保护机制仅能部分减轻损伤,而不能完全抑制损伤。这表明TAA所致急性肝损伤是多种炎症介质参与的复杂过程,其全部机制仍待进一步研究。
本文通过外源性瘦素预处理硫代乙酰胺所致的急性肝损伤,观察其对大鼠急性肝损伤早期炎症反应的影响,探讨该作用的可能机制,深入研究其保护作用机制将有助于瘦素的应用向临床过渡。
[1]裘辉,梁华平.瘦素对损伤器官的保护作用[J].国际外科学杂志,2008,35(7):467-470.
[2]Krol E,Speakman JR.Regulation of body mass and adiposity in the field vole,Microtus agrestis:a model of leptin resistance[J].J Endocrinol,2007,192:271-278.
[3]Shi Y,Yan GT,Lin J,et al.Intestinal ischemia-reperfusion injury made leptin decreased[J].Regul Pept ,2006,133:27-31.
[4]王春妍,范玉强,迟宝荣,等.核因子-κB在硫代乙酰胺所致急性肝损伤中的作用及机制研究[J].中华消化杂志,2008,28(11):733-736.
[5]Puneet P,Moochhala S,Bhatia M.Chemokines in acute respiratory distress syndrome[J].Am J Physiol Lung Cell Mol Physiol,2005,288:3-15.
[6]Nowak M,Gaines GC,Rosenberg J,et al.LPS-induced liver injury in D-galactosamine-sensitized mice requires secreted TNF-alpha and the TNF-p55 receptor [J].Am J Physiol Regul Integr Comp Physiol,2000,278:1202-1209.
[7]Sukhomik I,Helou H,Lufie M,et al.The effect of leptin on intestinal recovery following ischemia-reperfusion injury in a rat[J].Pediatr Surg Int,2007,23(5):473-478.
[8]刘立新,韩德五,任大宾.肠源性内毒素血症在硫代乙酰胺所致肝损伤发病中的作用[J].中华肝脏病杂志,2000,8(3):174-175.
