FVB和EIIa-Cre小鼠胚胎冷冻保存研究
2012-10-17,,,,
,, , ,
(浙江大学实验动物中心,浙江杭州 310058)
人类疾病动物模型是研究疾病病因、揭示疾病发生机理及评价治疗措施等的重要实验对象和材料。由于基因修饰小鼠疾病模型存在着极其重要的理论研究价值和广泛的实际应用潜力,所以对小鼠模型进行长期保种显得越来越重要。常规保种方法用于大量基因修饰小鼠维持时,存在许多不足,如维持成本高、疾病威胁、遗传漂变等,且这些小鼠往往对营养、环境等因素的要求也不一样[1]。胚胎和精子的冷冻保存及复苏技术则可弥补常规动物保种和繁育方法的缺陷。
FVB小鼠是一种常用的实验小鼠品系,起源于远交系Swiss小鼠。1935年,该小鼠饲养于美国NIH研究所,1966年起开始选育。20世纪70年代初,在HSFS/N系小鼠培育至第八代时,发现部分小鼠携带Fv1 b基因,表现对B strain Friend白血病毒敏感,随后育成Fv1 b同型合子近交系,称作FVB品系。FVB繁殖力较强,窝产仔数多,受精卵前核大而显著,易于显微注射DNA,是适用于转基因实验的小鼠品系[2]。EIIa-Cre小鼠是以FVB小鼠为背景制作的转基因小鼠品系,转入的基因为纯合子,整合于No 6染色体第18 -95 Mbp的DNA区间,是广泛应用于突变和转基因研究的工具鼠[3]。
本研究以EIIa-Cre小鼠和其背景鼠FVB为研究对象,进行胚胎冷冻保存方法及其影响因素的研究。采用慢速冷冻和快速冷冻方法,探索其解冻和复苏程序的最佳条件,并比较两种方法的优缺点,为建立基因修饰小鼠胚胎保存资源库奠定基础。
1 材料与方法
1.1小鼠来源及胚胎获取
小鼠来源。EIIa-Cre和FVB小鼠均购于南京大学模式生物研究所,饲养于屏障设施内。
受精卵获取。选取成熟未配雌性小鼠(4~6周龄[4]),腹腔注射PMSG 5~10 IU/只,48 h后腹腔注射HCG 5~10 IU/只,随即与同基因型的成年雄性小鼠合笼。然后于注射HCG 14~16 h后处死雌鼠,连同子宫一起取出输卵管,用解剖针刺破输卵管膨大部,引出卵子团至HTF培养基中,置培养皿于37℃、5%CO2孵箱中培养。
2-细胞期胚胎获取。同上述超排交配(以阴栓为准)24 h后处死雌鼠,连同子宫一起取出输卵管(然后剪下输卵管),用注射器进行灌流冲洗,冲出胚胎,再将含有胚胎的培养基滴入培养皿中。
1.2玻璃化液配制
DAP213的配制。先用4M的DMSO和6M的PG(propylene glycol)溶解在PB1溶液中,形成A液;然后将2M的AA(acetamide)溶解在PB1中,形成B液。
最后A液和B液等量混合在一起,即形成DAP213抗冷冻剂[5]。
1.3胚胎冷冻
室温下配置1M的DMSO溶液,按冷冻麦管数量在直径3 cm的培养皿中制成数个液滴,每个液滴约100 μL。
将待冷冻的胚胎移入DMSO中,每个液滴约移入40个胚胎,然后依次将其他麦管中的胚胎移入液滴中,让其自然沉降至液滴底部。将5 μL的1M DMSO溶液与胚胎一起移至冷冻管中,放入0℃的冷却装置内。
5 min后,将预先冷却的胚胎保存液(DAP213)45 μL移入装有胚胎的冷冻管内。再经5 min后,将冷冻管放入固定装置,直接放入液氮中。
1.4冷冻胚胎的融解
将解冻液(0.25M蔗糖溶液)放入37℃、5%CO2培养箱中平衡30 min。
从液氮罐中取出冷冻管,倒掉管内液氮,室温下放置约30 s。将预热的解冻液注入冷冻管中,并用移液器迅速吹吸约10次,然后将内容物移至培养皿中,回收胚胎。
用嘴吸式移液器将回收的胚胎移入KSOM培养液滴中,静止10 min,冲洗胚胎2次后,在解剖镜下进行形态学检查。
1.52-细胞期胚胎的移植
选择10周龄左右母鼠制作备用的假孕受体母鼠。
先将母鼠放入输精管结扎的雄性小鼠合笼,进行交配。次日,将确认有阴道栓的雌鼠作为胚胎移植受体小鼠,麻醉后在其腰椎处剃毛,沿正中位置开一小口,再在腹部两侧肌肉分别开0.5 cm的小口,从腹腔内引出卵巢、输卵管和子宫。
确认输卵管喇叭口和膨大部位,在喇叭口之间的输卵管壁上剪开一切口,将移植针插入到输卵管中,植入胚胎,缝合后将小鼠放在37℃环境下保温,直到苏醒。
1.6统计方法
采用SAS 软件对数据进行单因素三水平方差分析。
分析比较两品系小鼠的受精卵和2-细胞胚胎期卵细胞的超排效率,胚胎复苏率、妊娠率和产仔率。
2 结果与分析
2.1超排卵数 详见表1。
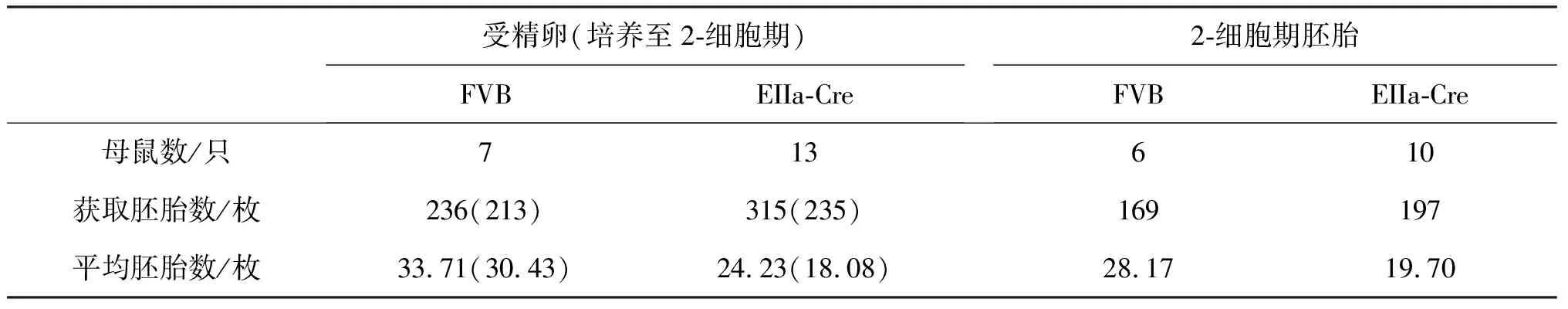
表1 FVB和EIIa-Cre小鼠超排卵数测定结果
由表1可知,FVB和EIIa-Cre小鼠超排后获取的受精卵数量分别为33.71枚和24.23枚,发育至2-细胞期的数量分别为30.43枚和17.08枚,EIIa-Cre的胚胎数明显少于FVB。超排后直接获取2-细胞期胚胎平均数分别为28.17枚和19.70枚,EIIa-Cre的胚胎数也明显少于FVB。
2.2胚胎复苏移植结果 详见表2。
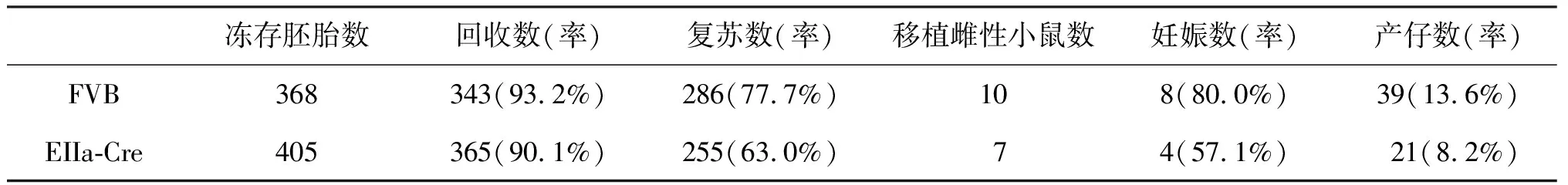
表2 FVB和EIIa-Cre的复苏移植结果
由表2可知,FVB和EIIa-Cre小鼠的胚胎复苏率、妊娠率和产仔率均存在较大差异,分别为77.7%和63.0%、80.0%和57.1%、13.6%和8.2%,FVB小鼠明显高于EIIa-Cre小鼠。
3 讨论
3.1小鼠超排卵效果受多种因素影响,其中主要因素有小鼠周龄、激素注射剂量、PMSG和HCG注射间隔时间及健康状态等。
关于激素注射剂量、PMSG和HCG注射间隔时间的研究,相关报道较多[6-7]。董婉维等[4]报道4~6周龄FVB超排效果最佳,这可能与雌鼠性成熟程度有关,4~6周龄小鼠已达到性成熟,卵泡成熟周期已经开始,对卵泡刺激素(FSH)有反应的卵泡数达峰值,排卵数明显高于6~10周龄的FVB小鼠。
EIIa-Cre为FVB背景小鼠,采用相同方案,取得了较好的超排效果,表明两者的最佳超排条件可能相近。
本研究显示,EIIa-Cre的胚胎数(受精卵或2-细胞期)明显少于FVB小鼠,这可能与其遗传背景改变有关,Spearow J L等[8]和Byers SL等[9]曾报道小鼠品系的遗传背景是影响超排效果的主要因素之一。
3.2胚胎冻存复苏技术是一种简单、实用、经济而可靠的保种方法,可降低动物饲养和繁育成本,扩大动物品系的保存能力,也可随时为其它胚胎工程技术,如胚胎移植、胚胎分割、体外受精、动物性别控制、转基因动物技术和胚胎干细胞技术等提供可用胚胎。
通过建立胚胎库,可在世界范围内运送胚胎,从而取代活体运输,既降低了费用又可避免疾病传播,还能解决遗传漂变及人为、环境因素造成的动物生物学特征和遗传特性的改变等问题。
随着基因修饰动物品系的急剧增加,对胚胎冷冻技术提出了更高的要求,不同品系最佳冻存复苏条件存在差异,人们又很难逐个品系摸索其最佳冻存复苏条件。本研究通过开展基因修饰品系与其背景品系的冻存复苏对比研究,尝试建立背景品系最佳冻存复苏条件用于各个基因修饰品系胚胎保存的可能性。
结果显示,相同方法 EIIa-Cre的各项效率均低于其背景品系FVB,但其各项数据均不影响该品系成功保种,笔者采用适当增加EIIa-Cre超排个体可明显提高保种效率。所建立的方法,可为今后其他基因修饰动物品系的胚胎保存提供参考。
[1]Rall W F, Fahy G M. Ice-free cryopreservation of mouse embryo sat-196℃ by vitrification[J]. Nature, 1985, 313:573-575.
[2]Cathy E, Bakker, Coleta, Verheij, et a1. Fmrl knoc koutmice:Amodel tostudy fragile Xmentalre tardation[J].Cell,1994,78:23.
[3]Yunzheng Le, Brian Sauer. Conditional gene knockout using cre recombinase[J]. Molecular Biotechnology,2001,17(3):269-275.
[4]董婉维, 周生来, 杨 葳,等. FVB小鼠超排卵及胚胎冷冻技术的研究[J]. 中国比较医学杂志,2006,16(11):652-654.
[5]徐平. 实验动物管理与使用操作技术规程[M]. 上海科学出版社,2007,96-104.
[6]高建明, 候文元, 焦古海. 小鼠超排卵效果分析[J]. 北京农学院学报, 2000, 15(1):25-28.
[7]戴丽军, 黄月玲, 叶炳飞. C57BL/6J小鼠超排卵的研究[J]. 中国实验动物学报, 2003,1l(1):5l-53.
[8]Spearow J L,Barkley M. Genetic control of hormone-induced ovulation rate in mice[J]. Biol Reprod,1999,61:851-856.
[9]Byers S L,Payson S J,Taft R A. Performance of ten inbred mouse strains following assisted reproductive technologies(ARTs)[J]. Theriogenology,2006;65(9):1716-1726.
