拟南芥中热胁迫相关microRNA的差异表达
2012-10-10冯静弦汪启明饶力群
冯静弦,汪启明,胡 琪,饶力群
(湖南农业大学生物化学与分子生物学研究室,湖南 长沙 410128)
在高级真核生物的基因组中,大部分的转录产物是非编码RNA,仅不到3%的基因编码蛋白质[1]。microRNA(miRNA)是一类广泛存在于植物、动物、藻类,以及其他一些单细胞生物和DNA病毒中的非编码小分子RNA,在进化上具有高度保守性并且能在翻译水平调控基因的表达。miRNA是由细胞核内的pri-miRNA经Drosha RNase将其切割成具有回文结构的RNA前体(pre-miRNA),再经过Dicer酶加工后生成一种大小约21~23个碱基小分子成熟的miRNA[2-3]。在植物中,miRNA通过碱基互补配对的方式识别靶mRNA,并根据互补程度的不同来指导沉默复合体降解靶mRNA或者阻遏靶mRNA的翻译[4-5]。最近的研究表明miRNA参与各种各样的调节途径,包括激素调节、生长发育、信号转导以及逆境环境的适应能力等[6-8]。大量研究结果表明,在植物中,干旱、盐碱、冷害、高温等非生物胁迫,能够影响基因在植物内转录及转录后水平的表达调控[9]。高温是一种限制植物生长和分布的重要自然灾害之一[10]。近年来的研究发现,miRNA作为一种调控因子参与到植物响应外界胁迫的过程中。当miRNA响应高温胁迫的调控时,其表达量会升高,进而下调其靶基因,这些靶基因可能是逆境胁迫的负调控子,从而达到帮助植物度过逆境的作用。2004年Sunkar等构件了经高盐、干旱、冷和ABA处理的拟南芥小RNA库,发现26个新miRNA以及一些miRNA能受到非生物逆境胁迫的诱导。对于不同的植物、不同的植物组织和器官,应当选择不同的提取方法,因此,笔者以拟南芥叶片为材料选择了3种常用的提取方法并加以改进,比较其提取效果。只有提取到质量高完整性好的总RNA,才能确保半定量RT-PCR准确检测到热胁迫相关基因表达量,从而真实反映起始模板中基因表达量的差异[11]。本研究在生物信息学的基础上通过半定量RT-PCR技术筛选到4个与热胁迫相关的miRNA。半定量RT-PCR技术是近年发展起来的探讨基因转录水平的有效手段[12]。此方法的原理是在PCR体系中加入内对照系统,将样本间的模板质量和扩展效率调整到同一水平,即利用相同量的RNA进行反转录以及PCR扩增,然后通过电泳检测扩增产物的表达量的差异,可为进一步研究拟南芥热胁迫相关miRNAs的表达机制及其响应热胁迫诱导的作用过程提供依据。
1 材料与方法
1.1 材料
1.1.1 供试材料 供试材料为湖南农业大学生物科学与技术学院生物化学与分子生物学实验室提供的Col-4野生型拟南芥,将拟南芥置于38℃的光照培养箱中分别处理 0、0.5、1、2、4 h 后,取其叶片,-80℃保存。
1.1.2 仪 器 Eppendorf高速冷冻离心机、PCR仪、紫外分光光度计、电泳仪、电泳槽、凝胶成像分析仪、电子天平(1/1 000 g)
1.1.3 试 剂 焦碳酸二乙酯(DEPC)One Step PrimeScript miRNA cDNA Synthesis Kit与PMD18-T载体试剂盒均为Takara产品;Trizol试剂为invitrogen产品;Taq DNA聚合酶为赛博产品;提取液1:2%CTAB,100 mmol/L Tris-HCl(pH=8.0),1.5 mol/L NaCl,0.20 mmol/L EDTA(pH=8.0),1%β-mercaptoethanol,5%PVP;提取液 2:50 mmol/L of Tris-HCl(pH=9.0),100 mmol/L NaCl,1%SDS,5%PVP;Li-Cl;氯仿/异丙醇(24∶1);氯仿;异丙醇;水饱和酚;无水乙醇。
1.2 方法
1.2.1 引物合成 引物采用PrimerPremier 5.0软件设计,由华大基因公司合成,miRNA引物及相关引物序列如表1所示。
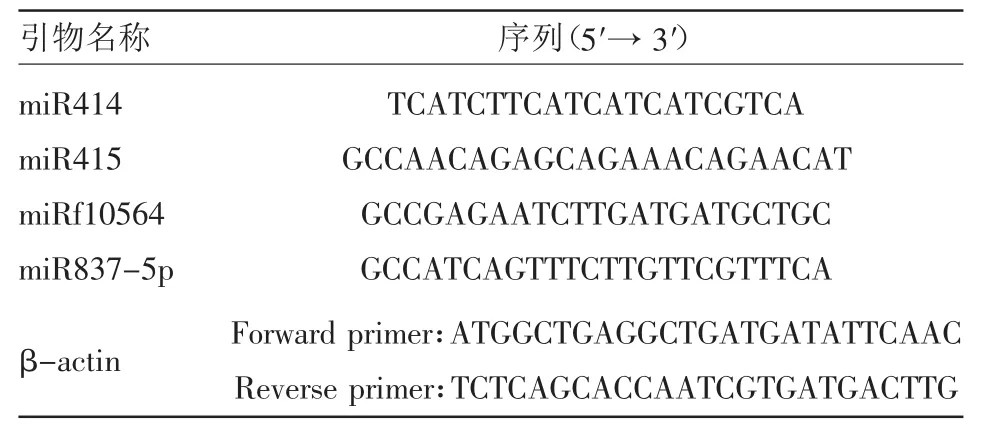
表1 miRNA引物及相关引物序列
1.2.2 拟南芥总RNA的提取 分别称取0.1 g新鲜拟南芥叶片,放入液氮预冷过的研钵中,迅速将材料研磨成粉末(研磨的过程中要不断补充液氮),转移到一个预冷的1.5 mL离心管中。
(1)改良CTAB法:向离心管中加入0.5 mL提取液 1,剧烈振荡混匀,65℃温浴 20 min,4℃、12 000 r/min离心10 min;吸取上清液转移到新的离心管中,加入等体积的氯仿/异丙醇(24∶1)振荡混匀,4℃、12 000 r/min离心10 min;取上清液加入1/2体积氯仿振荡混匀,4℃、12 000 r/min离心10 min;取上清液,加入1/4体积8 mol/L的LiCl,-80℃沉淀过夜,4℃、12 000 r/min 离心 20 min;弃上清液,加入75%乙醇洗涤沉淀,4℃、7 500 r/min离心 5 min;超净工作台上风干乙醇,用30 μLDEPC水溶解。
(2)改良的热酚法:向离心管中加入0.4 mL预热的水饱和酚,0.6 mL RNA 提取液 2,0.05 mL β-巯基乙醇,振荡混匀后,冰浴10 min;加入0.4 mL氯仿,剧烈振荡混匀,室温静置10 min,4℃、12 000 r/min离心15 min;取上清液,加入等体积的氯仿/异丙醇(24∶1),混匀后冰浴 10 min,4℃、12 000 r/min离心 10 min,加入 1/4体积 8 mol/L LiCl,-20℃沉淀3 h,加入75%乙醇洗涤沉淀,4℃、7 500 r/min离心5 min;超净工作台上风干乙醇,用30 μL DEPC水溶解。
(3)Trizol提取法:向离心管中加入1 mL Trizol,剧烈振荡混匀,在冰上静置15 min,4℃、12 000 r/min离心10 min;吸取上清液转移到新的离心管中,加入200 μL氯仿,剧烈振荡15 s,冰上静置15 min,4℃、12 000 r/min 离心 15 min;取上清液约 400 μL到新的离心管中,加入400 μL异丙醇,轻轻混匀,-20℃沉淀 0.5 h,4℃、12 000 r/min离心 10 min;加入75%乙醇洗涤沉淀,4℃、7 500 r/min离心5 min;超净工作台上风干乙醇,用30 μL DEPC水溶解。分别取4 μL上样,用1.0%琼脂糖凝胶电泳检测总RNA的完整性,用紫外分光仪检测OD260/OD280值,如果结果在1.9~2.0时,说明提取的总RNA质量较好,可以进行下一步试验。
1.2.3 半定量RT-PCR 采用Takara公司的One Step PrimeScript miRNA cDNA Synthesis Kit试剂盒给miRNA加A尾后进行逆转录,PCR反应引物一条由试剂盒提供的通用引物(Uni-miR qPCR Primer),一条自行设计的特异性引物,完成半定量RT-PCR反应(以β-actin作为内参基因)。RT反应体积为 20 μL,先加入 1 μL 总 RNA,再加入 10 μL 2 ×miRNA Reaction Buffer Mix,2 μL 0.1%BSA,2 μL miRNA PrimeScript RT Enzyme Mix,用 DEPC水补足至 20 μL,混匀后 37℃反应 60 min,85℃ 5 s终止反应。
反转录结束后,取1 μL cDNA进行PCR反应。PCR 反应体积为 25 μL,1 μL 模板,1 μL dNTP,2.5 μL Buffer,0.5 μLUni-miR qPCR Primer,0.5 μL 特异性引物,0.5 μL Taq 酶,用水补足至 25 μL。反应程序为:94℃ 5 min,94℃ 30 s,58℃ 30 s,72℃ 20 s,miR414、miR415、miR837-5p 25 个循环,miRf10564-akr 28个循环,最后72℃延伸10 min。
用含EB(0.5 μg/mL)的2%的琼脂糖凝胶在电压100 V下电泳检测RT-PCR产物。在凝胶成像仪下观察miRNA在不同时间热处理下的表达情况。1.2.4 PCR产物的克隆与测序 利用苯酚氯仿抽提的方法回收DNA片段。与PMD-18T载体连接,然后转化大肠杆菌感受态细胞。通过蓝白斑筛选鉴定PCR阳性克隆,测序工作委托华大基因公司完成。
2 结果与分析
2.1 总RNA的提取
OD260/OD280的比值可以确定样品的纯度,提取样品OD260/OD280的比值越接近2.0,说明RNA的纯度较高,样品提取得好,可以进行后续试验;当比值低于1.7,所得RNA不可用,需重新提取。改良CTAB法、Trizol法、改良热酚法的OD260/OD280比值分别为 1.56、1.93、1.96,RNA 平均产量分别为480、1 980、300 μg/mL。Trizol法和改良热酚法的OD260/OD280比值均在1.9到2.0之间,但是改良的热酚法所得总RNA的产量过低。琼脂糖凝胶电泳检测的结果显示,28 S和18 S的条带都比较清晰,并且28 S的条带亮度约为18 S亮度的两倍(图1),改良的CTAB法没有提取到高质量的RNA,电泳检测结果显示有明显的拖带,所以Trizol法是最适合的提取方法。
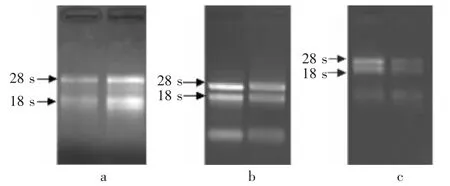
图1 总RNA经1%琼脂糖凝胶电泳检测的结果
2.2 半定量RT-PCR检测miRNA表达差异
在总RNA逆转录时同时进行加poly-A法,可以在一次逆转录后获得所有的miRNA对应的cDNA。其原理是在成熟的miRNA的3′端加上一个poly-A尾巴,这样Oligo-dT(逆转录引物)就很容易结合到mRNA上来合成cDNA,一次逆转录反应就合成了所有miRNA以及其他snRNA、mRNA对应的cDNA。PCR反应过程中,5′端的反向引物为逆转录试剂盒中提供的 Universal Adapter Primer,3′端的为自行设计的miRNA Specific Forward Primer。
以拟南芥中成熟叶片经过不同时间热处理后的总RNA为模板,逆转录后采用β-actin作为内参基因,采用表1中的引物对拟南芥中miR414、miR415、miR837-5p和miR10546-akr进行半定量RT-PCR检测,通过比较条带亮度的差异来分析4种miRNA在38℃不同时间的热处理下的表达差异。从电泳条带的亮度上可以看出(图2),拟南芥中 miR414、miR415、miR837-5p 和 miRf10546-akr这 4 个基因在 38℃分别热处理0、0.5、1、2、4 h 后的表达差异。
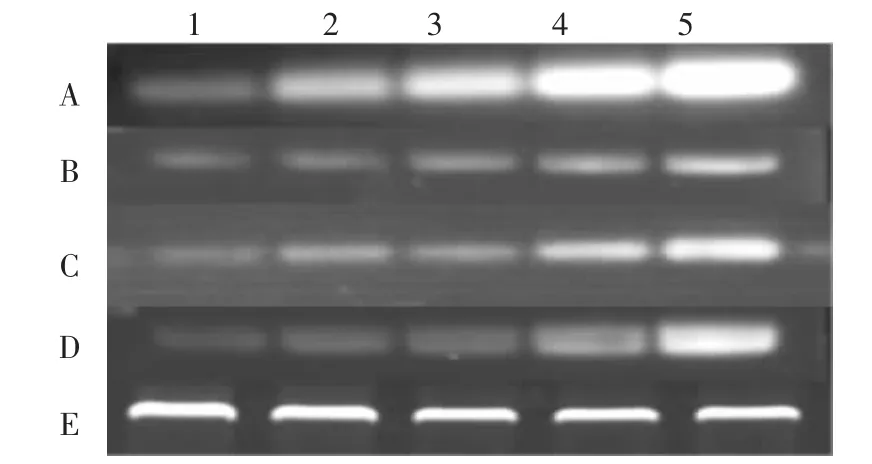
图2 热胁迫处理不同时间下拟南芥中miRNA的表达情况
随着 38℃处理时间的延长,miR414、miR415、miR837-5p和miRmiRf10546-akr的表达量总体均呈现逐渐增加趋势。miR414在0.5 h处理后就出现了明显的表达量增加的情况,miR414的每个处理时间的表达量都明显高于miR415、miR837-5p和miRmiRf10546-akr;miR837-5p 在处理 0.5、1 h 时没有很明显变化,但在处理2 h后其表达量出现显著的提高;miR415和miRmiRf10546-akrr在处理0.5、1、2 h后都没有很明显的表达量的提高,但在4 h后出现表达量的明显提高。miR414、miR415、miR837-5p和miRmiRf10546-akrr在 38℃热处理不同时间后其表达量都有提高,未处理的对照和热胁迫处理不同时间下的表达差异,可能说明它们的表达与植物抗热机制存在一定的关系,即其相关靶基因在热胁迫下有相对不同的调节。
3 讨论
在动植物表达分析中,常常用到的是实时定量PCR、Northern blot、基因芯片等半定量技术,但这些方法费时费力,且需要特殊的仪器,而半定量RT—PCR技术操作相对简便,近年来被广泛地应用于此类研究中[13-15]。近年来,国外的研究人员针对miRNA的长度仅20~23个核苷酸,分别采用了连线性接头或者设计茎环引物等方式在动植物组织中检测到miRNA的表达[16-18]。石艳丽等[19]用半定量RT-PCR法测定链球菌透明质酸合酶mRNA的水平,这对于深入探讨透明质酸发酵有重要意义。笔者运用半定量RT-PCR的方法检测了拟南芥4个miRNA的表达受到热胁迫的诱导情况,结果表明在38℃不同时间处理下各个miRNA的表达情况都有差异,并随着处理时间的延长,其表达量均出现明显提高。
综上所述,半定量RT-PCR技术能够检测到基因显著的水平表达变化,该方法在各个研究领域都有着非常广泛的应用,随着该技术的日趋成熟和完善,它将成为研究者有力的研究手段。
[1]Shabalina S A,Spiridonov N A.The mammalian transcriptome and the function of non-coding DNA sequences[J].Genome Biol,2004,5(4):105.
[2]Lee R C,Feinbaum R L,Ambros V.The C.elegans heterochronic gene in-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843-854.
[3]Lee Y,Ahn C,Han J,et al.The nuclear RNase III Drosha initiates microRNA processing[J].Nature,2003,425(6956):415-419.
[4]Bartel D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116:281-297.
[5]Du T,Zamore P D.MicroPrimer:the biogenesis and function of microRNA[J].Development,2005,132:4645-4652.
[6]Mallory A C,Dugas D V,Bartel D P,et al.MicroRNA regulation of NAC-domain targets is required for proper formation and separation of adjacent embryonic,vegetative,and floral organs[J].Curr Biol,2004,14:1035-1046,1264.
[7]Bartel B,Bartel D P.MicroRNAs:at the root of plant development[J].Plant Physiol,2003,132:709-717.
[8]Mallory A C, Bartel D P, Bartel B.MicroRNA directed regulation of Arabidopsis Auxin Response Factor17 is essential for proper development and modulates expression of early auxin response genes[J].Plant Cell,2005,17:1360-1375.
[9]Sunkar R,Zhu J K.Novel and stress-regulated microRNA and other small RNAs from Arabidopsis[J].Plant Cell,2004,16:2001-2019.
[10]张鹤山,刘 洋,田 宏,等.热胁迫下紫花苜蓿种子萌发特征及耐热性研究[J].湖北农业科学,2011,50(2):348-352.
[11]卢建雄,臧荣鑫,潘和平.半定量RT—PCR法检测原代培养脂肪细胞生脂基因mRNA转录表达 [J].中兽医医药杂志,2005,(6):16-18.
[12]Cottrez F,Auriauh C,Apron A,et al.Quantitative PCR:validation of the useof multispecific internal control[J].Nucleic A cida Res,1994,22(1):2712-2713.
[13]Mathias C,Martine B,Anne V C.A semi—quantitative RT-PCR method to readily compare expression levels within Botrytis cinerea multigenic families in vitro and in planta[J].Curt Genet,2003,43(1):303-309.
[14]Rolland V G.Semli-quantitative analysis of gene expression in cultured chondrocytes by RT-PCR [J].Methods Mol Med,2004,100(1):69-78.
[15]Fellenr M D,Durand K,Correa M.A semi quantitative PCR method (SQ-PCR)to nleasure Epstein-Barr virus(EBV)load:its application in transplant patients[J].Biotechniques,1997,22(1):630-634,636.
[16]Lu D P,Read R L,Humphreys D T,et al.PCR-based expression analysis and identification of microRNAs[J].Journal of RNAi and Gene Silencing,2005,1(1):44-49.
[17]Chen C F,Ridzon D A,Broomer A J,et al.Real-time quantification of microRNAs by stem-loop RT-PCR[J].Nucleic Acids Research,2005,33(20):179-187.
[18]Tang F C,Hajkova P,Barton S C,et al.MicroRNA expression profiling of single whole embryonic stem cells[J].Nucleic Acids Research,2006,34(2):9-15.
[19]石艳丽,郭学平,王凤山,等.半定量RT—PCR法测定链球菌透明质酸合成酶mRNA的水平 [J].食品与药品,2005,7(2):22-24.
