负压封闭引流对兔皮肤创面炎症细胞趋化和炎症因子分泌的影响
2012-10-10白祥军李仁杰薛晨晨
杨 帆,胡 耑,白祥军,李仁杰,张 锟,薛晨晨,曹 圆
(华中科技大学同济医学院附属同济医院创伤外科,湖北武汉430030)
临床上,挤压综合征、坏死性筋膜炎等急性创伤可造成失控性炎症反应,从而继发全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)、脓毒症和多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)[1],而负压封闭引流(vacuum sealing drainage,VSD)可有效清除创面坏死组织和渗出液,已广泛应用于各种急性创面的治疗,临床效果显著[2-4]。但VSD减轻组织细胞炎症反应的作用机制目前尚不明确。本实验通过建立兔创面模型,研究VSD对创面局部组织巨噬细胞、中性多形核白细胞(polymorphonuclear neutrophils,PMN)、淋巴细胞、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)的影响,探讨VSD减轻创面炎症反应的可能机制。
1 材料与方法
1.1 主要材料、试剂与仪器 VSD一次性护创材料为武汉维斯第公司产品、安舒妥伤口愈合快示格胶贴为英国施乐辉公司产品。TNF-α酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒、IL-6检测ELISA试剂盒均购自北京博奥森公司。主要仪器包括:便携式负压吸引仪(武汉维斯第公司)、Denley dragon wellscan MK3酶标仪、微量电动组织匀浆器(美国Kimble公司)及JT-12J全自动生物组织脱水机(武汉俊杰公司)等。
1.2 实验动物 12只普通级健康日本大耳白兔,体质量2.5~3.5kg,雌雄不限,由湖北省实验动物研究中心提供,实验动物质量合格证号:SCXK(鄂)-2008-0005-0007101。动物饲料由华中科技大学同济医学院附属同济医院动物实验中心提供。
1.3 动物建模与分组 用8%硫化钠(天津恒兴公司)于兔背部脱毛,3min后温水洗净并涂润肤油保护皮肤,适应性喂养1周。建模前将规格为15cm×5cm的VSD辅料修剪为4块备用,每块大小为5cm×5cm。实验兔称体质量后,采用30mg/kg盐酸氯胺酮经兔耳缘静脉注射行兔全身麻醉,兔背部脱毛区予0.05%活力碘(武汉扬子公司)消毒,用手术刀全层切开皮肤直至肌肉层,形成一个2cm×2cm的创面,压迫止血。将建模后的12只实验兔随机分为2组:(1)常规组(n=6),创面消毒后不作特殊处理,仅每日常规换药、包扎;(2)VSD组(n=6),创面消毒后,乙醇脱碘,清除创缘污渍,采用胶贴贴膜后给予持续-125mmHg(-16.6kPa)负压吸引,若存在引流管道漏气或堵塞,则及时更换贴膜或VSD辅料。上述实验兔均在特制饲养单笼中按标准条件进行饲养,防止创面污染及贴膜破损漏气。
1.4 巨噬细胞、PMN及淋巴细胞检测 建模后,VSD组和常规组实验兔分别于1、2、3、4、5、6、7d在创缘处切取大小为3mm×5mm的组织,用4%多聚甲醛固定过夜,石蜡包埋、切片,苏木素-伊红(hematoxylin-eosin,HE)染色。光学显微镜(日本Olympus公司)观察并于600倍下随机取5个视野,计算每个视野中巨噬细胞、PMN及淋巴细胞数量,结果以5个视野的平均值表示。将建模时切取的正常组织作为正常对照。
1.5 TNF-α和IL-6检测 建模后,VSD组和常规组实验兔分别于0.5、1.0、6.0、12.0h及1、3、5、7d在创缘处切取大小为2mm×2mm的组织,磷酸盐缓冲溶液(phosphate buffered solution,PBS)洗涤组织,称质量,-80℃保存待测。采用二辛可宁酸(bicinchoninic acid method,BCA)法进行蛋白定量,ELISA法检测创面组织中TNF-α及IL-6含量。将建模时切取的正常组织作为正常对照。
1.6 统计学处理 采用SPSS13.0软件进行统计分析,计量资料用±s表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 VSD组和常规组创面组织巨噬细胞、PMN及淋巴细胞的计数 建模前VSD组和常规组比较,创面组织巨噬细胞、PMN及淋巴细胞计数的差异无统计学意义(P>0.05),具有可比性。自1d时间点起两组创面巨噬细胞及PMN计数均开始升高。VSD组创面巨噬细胞计数显著高于常规组(P<0.05),自6d时间点起两组创面的巨噬细胞计数均开始下降,VSD组的创面巨噬细胞计数仍高于常规组(P<0.01)。VSD组和常规组创面PMN计数分别在3d和4d时间点起开始下降,VSD组创面PMN计数持续低于常规组(P<0.01)。自1d时间点起常规组创面淋巴细胞计数开始升高,自2d起开始下降,而VSD组的创面淋巴细胞计数于1d时间点时达峰值,然后持续下降且显著低于常规组(P<0.05)。见图1、表1。
2.2 VSD组和常规组创面组织TNF-α及IL-6含量的变化建模前VSD组和常规组比较,创面组织TNF-α及IL-6含量的差异无统计学意义(P>0.05),具有可比性。自0.5h时间点起两组创面TNF-α及IL-6含量均开始升高。自1h时间点起VSD组创面TNF-α含量显著低于常规组(P<0.05),该组创面TNF-α含量在12h时间点时稍下降。两组创面IL-6含量在12h时间点时稍有下降后上升,自12h时间点起VSD组创面IL-6含量显著低于常规组(P<0.05)。两组创面 TNF-α、IL-6含量均于24h时间点达到峰值后开始下降。见表2。
表1 创面组织巨噬细胞、PMN及淋巴细胞的计数 ( ±s,个)
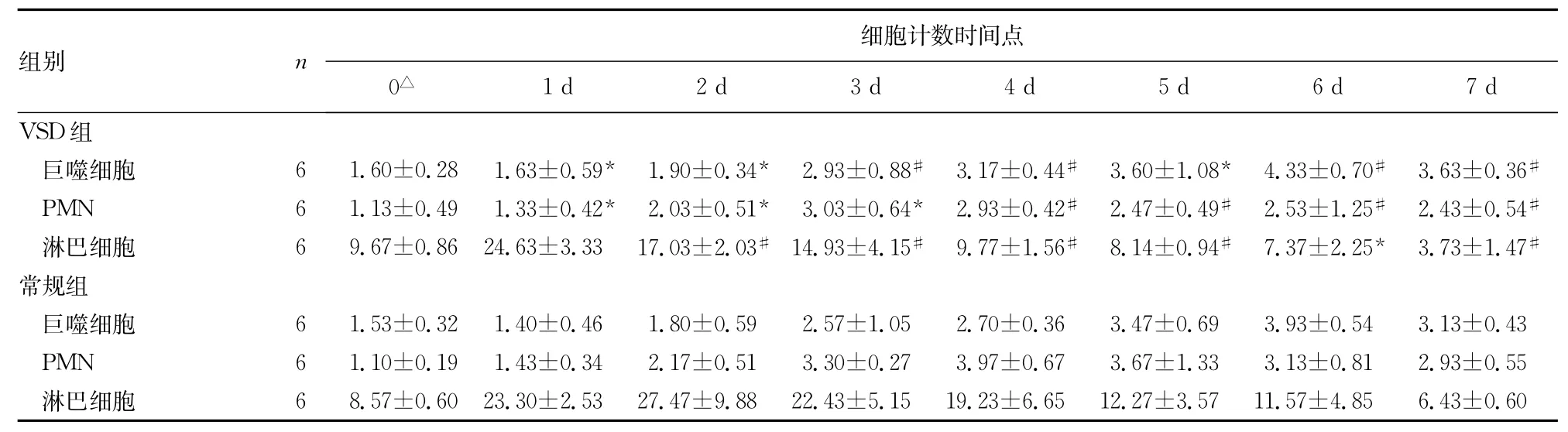
表1 创面组织巨噬细胞、PMN及淋巴细胞的计数 ( ±s,个)
△:为建模时;*:P<0.05,#:P<0.01,与常规组的相同细胞比较。
组别 n细胞计数时间点0△1d 2d 3d 4d 5d 6d 7d VSD 组巨噬细胞 6 1.60±0.28 1.63±0.59* 1.90±0.34* 2.93±0.88# 3.17±0.44# 3.60±1.08* 4.33±0.70# 3.63±0.36#PMN 6 1.13±0.49 1.33±0.42* 2.03±0.51* 3.03±0.64* 2.93±0.42# 2.47±0.49# 2.53±1.25# 2.43±0.54#淋巴细胞 6 9.67±0.86 24.63±3.33 17.03±2.03# 14.93±4.15# 9.77±1.56# 8.14±0.94# 7.37±2.25* 3.73±1.47#常规组巨噬细胞 6 1.53±0.32 1.40±0.46 1.80±0.59 2.57±1.05 2.70±0.36 3.47±0.69 3.93±0.54 3.13±0.43 PMN 6 1.10±0.19 1.43±0.34 2.17±0.51 3.30±0.27 3.97±0.67 3.67±1.33 3.13±0.81 2.93±0.55淋巴细胞 6 8.57±0.60 23.30±2.53 27.47±9.88 22.43±5.15 19.23±6.65 12.27±3.57 11.57±4.85 6.43±0.60
表2 创面组织TNF-α及IL-6含量的变化 ( ±s,pg·L-1)
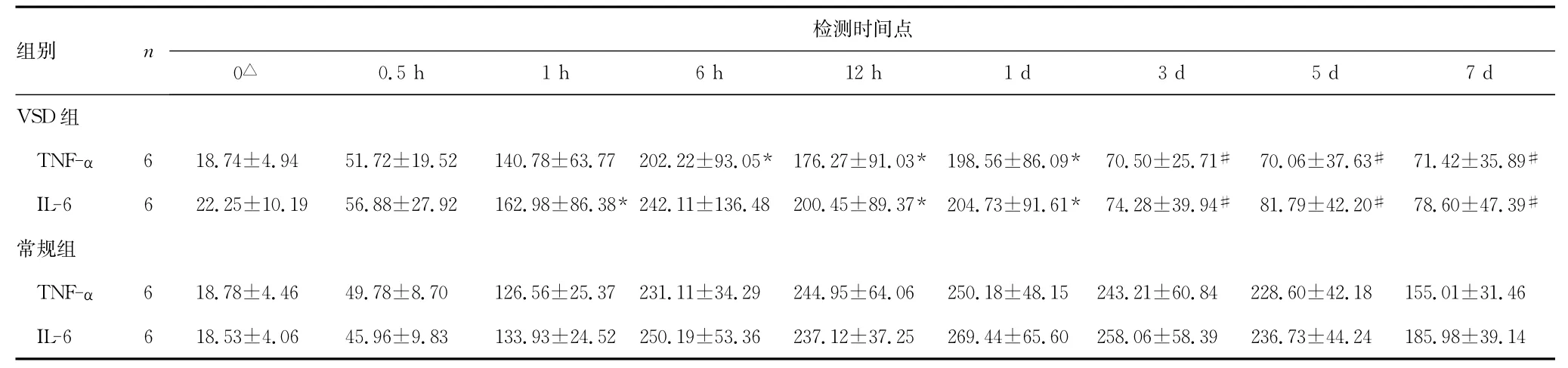
表2 创面组织TNF-α及IL-6含量的变化 ( ±s,pg·L-1)
△:为建模时;*:P<0.05,#:P<0.01,与常规组的相同检测指标比较。
组别 n检测时间点0△0.5h 1h 6h 12h 1d 3d 5d 7d VSD 组TNF-α 6 18.74±4.94 51.72±19.52 140.78±63.77 202.22±93.05* 176.27±91.03* 198.56±86.09* 70.50±25.71# 70.06±37.63# 71.42±35.89#IL-6 6 22.25±10.19 56.88±27.92 162.98±86.38*242.11±136.48 200.45±89.37* 204.73±91.61* 74.28±39.94# 81.79±42.20# 78.60±47.39#常规组TNF-α 6 18.78±4.46 49.78±8.70 126.56±25.37 231.11±34.29 244.95±64.06 250.18±48.15 243.21±60.84 228.60±42.18 155.01±31.46 IL-6 6 18.53±4.06 45.96±9.83 133.93±24.52 250.19±53.36 237.12±37.25 269.44±65.60 258.06±58.39 236.73±44.24 185.98±39.14
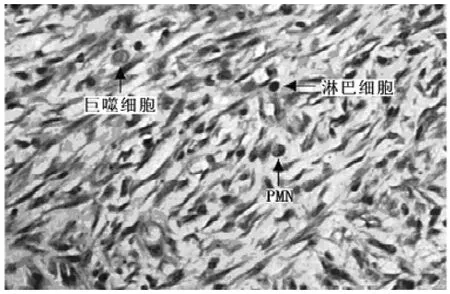
图1 创面组织巨噬细胞、PMN及淋巴细胞形态 (HE×600)
3 讨 论
炎症作为机体创伤后的基本防御性反应,通常包括早期的无菌性炎症和后期的感染性炎症。炎症细胞和炎症因子对炎症结局具有决定作用。合并感染时,这些因子能与细菌脂多糖协同,刺激更多炎症介质的表达,从而放大和加重炎症反应。临床实践表明VSD可显著下调创面组织的炎症反应,减少感染的发生,促进创面愈合。
本实验发现VSD组创面的巨噬细胞计数显著高于常规组,而VSD组创面PMN、淋巴细胞计数以及TNF-α、IL-6含量则持续低于常规组。其可能机制包括:(1)负压刺激机体巨噬细胞和PMN向创面趋化。巨噬细胞和PMN均属于吞噬细胞,在炎症早期受趋化因子作用,可透过血管壁移行至组织损伤处,其主要功能是吞噬和杀灭病原体。巨噬细胞吞噬病原体或坏死组织后形成吞噬体,可存活数十天,而PMN杀死吞噬的病原体后,自身死亡成为脓细胞。当存在物理负压刺激时,巨噬细胞和PMN加快向创面迁移和趋化,使治疗初期VSD组创面的巨噬细胞和PMN较常规组多。由于PMN参与局部炎症反应后其功能迅速降低,发生细胞凋亡或坏死,被巨噬细胞识别、吞噬,而巨噬细胞生存周期较长,使实验表现为VSD组创面的巨噬细胞计数显著高于常规组。同时,由于脓细胞增多,刺激巨噬细胞清除机体衰老及受损的炎症细胞,进一步上调巨噬细胞功能,使其分泌多种细胞因子参与创面修复,调节免疫应答。若创伤发生时巨噬细胞表面的防御性受体受到下调,而效应性受体上调,将导致失控性炎症反应的发生。(2)抑制细菌繁殖。创面贴膜使其与外界隔绝,可防止细菌侵入,减少病原微生物的定植和继发感染的发生,从而降低免疫细胞增生、迁移和活化。同时,VSD形成的创面密闭、潮湿环境为巨噬细胞发挥吞噬功能提供有利条件,较传统干燥创面更利于免疫细胞的游走和渗入,联合持续引流可直接清除病原体[5-7]。(3)下调炎症反应。VSD可减少创面TNF-α及IL-6分泌,促进浸润的淋巴细胞消退。巨噬细胞和PMN是非特异性免疫应答反应中的主要效应细胞,其作用不仅限于吞噬与杀菌,而且能合成、分泌多种细胞因子参与炎症反应。PMN坏死而被吞噬可避免胞内炎症物质释放,从而局限炎症范围,下调巨噬细胞和PMN的上、下游炎症反应。当炎症反应控制后,创面TNF-α、IL-6含量和淋巴细胞计数下降。TNF-α是促炎症反应的主要效应分子[8],能通过激活核转录因子抑制PMN的凋亡,加重炎症反应[9-10];IL-6可由多种细胞合成和释放,通过刺激血小板活化因子而协同TNF-α放大炎症反应或抑制PMN的凋亡[11-12]。当各种原因造成细胞凋亡延迟或障碍时,细胞存活时间延长,细胞数量和刺激性产物增多,一旦坏死,将导致持续、剧烈的炎症反应和组织损伤[13-14]。
目前大部分研究认为,VSD通过改善创面血流、消除水肿及上调生长因子表达等途径促进创面的修复[2-4,15]。本研究观察到物理负压可活化巨噬细胞,减少炎症介质TNF-α及IL-6的分泌,预防过度炎症反应的发生,对完善VSD理论具有一定的指导意义。
[1] 杨帆,白祥军,易成腊,等.急诊负压封闭引流术治疗挤压综合征[J].中华创伤杂志,2009,25(2):103-106.
[2] Ubbink DT,Westerbos SJ,Nelson EA,et al.A systematic review of topical negative pressure therapy for acute and chronic wounds[J].Br J Surg,2008,95(6):685-692.
[3] Koehler C,Niederbichler AD,Jung FJ,et al.Wound therapy using the vacuum-assisted closure device:clinical experience with novel indications[J].J Trauma,2008,65(3):722-731.
[4] Witkowski W,Jawien A,Witkiewicz W,et al.Initial multicentre observations upon the effect of a new Topical Negative Pressure device upon patient and clinician experience and the treatment of wounds[J].Int Wound J,2009,6(2):167-174.
[5] Phillips PG,Birnby LM,Narendran A.Hypoxia induces capillary network formation in cultured bovine pulmonary microvessel endothelial cells[J].Am J Physiol,1995,268(5Pt 1):L789-800.
[6] Chen SZ,Li J,Li XY,et al.Effects of vacuum-assisted closure on wound microcirculation:an experimental study[J].Asian J Surg,2005,28(3):211-217.
[7] 晏继银,张东江,阿秀梅,等.利用真空促进伤口愈合的观察[J].中华外科杂志,2003,41(2):115.
[8] Kato Y,Morikawa A,Sugiyama T,et al.Role of tumor necrosis factor-alpha and glucocorticoid on lipopolysaccharide (LPS)-induced apoptosis of thymocytes[J].FEMS Immunol Med Microbiol,1995,12(3/4):195-204.
[9] Nolan B,Collette H,Baker S,et al.Inhibition of neutrophil apoptosis after severe trauma is NFkappabeta dependent[J].J Trauma,2000,48(4):599-604.
[10]Choi M,Rolle S,Wellner M,et al.Inhibition of NF-kappaB by a TAT-NEMO-binding domain peptide accelerates constitutive apoptosis and abrogates LPS-delayed neutrophil apoptosis[J].Blood,2003,102(6):2259-2267.
[11]Kobayashi E,Yamauchi H.Interleukin-6and a delay of neutrophil apoptosis after major surgery[J].Arch Surg,1997,132(2):209-210.
[12]Biffl WL,Moore EE,Moore FA,et al.Interleukin-6delays neutrophil apoptosis via a mechanism involving platelet-activating factor[J].J Trauma,1996,40(4):575-578.
[13]柳垂亮,李玉娟,招伟贤.中性粒细胞凋亡与炎症反应[J].广东医学,2002,23(11):1218-1220.
[14]El Mezayen R,El Gazzar M,Seeds MC,et al.Endogenous signals released from necrotic cells augment inflammatory responses to bacterial endotoxin[J].Immunol Lett,2007,111(1):36-44.
[15]刘飞,罗晴瑜,梁智.封闭式负压引流技术的原理与创面修复[J].中华损伤与修复杂志,2008,3(4):487-492.
