三氧化二砷逆转A549细胞对TRAIL耐药的研究*
2012-10-10王绩英赵雪强王昌明莫碧文
王绩英,赵雪强,王昌明,莫碧文,蒋 明,陈 峰
(桂林医学院附属医院呼吸内科,广西桂林541001)
在各种常见肿瘤中男性肺癌的发病率和死亡率最高,女性肺癌的发病率位居第4,死亡率位居第2。在中国,肺癌的发病率逐年上升[1]。由于大多数肺癌患者确诊时已属晚期,失去了手术机会,使放、化疗成为肺癌综合治疗的主要手段,但大多数肺癌患者对目前的常规化疗药物不敏感,因此,迫切需要寻求新的、更有效的化疗药物。肿瘤靶向治疗是以肿瘤细胞的某些关键蛋白作为靶点,特异性杀伤肿瘤细胞,而对正常细胞没有不良反应。在本研究中,将人非小细胞肺癌A549细胞用肿瘤坏死因子相关的凋亡诱导配体(tumor related apoptosis inducing ligand,TRAIL)、三氧化二砷(arsenic trioxide,As2O3)处理,观察A549细胞的增殖与凋亡,以及TRAIL和As2O3对A549细胞核因子kappa B(nuclear factor-kappa B,NF-κB)、半胱-天冬 氨 酸 蛋 白 酶 (cysteinyl aspartate specific protease,caspase)-3、survivin mRNA 表达的影响。
1 材料与方法
1.1 细胞及主要试剂 人非小细胞肺癌A549细胞为实验室自行传代保存。重组人TRAIL为以色列PROSPEC公司产品,As2O3注射液为哈尔滨伊达药业公司产品,Dulbecco′s改良Eagle培养(Dulbecco′s modified Eagle′medium,DMEM)、Trizol、AMV第一链cDNA合成试剂盒及聚合酶链反应(polymerase chain reaction,PCR)System购自TAKARA公司。引物序列见表1,引物由上海生工生物工程技术服务有限公司合成。
1.2 细胞培养及分组 将A549细胞置于含10%胎牛血清、100U/mL青霉素及100μg/mL链霉素的DMEM培养基中培养,待细胞处于对数生长期时将其分为对照组(仅加入DMEM)及实验组,实验组又分为As2O3(1μmol/L组As2O3处理)、TRAIL组(100μg/L TRAIL处理)及联合组(1μmol/L As2O3与100μg/L TRAIL联合处理)。

表1 PCR引物序列
1.3 四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)比色法检测 将对数生长期的细胞以每孔200μL,2 000个/孔的细胞密度接种于96孔板,待细胞贴壁后按上述分组处理细胞,每组设3个复孔,同时设空白对照(仅加培养基)。培养24、48、72h后终止实验,每孔加5mg/mL MTT 20μL,继续培养4h,弃掉培养基,每孔加二甲基亚砜(dimethyl sulfoxide,DMSO)200μL,震荡5min,使沉淀充分溶解。用酶标仪测490nm吸光度(absorbance,A)值。按公式计算细胞增殖抑制率:细胞增殖抑制率(%)=[(对照组A值-实验组A值)/对照组A值]×100%。
1.4 流式细胞仪检测 取对数生长期细胞接种于6孔板中,每孔4×104个细胞,培养12h后,用含0.5%胎牛血清的DMEM继续培养24h,使细胞周期同步化。按上述分组处理细胞,每组设3个复孔,培养48h后收集细胞,制成单细胞,70%冷乙醇固定,4℃过夜,检测前用磷酸盐缓冲溶液(phosphate buffered solution,PBS)洗涤,加入20μL核糖核酸酶A(RNaseA),37℃孵育30min,避光加碘化丙啶(propidium iodide,PI)染液,冰浴30min,以300目筛网过滤。调整细胞密度为1.0×106/mL后以流式细胞仪检测,激发光源为氩离子,激发波长488nm,用Multicycle DNA分析软件行细胞凋亡率测定。
1.5 逆转录-PCR(reverse transcriptase-PCR,RT-PCR)检测各组细胞于药物干预48h后提取总RNA。总RNA提取按TAKARA公司提供的试剂操作步骤操作。AMV第一链cDNA合成试剂盒反转录为cDNA,再经PCR扩增。NF-κB扩增条件如下:94℃预变性3min后,94℃变性15s,61℃退火30s,72℃延伸30s,共35个循环;最后72℃延伸5min。survivin扩增条件如下:94℃预变性3min后,94℃变性15s,61℃退火30s,72℃延伸30s,共35个循环;最后72℃延伸5min。caspase-3扩增条件如下:94℃预变性3min后,94℃变性15s,60℃退火30s,72℃延伸30s,共35个循环;最后72℃延伸5min。PCR产物用2.5%的琼脂糖凝胶电泳检测,凝胶成像系统分析,计算相对表达量(与β-actin的比值)。
1.6 统计学处理 应用SPSS16.0软件进行统计学分析,计量数据用±s表示,采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 As2O3、TRAIL对A549细胞增殖的影响 As2O3组、TRAIL组A549细胞与对照组比较,细胞增殖的差异没有统计学意义。联合组A549细胞增殖作用明显强于As2O3组及TRAIL组,且具有时间依赖性(P<0.05),见表2。
表2 As2O3及TRAIL对A549细胞的增殖抑制作用(±s,%,n=3)
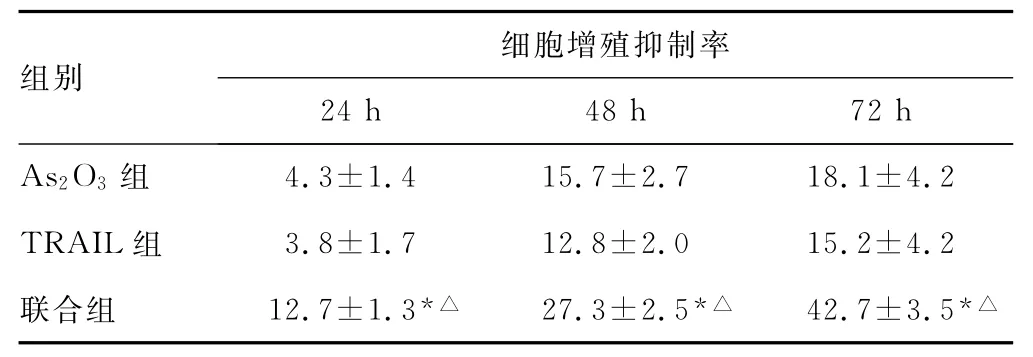
表2 As2O3及TRAIL对A549细胞的增殖抑制作用(±s,%,n=3)
*:P<0.05,与As2O3组比较;△:P<0.05,与TRAIL组比较。
组别细胞增殖抑制率24h 48h 72h As2O3组4.3±1.4 15.7±2.7 18.1±4.2 TRAIL组 3.8±1.7 12.8±2.0 15.2±4.2联合组 12.7±1.3*△ 27.3±2.5*△ 42.7±3.5*△
2.2 As2O3、TRAIL对A549细胞凋亡的影响 凋亡的细胞通透性增加,细胞膜上会出现小漏洞,在洗涤和染色的过程中小片段DNA从细胞内丢失,使凋亡细胞的DNA含量低于正常细胞,在流式细胞仪DNA直方图上出现典型的亚二倍体凋亡峰。联合组 A549细胞的凋亡率为(28.73±1.55)%,而As2O3组和TRAIL组细胞凋亡率分别为(13.23±1.99)%和(5.92±2.48)%。联合组分别与As2O3组和TRAIL组比较,差异有统计学意义(P<0.05)。
2.3 As2O3、TRAIL 对 A549 细 胞 NF-κB、survivin 及caspase-3mRNA表达的影响
2.3.1 As2O3、TRAIL对 A549细胞 NF-κB mRNA表达的影响 与对照组比较,经As2O3、TRAIL处理48h后,各实验组A549细胞 NF-κB mRNA 的表达下降,联合组细胞 NF-κB mRNA表达下降尤为明显(P<0.01),见图1。
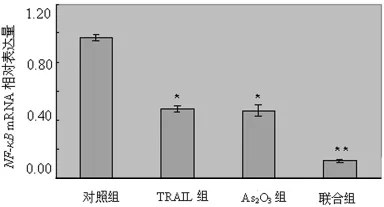
图1 对照组、TRAIL组、As2O3组及联合组A549细胞NF-κB mRNA 的表达
2.3.2 As2O3、TRAIL对 A549细胞survivin mRNA 表达的影响 与对照组比较,经As2O3、TRAIL处理48h后,各实验组A549细胞survivin mRNA的表达下降,联合组细胞survivin mRNA表达下降尤为明显(P<0.01),见图2。
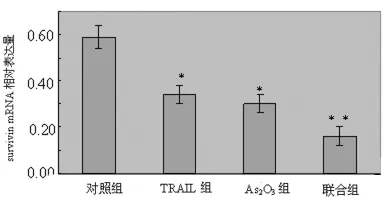
图2 对照组、TRAIL组、As2O3组及联合组A549细胞survivin mRNA的表达
2.3.3 As2O3、TRAIL对 A549细胞caspase-3mRNA表达的影响 各实验组A549细胞经As2O3、TRAIL处理48h后,与对照组比较,As2O3组A549细胞caspase-3mRNA的表达增强,TRAIL组A549细胞caspase-3mRNA的表达没有明显变化;与As2O3组和TRAIL组比较,联合组A549细胞caspase-3mRNA的表达明显增强(P<0.01),见图3。
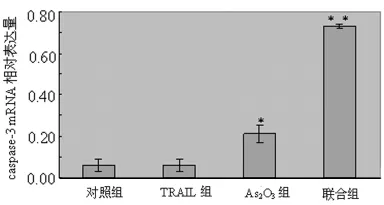
图3 对照组、TRAIL组、As2O3组及联合组A549细胞caspase-3mRNA的表达
3 讨 论
TRAIL是新发现的肿瘤坏死因子(tumor necrosis factor,TNF)超家族成员,TRAIL通过与其受体[死亡受体(death receptor,DR)4、DR5]结合而启动死亡途径,激活Caspase级联反应,最终激活caspase-3发生生物效应,从而引发对TRAIL敏感的细胞大量、快速凋亡,而对机体正常组织不具有明显的毒性作用[2]。因此,TRAIL可能是一种很好的肿瘤靶向治疗药物。但近年来的研究发现,尽管TRAIL具有良好的特异性,仍面临抗肿瘤药普遍存在的耐药性问题,人们发现大部分肺癌细胞对TRAIL耐药,TRAIL的耐药机制目前仍不十分清楚[3-4]。作者推测化疗药物与TRAIL联用也许可逆转TRAIL的耐药性。As2O3是传统中药砒石的主要成分,是一种剧毒化合物。目前研究发现As2O3对急性早幼粒细胞性白血病具有诱导细胞凋亡的作用,并已在临床应用,同时,As2O3可逆转部分肿瘤细胞的耐药性。本实验通过流式细胞术检测发现TRAIL组的凋亡率仅有(5.92±2.48)%,而联合组的凋亡率为(28.73±1.55)%。
多药耐药(mutidrug resistance,MDR)是影响肿瘤化疗效果的重要原因。目前MDR的机制仍不完全清楚,人们认为由于 MDR1基因编码的跨膜 P-糖蛋白(P-glycoprotein,P-gp)、MRP1基因编码的跨膜糖蛋白使细胞内的药物排出或分布异常,使药物不能在细胞内达到有效浓度[5-6]。但这一机制还不能完全阐明 MDR。研究表明,MDR与细胞凋亡有关。Survivin是目前发现的较强的凋亡抑制蛋白,具有调控细胞增殖和凋亡作用,Survivin和肺癌的耐药性与疾病预后有关[7-9]。RT-PCR检测显示联合组A549细胞survivin mRNA的表达明显下降,而caspase-3mRNA的表达明显增强。
NF-κB具有显著抑制肿瘤细胞凋亡的功能,它与肿瘤的发生、生长和转移等多个环节密切相关。NF-κB的持续激活刺激细胞生长,导致细胞增殖失控[10]。但NF-κB的作用却有争议,Ehrhardt等[11]认为NF-κB在TRAIL凋亡信号转导过程中发挥负向调节作用,阻止细胞发生凋亡。Shetty等[12]则得出相反的结论,认为NF-κB促进TRAIL凋亡信号的发生,并认为NF-κB亚单位的种类及数量是这一作用的关键。有研究证实Survivin参与了 NF-κB介导的抗细胞凋亡全过程,存在NF-κB-Survivin途径[13-15]。
TRAIL与As2O3联用对A549细胞的增殖抑制作用及诱导凋亡作用明显强于As2O3或TRAIL单独应用的作用。在联合组中可观察到细胞NF-κB mRNA的表达明显下降,这说明As2O3可能是通过NF-κB通路下调survivin mRNA,上调caspase-3mRNA的表达,从而解除survivin对caspase-3的抑制而逆转A549细胞对TRAIL的耐药性。As2O3能否在体内增强TRAIL的凋亡诱导作用,还有待进一步的研究。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] Aggarwal BB,Bhardwaj U,Takada Y.Regulation of TRAIL-induced apoptosis by ectopic expression of antiapoptotic factors[J].Vitam Horm,2004,67:453-483.
[3] Hopkins-Donaldson S,Ziegler A,Kurtz S,et al.Silencing of death receptor and caspase-8expression in small cell lung carcinoma cell lines and tumors by DNA methylation[J].Cell Death Differ,2003,10(3):356-364.
[4] Stegehuis JH,de Wilt LH,de Vries EG,et al.TRAIL receptor targeting therapies for non-small cell lung cancer:current status and perspectives[J].Drug Resist Updat,2010,13(1/2):2-15.
[5] O′Connor R.The pharmacology of cancer resistance[J].Anticancer Res,2007,27(3A):1267-1272.
[6] 靳胜,陈书恩,张曼,等.姜黄素逆转hl60/Adr及 mcf-7/Adr的多药耐药研究[J].重庆医学,2010,40(1):21-23.
[7] Yang H,Fu JH,Hu Y,et al.Influence of SiRNA targeting survivin on chemosensitivity of H460/cDDP lung cancer cells[J].J Int Med Res,2008,36(4):734-747.
[8] Yang CT,Li JM,Weng HH,et al.Adenovirus-mediated transfer of siRNA against survivin enhances the radiosensitivity of human non-small cell lung cancer cells[J].Cancer Gene Ther,2010,17(2):120-130.
[9] Derin D,SoydinçHO,Guney N,et al.Serum levels of apoptosis biomarkers,survivin and TNF-alpha in nonsmall cell lung cancer[J].Lung Cancer,2008,59(2):240-245.
[10]马武开,姚宇红,黄礼明,等.白血病多药耐药与 NF-κB调控机制[J].广东医学,2009,30(12):1930-1931.
[11]Ehrhardt H,Fulda S,Schmid I,et al.TRAIL induced survival and proliferation in cancer cells resistant towards TRAIL-induced apoptosis mediated by NF-kappaB[J].Oncogene,2003,22(25):3842-3852.
[12]Shetty S,Gladden JB,Henson ES,et al.Tumor necrosis factor-related apoptosis inducing ligand (TRAIL)up-regulates death receptor 5(DR5)mediated by NFkappaB activation in epithelial derived cell lines[J].Apoptosis,2002,7(5):413-420.
[13]Kato J,Kuwabara Y,Mitani M,et al.Expression of sur-vivin in esophageal cancer:correlation with the prognosis and response to chemotherapy[J].Int J Cancer,2001,95(2):92-95.
[14]Notarbartolo M,Cervello M,Poma P,et al.Expression of the IAPs in multidrug resistant tumor cells[J].Oncol Rep,2004,11(1):133-136.
[15]Takada Y,Murakami A,Aggarwal BB.Zerumbone abolishes NF-kappaB and IkappaBalpha kinase activation leading to suppression of antiapoptotic and metastatic gene expression,upregulation of apoptosis,and downregulation of invasion[J].Oncogene,2005,24(46):6957-6969.
