依那普利联合缬沙坦对慢性心力衰竭患者胰岛素抵抗的影响
2012-10-10胡春燕蒋庆渊蔡振荣
马 晶,胡春燕,蒋庆渊,蔡振荣
(上海市复旦大学附属华山医院南汇分院心内科 201300)
近年来的研究表明,慢性充血性心力衰竭(chronic congestive heart failure,CCHF)患者体内存在胰岛素抵抗,并且后者通过代谢和非代谢因素加速心力衰竭进展。血管紧张素转换酶抑制剂(angiotensin-converting enzyme ingibitors,ACEI)和血管紧张素Ⅱ受体拮抗剂(angiotensin receptor blocker,ARB)在不同水平上改善心功能,近年来,这两类药物的联合应用在治疗CCHF方面越来越受到人们的关注。ACEI单独治疗CCHF及其对胰岛素抵抗的影响多有报道,但目前对ACEI与ARB联合应用是否能更大程度地改善胰岛素抵抗的研究尚少,结果也不一致[1-2]。为此,本研究检测了接受ACEI类药物依那普利与ARB类药物缬沙坦联合治疗的CCHF患者空腹血糖 (fast blood glucose,FBG)、空腹胰岛 素 (fast insulin,FINS)、左 心 室 射 血 分 数 (left ventricular ejection fraction,LVEF)、稳态模型胰岛素抵抗评估指数(homeostasis model assessment of insulin resistance,HOMA-IR)及胰岛素敏感指数(insulin sensitivity index,ISI),旨在初步探讨依那普利与缬沙坦联合治疗对CCHF患者胰岛素抵抗的影响,为其治疗心力衰竭的临床应用提供新的理论依据。
1 资料与方法
1.1 一般资料 收集本院心内科于2010年1~12月门诊及住院的心力衰竭患者150例,入选标准:符合美国纽约心脏病协会(New York heart association,NYHA)1974年心力衰竭诊断标准,分级为心功能Ⅱ~Ⅳ级;彩色多普勒超声诊断仪检查,静息LVEF均小于45%;B型利钠肽(B-type natriuretic peptide,BNP)>100pg/mL;并排除糖尿病,肥胖,内分泌疾病,严重肝、肾功能不全等。其中冠状动脉粥样硬化性心脏病(冠心病)75例,高血压心脏病32例,扩张型心肌病27例,风湿性心脏病16例。
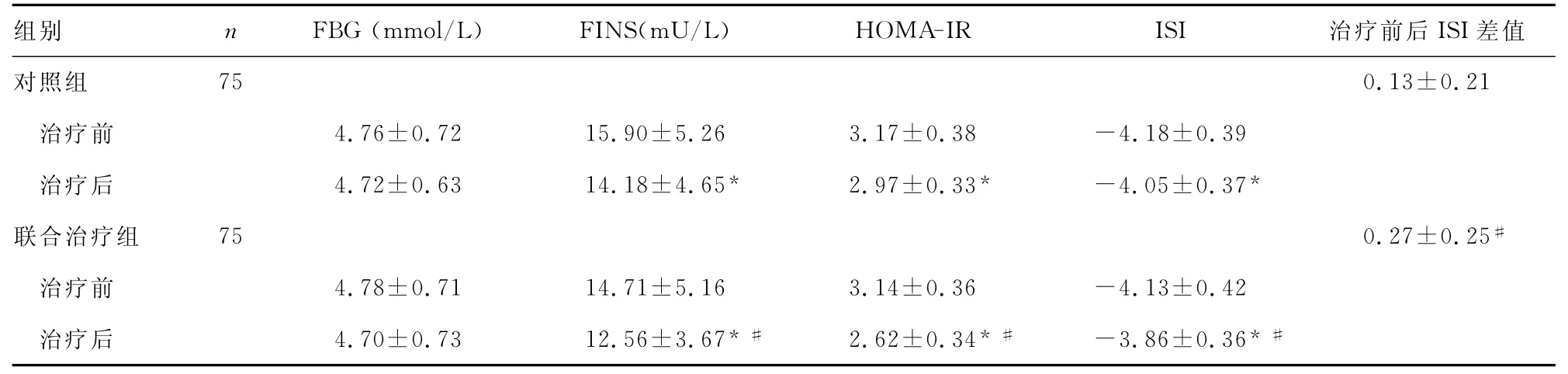
表1 两组患者治疗前后FBG、FINS、HOMA-IR、ISI比较
1.2 分组与治疗方法 采取随机双盲对照研究,计算机随机数字法将150例患者随机分为联合治疗组及对照组,每组75例。(1)联合治疗组:男32例,女43例;平均年龄(67.2±8.7)岁 ;身 体 质 量 指 数 ( body mass index,BMI)为 ( 26.12±3.31)kg/m2;LVEF(35.9±3.1)%,BNP 为 ( 156.2±27.0)pg/mL;其中冠心病39例,高血压心脏病15例,扩张型心肌病12例,风湿性心脏病9例。(2)对照组:男36例,女39例;平均年龄(65.6±7.9)岁;BMI(24.52±3.26)kg/m2;LVEF(36.1±3.2)%,BNP(152.3±30.2)pg/mL;其中冠心病36例,高血压心脏病17例,扩张型心肌病15例,风湿性心脏病7例。两组之间年龄、性别、BMI、病因构成、心功能方面比较差异均无统计学意义(P>0.05),具有可比性。对照组除治疗原发病、服用利尿剂、洋地黄等药物外,同时给予口服依那普利,5mg/次,1次/d;联合治疗组在上述用药基础上给予口服缬沙坦,80mg/次,1次/d,两组患者共观察治疗6个月。
1.3 生化检测 两组患者采血前均禁食12h以上,于上午8:00静息状态下抽取空腹肘静脉血5mL,待血凝固后分离血清,取上清液100μL用竞争放射免疫分析法测量FINS,同时氧化酶法检测FBG。
1.4 LVEF测定 采用美国Acuson-128型彩色多普勒超声诊断仪,用Simpson法测定两组治疗前、后LVEF。
1.5 计算 HOMA-IR和ISI 采用公式计算 H OMA-IR,HOMA-IR=FINS(mU/L)×FBG(mmol/L)/22.5,该 指 数 越高,胰岛素抵抗程度越严重。根据李光伟和Step[3]介绍的公式计算ISI,ISI=Ln[1/(FINS×FBG)],该数值越高,胰岛素敏感性越高;数值越低,说明胰岛素抵抗越明显。
1.6 统计学处理 采用SPSS13.0软件进行统计学分析。计量资料以±s表示,两样本均数比较及组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
对照组与联合治疗组患者治疗后的FBG与治疗前比较,差异无统计学意义(P>0.05);与治疗前比较,两组患者治疗后的FINS、HOMA-IR明显降低,而ISI明显升高,差异有统计学意义(P<0.05)。治疗后,联合治疗组患者的FINS、HOMA-IR下降幅度及ISI升高幅度明显高于对照组,差异有统计学意义(P<0.05)。见表1。
对照组与联合治疗组患者治疗后的LVEF分别为(39.5±3.6)%、(41.3±3.5)%,明显高于治疗前[分别 为(36.1±3.2)%、(35.9±3.1)%](P<0.05),且治疗后联合治疗组患者的LVEF升高幅度高于对照组LVEF升高幅度,差异有统计学意义(P<0.05)。
3 讨 论
冠心病、心力衰竭等心脏病与代谢综合征密切相关[4]。胰岛素抵抗是指正常剂量的胰岛素产生低于正常生物学效应的一种状态,即单位浓度胰岛素的细胞效应减弱,胰岛素在促进葡萄糖摄取和利用方面作用减低,机体代偿性分泌过多胰岛素以控制血糖水平,从而产生高胰岛素血症,后者可导致肥胖症、糖耐量异常、2型糖尿病、血脂异常及冠心病等一系列病理生理改变。胰岛素抵抗被认为是独立的心血管疾病危险因子[5-6],且与 CCHF的发生、发展密切相关[7-8]。胰岛素抵抗在高血压及冠心病发生、发展过程中的作用已被证实,随着对胰岛素抵抗的深入了解,近年来,胰岛素抵抗与CCHF间的作用被广泛关注,研究认为胰岛素抵抗与CCHF间存在密切联系,胰岛素抵抗是CCHF的发病基础,而不是曾经认为的CCHF的结果[9]。国外学者研究发现,胰岛素抵抗可明显降低CCHF患者的运动耐量[10]。
ACEI和 ARB在不同水平上改善心功能[11-12],多项临床观察表明,二者联合应用抑制肾素-血管紧张素系统(renin-angiotensin system,RAS)的作用会增强,产生的治疗效果增加。卡托普利和缬沙坦均可有效改善心肌梗死后的胶原网络重塑,从而有效预防和治疗心力衰竭[13]。本研究结果显示,缬沙坦与依那普利联合应用后,患者LVEF高于治疗前,与既往研究基本一致。
ACEI已被证实可有效改善胰岛素抵抗[14-15]。但目前对ACEI与ARB联合应用对胰岛素抵抗有何影响的报道不多,结果也不一致。有研究认为ACEI与ARB联合应用可增加糖代谢异常,并促进心力衰竭进展[1]。但也有研究显示ACEI与ARB联合治疗并不增加糖尿病的发病率[2]。本研究发现,缬沙坦与依那普利联合应用后,与治疗前比较,患者FINS、HOMA-IR降低,而ISI升高;缬沙坦与依那普利联合治疗后,与单用依那普利治疗比较,患者FINS和 HOMA-IR下降幅度、ISI与LVEF升高幅度均显著增加,说明缬沙坦与依那普利联合应用可改善CCHF患者胰岛素抵抗,改善心力衰竭严重程度,且两药联合应用的治疗效果大于单用ACEI。考虑其可能机制是:(1)血管紧张素Ⅱ可通过促进肝糖原分解而提高交感神经兴奋性,减少胰岛素底物-1与胰岛素受体结合,影响胰岛素的信号转导,促进CCHF患者的炎症反应而导致胰岛素抵抗,而缬沙坦与依那普利在不同水平上阻滞RAS,抑制血管紧张素Ⅱ的生物学效应;(2)抑制缓激肽的降解,提高CCHF患者循环中缓激肽水平,从而可通过扩张血管,促进胰岛素介导的葡萄糖摄取和利用,提高胰岛素敏感性,改善胰岛素抵抗;(3)抑制烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide-adenine dinucleotide phosphate,NADPH)氧化酶,从而改善CCHF患者的氧化应激,提高胰岛素敏感性。
综上所述,胰岛素抵抗是CCHF患者体内存在的现象,在临床上对CCHF患者联合应用缬沙坦与依那普利可明显改善CCHF患者的胰岛素抵抗,并改善其心力衰竭严重程度。
[1] Yusuf S,Ostergren JB,Gerstein HC,et al.Effects of candesartan on the development of a new diagnosis of diabetes mellitus in patients with heart failure[J].Circulation,2005,112(1):48-53.
[2] ONTARGET Investigators,Yusuf S,Teo KK,et al.Telmisartan,ramipril,or both in patients at high risk for vascular events[J].N Engl J Med,2008,358(15):1547-1559.
[3] 李光伟,Step L.检测人群胰岛素敏感性的一项新指数[J].中华内科杂志,1993,32(10):656-660.
[4] Hoshino A,Nakamura T,Enomoto S,et al.Prevalence of coronary artery disease in Japanese patients with cerebral infarction:impact of metabolic syndrome and intracranial large artery atherosclerosis[J].Circ J,2008,72(3):404-408.
[5] Ingelsson E,Sundström J,Arnlöv J,et al.Insulin resistance and risk of congestive heart failure[J].JAMA,2005,294(3):334-341.
[6] Held C,Gerstein HC,Yusuf S,et al.Glucose levels predict hospitalization for congestive heart failure in patients at high cardiovascular risk[J].Circulation,2007,115(11):1371-1375.
[7] Adachi H,Ohno T,Oguri M,et al.Effect of insulin sensitivity on severity of heart failure[J].Diabetes Res Clin Pract,2007,77Suppl 1:S258-262.
[8] Swan JW,Anker SD,Walton C,et al.Insulin resistance in chronic heart failure:relation to severity and etiology of heart failure[J].J Am Coll Cardiol,1997,30(2):527-532.
[9] Witteles RM,Fowler MB.Insulin-resistant cardiomyopathy clinical evidence,mechanisms,and treatment options[J].J Am Coll Cardiol,2008,51(2):93-102.
[10]Alzadjali MA,Godfrey V,Khan F,et al.Insulin resistance is highly prevalent and is associated with reduced exercise tolerance in nondiabetic patients with heart failure[J].J Am Coll Cardiol,2009,53(9):747-753.
[11]Ahmed A,Centor RM,Weaver MT,et al.A propensity score analysis of the impact of angiotensin-converting enzyme inhibitors on long-term survival of older adults with heart failure and perceived contraindications[J].Am Heart J,2005,149(4):737-743.
[12]Voros S,Yang Z,Bove CM,et al.Interaction between AT1and AT2receptors during postinfarction left ventricular remodeling[J].Am J Physiol Heart Circ Physiol,2006,290(3):H1004-1010.
[13]袁小媚,马康华.卡托普利和缬沙坦对大鼠心肌梗死后胶原网络重塑的干预研究[J].重庆医学,2006,35(15):1375-1377.
[14]Goossens GH,Blaak EE,Schiffers PM,et al.Effect of short-term ACE inhibitor treatment on peripheral insulin sensitivity in obese insulin-resistant subjects[J].Diabetologia,2006,49(12):3009-3016.
[15]Hosogai N,Fukuhara A,Oshima K,et al.Adipose tissue hypoxia in obesity and its impact on adipocytokine dysregulation[J].Diabetes,2007,56(4):901-911.
