腹内高压对机械通气兔膈肌细胞凋亡和超微结构的影响
2012-09-28葛慧青徐培峰陆志华朱涛袁月华应可净
葛慧青 徐培峰 陆志华 朱涛 袁月华 应可净


腹内高压(intra-abdominal hypertension,IAH)是多种内外科危重疾病的高危并发症,其发病隐匿、病死率高,近十年来逐渐引起国内外众多学者的高度重视。腹内高压时不仅引起腹腔内脏器灌注不足与脏器功能损害,还影响腹腔外器官特别是呼吸功能的损害,并导致呼吸衰竭[1-6]。呼吸衰竭患者的主要支持手段是人工机械通气,为呼吸衰竭的各种病因治疗争取时间和创造条件。但机械通气时膈肌的去负载失活可诱导发生膈肌功能不全(ventilation-induced diaphragmatic dysfunction, VIDD)。
目前国内外有关IAH对呼吸系统影响的研究都集中在呼吸力学、氧合功能等方面。而作为机体最主要的呼吸肌,膈肌的功能状态对整个呼吸功能起着重要的作用。腹内高压同时伴呼吸衰竭需机械通气时,其腹内压增高是否对膈肌功能产生进一步影响,目前国内外尚无相关研究报道。
1 材料与方法
1.1 实验动物
成年健康新西兰大白兔15只(普通级),体质量2.1~2.3 kg,雌雄不限,由浙江省实验动物中心提供。所有的操作和实验流程均遵守《实验动物管理条例》。动物在实验前12 h禁食,但可进水。8%水合氯醛4 ml/kg腹腔注射麻醉,开通双侧耳缘静脉,进行气管切开插管(直径3.5 mm)、左颈总动脉置管血压监测。微泵咪唑安定1 mg/(kg?h)静脉注射维持镇静。各组实验过程中持续经兔耳正中动脉监测动脉血压,维持生命体征稳定。根据血气调整吸入气氧饱和度(FIO2)、潮气量(VT)和呼吸频率(RR),或者静脉滴注5%碳酸氢钠注射液纠正酸中毒。
1.2 动物分组
将15只新西兰白兔随机分3组(随机数字表法),每组5只。(1)CMV组:容量控制机械通气(RODENT VENTILATOR DH-150,浙江大学医学院仪器设备厂),呼吸频率RR40~50次/min、VT 6~8 ml/kg、吸呼比(I/E)1∶ 2~1∶ 3、FIO2 1 L/min。根据血气调整呼吸机参数,维持PaCO2在35~45 mm Hg(1 mm Hg=0.133 kPa),PaO2>70 mm Hg。[7](2)CMV+IAH组:机械通气和镇静等支持方法同CMV组。实验动物腹腔内冲入氮气,使腹腔内压力保持在12 mm Hg水平。(3)对照组:不进行机械通气,耳缘静脉注入10~20 ml空气处死动物。
1.3 膈肌标本采集
CMV组和CMV+IAH组通气6 h后,耳缘静脉注入10~20 ml空气处死动物,剖腹取左半膈肌组织,分别用于免疫组化和Western blotting,对Caspase-3蛋白表达进行检测;透射电镜下观察膈肌肌纤维的超微结构变化。
1.4 Caspase-3指标测定
膈肌标本经常规脱水、包埋、制成蜡块,石蜡切片行免疫组化步骤(SABC法)进行显微镜下观察组织染色情况并拍照。用已知阳性片作阳性对照,以PBS代替一抗作为阴性对照。结果判定: 光学显微镜下,采用双盲法观片。观察在良好的组织结构及清晰的背景上细胞膜和肌细胞核上出现淡黄色至棕黄色颗粒的细胞为阳性细胞,以表达为阳性的细胞数量占这些切片中该类细胞总数的比率作为这个组织的阳性率。随机观察10个高倍镜视野,至少计数1000个细胞。按每高倍镜视野阳性细胞数百分比记分:阳性细胞数小于10%为0分;阳性细胞数10%~50%为1分;阳性细胞数51%~75%为2分;阳性细胞数≥75%为3分。按着色强度记分:不着色者记为0分;染色弱、呈淡黄色者记为1分;染色中等、呈黄色者记为2分;染色强、呈棕黄色者记为3分。两种记分的乘积决定蛋白表达的高低:<4分者认为低表达,≥6分者认为高表达。
膈肌组织经RIPA蛋白裂解液裂解组织,提取总蛋白,通过Western blot方法检测Caspase-3的蛋白表达,同时检测GAPDH内参来校正上样量或表达误差,并测定灰度值进行比较。
1.5 组织学观察
膈肌组织轻微牵拉至原位长度置入2.5%戊二醛固定液中固定,0.1 mol/L pH 7.01磷酸缓冲液漂洗,用1%锇酸后固定1~2 h时后,钾砷酸盐缓冲液漂洗,再次0.1 mol/L pH 7.01 磷酸缓冲液漂洗,梯度酒精脱水,包埋剂和丙酮混合液(V/V=1/1)处理,存包埋剂处理样品70℃加热过夜,超薄切片(70 nm),醋酸双氧铀、柠檬酸铅染色,日本JEOL公司的JEM-1230型透射电镜中观察。电镜下观察肌丝的排列,线粒体形态、大小和分布,以及细胞核等超微结构的变化。
1.6 统计学方法
计量资料以均数±标准差(x±s )表示,应用SPSS 13.0软件进行统计学处理,均数比较采用单因素方差分析,所有资料均进行正态性检验。多个样本均数间的两两比较采用q检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 兔膈肌细胞Caspase-3蛋白的表达
Caspase-3蛋白主要表达在膈肌细胞核上,其次在细胞膜上。CMV组的肌细胞核上呈棕黄或者棕褐色,阳性细胞数为25%~60%,Caspase-3蛋白呈中等表达(4.20±0.39)分; CMV+IAH组阳性细胞数为55%~85%, Caspase-3蛋白呈高表达(7.12±0.54)分,见图1。
A(×200)和B(×400)为Caspase-3在对照组中的表达;C(×200)和D(×400)为Caspase-3在CMV 6 h组中的表达;E(×200)和F(×400)为Caspase-3在CMV+IAH6h组中的表达 。 与对照组比较,aP<0.01;CMV+IAH与CMV组比较,bP<0.01
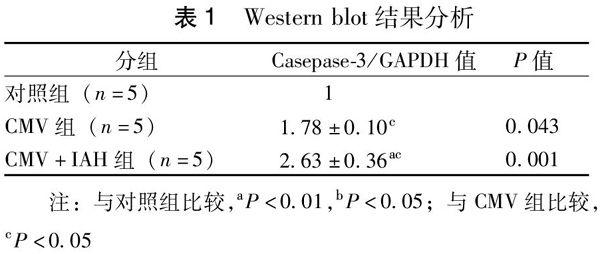
Weatern blot结果显示,内参为均一显影的条带,Caspase 3显影条带密度不同(图2),以Caspase 3灰度值/GAPDH灰度值表示Capase 3蛋白相对表达水平,将相应对照组Caspase 3蛋白表达量标准化为1,计算Ratio(图1),CMV组、CMV+IAH组Caspase 3蛋白的表达量均显著高于对照组(P<0.01),CMV+IAH组与CMV组比较,差异具有统计学意义(P<0.05),提示CMV+IAH促进膈肌细胞的氧化应激。以上结果均重复3次。
2.2 IAH对机械通气兔膈肌组织病理的影响
电镜下可见,CMV组肌丝整齐但排列疏松,局部肌丝模糊、肌丝紊乱,Z线清晰,脂质空泡形成。部分线粒体肿胀明显,嵴膜断裂,空泡形成;CMV+IAH组膈肌結构损伤最明显,出现肌丝结构紊乱,排列不整齐,Z线模糊。肌原纤维间线粒体溶解、肿胀、基质空亮、嵴变形,局部线粒体空泡化,膜结构消失;而对照组肌原纤维排列整齐,肌丝、肌节清晰,无肿胀,Z线排列整齐;线粒体形状规则,外膜完整,嵴致密、丰富。见图3。
A:对照组;B:CMV组、C:CMV+IAH组 ;红色箭头处为线粒体,黄色箭头处为Z线,绿色箭头处为断裂的肌纤维
3 讨论
腹内高压(intra-abdominal hypertension,IAH)是指由于腹内压力持续性升高大于等于12 mm Hg(1 mm Hg=0.133 kPa)时引起的一系列心、肺、肝、肾、神经等全身各系统功能障碍。流行病学显示,内科及外科重症患者中IAH的发病率分别为54.4%和65.0%,且IAH是重症患者的独立死亡危险因素,伴有IAH的重症患者较不伴有IAH的重症患者病死率增加26% (53% vs. 27%)[8]。有研究表明,腹腔内压力与气道平台压直线相关[9],IAH可降低呼吸系统静态顺应性,增加气道阻力,增加肺泡-动脉氧分压差及呼吸死腔,严重时可导致呼吸功能衰竭[10-11]。Papavramidis等的动物实验显示慢性IAH膈肌肌纤维发生重塑,ⅡA型肌纤维减少,ⅡB型肌纤维增加,提高了膈肌对应负荷增加的能力,但同时慢性IAH增加实验兔膈肌氧化应激反应[12]。
多项研究显示,机械通气时膈肌的去负载失活是诱导膈肌功能失调的重要原因,可能是临床撤机失败的重要原因之一。临床上将之定义为机械通气诱导的膈肌功能不全(VIDD)。IAH对VIDD的影响目前国内外尚无相关报道。本研究结果显示,机械通气6 h后,CMV组Casepase-3蛋白活性表达显著高于对照组(P<0.05),提示在控制通气的早期即可引起膈肌氧化应激的改变,而CMV+IAH组在一定程度上加剧了氧化应激的发生(与对照组比较,P<0.01,与CMV组比较,P<0.05)。氧化应激是VIDD的早期表现,在VIDD的发生和发展过程中起主要作用。氧化应激不仅可造成膈肌结构的直接损伤,还可加速膈肌蛋白分解,导致膈肌萎缩。Zergeroglu等[13]研究发现,控制通气3~6 h,膈肌即可发生氧化应激,导致膈肌蛋白和脂质过氧化,且氧化损伤程度随时间进行性加重,而活性氧族介导的线粒体过氧化损伤可能是导致VIDD的重要原因之一。细胞凋亡的研究中,Casepase-3在凋亡发生过程中起着关键性作用[14]。而CMV+IAH组中膈肌细胞中Caspase-3蛋白表达与CMV组比较明显增强,提示IAH加重控制通气所导致的膈肌氧化应激。
研究发现,控制通气可导致肌原纤维断裂,线粒体肿胀,脂质空泡增加[7,15]。在本研究中,CMV+IAH组出现明显的膈肌超微结构损伤,且较CMV组更剧,考虑可能与以下因素有关。(1)膈肌缺血缺氧:CMV组膈肌被动收缩膈肌血流量的下降,而IAH增加了膈肌局部的压力,进一步加重了膈肌的缺血缺氧;(2)间接损伤:由于腹内高压引起腹腔内各脏器血流减少,导致机体全身炎症反应;(3)机械因素。
正常机体处于氧化和抗氧化的平衡状态。当机体在短时间内产生大量的自由基,超过其清除的能力时就会发生过氧化损伤。机械通气时膈肌的氧化应激将迅速发生。这与膈肌去负载失活的同时肺的反复膨胀而发生被动收缩有关,导致产生自由基的速度及种类均不同于单纯制动的肌肉 。在本实验中发现, CMV组6 h后出现局部肌丝模糊、肌丝紊乱,脂质空泡形成。部分线粒体肿胀明显,嵴膜断裂,空泡形成,提示在实验兔6 h膈肌去负载即出现了膈肌超微结构的改变;而CMV+IAH机械通气组6 h后,膈肌肌节间大量线粒体内膜变形,部分溶解。线粒体内膜受损会破坏其选择通透性,从而破坏内膜两侧质子电化学梯度并导致氧化磷酸化解偶联,从而产生大量的氧自由基 ,损伤膈肌。同时线粒体内膜的损坏影响了ATP能量的生成,加速了细胞的死亡。缺血及缺血再灌注是造成细胞凋亡的另一原因。它们主要造成能量代谢障碍、细胞内钙离子超载及自由基相关的损伤 。在本实验中,尽管动脉血氧分压及血压都保持正常,但是由于实验条件有限,实验过程中无法监测到局部的血流及血氧饱和度。Brancatisano等[15]研究表明被动机械通气能明显降低动物膈肌血流量。这种由机械通气造成的膈肌局部缺血可能是诱发细胞凋亡的原因之一,较高的腹内压有可能加剧局部缺血而加速细胞的凋亡。
参考文献
[1]Manu GM,Michael LC,Andrew K,et al. Results from the International Conference of Experts on Intra-abdominal Hypertension and Abdominal Compartment Syndrome [J]. Intensive Care Med,2006, 32(11):1722-1732.
[2] Joynt GM, Wai JK. Intra-abdominal hypertension and abdominal compartment syndrome - making progress [J]. Anaesth Intensive Care, 2012,40(1):11-13.
[3] Chalkias A, Xanthos T. Intra-abdominal hypertension: a potent silent killer of cardiac arrest survivors [J]. Am J Emerg Med,2012,30(3):502-504.
[4] Mahjoub Y, Lorne E, Maizel J, et al. Effect of intra-abdominal hypertension on left ventricular relaxation: a preliminary animal study [J]. Br J Anaesth,2012, 108(2):211-215.
[5] Mohmand H, Goldfarb S. Renal dysfunction associated with intra-abdominal hypertension and the abdominal compartment syndrome [J]. J Am Soc Nephrol, 2011,22(4):615-621.
[6] 马静,陈华文,吴雷,等.产后大出血腹内高压与急性肾功能衰竭的关系[J].中华急诊医学杂志,2009,18(12):1330-1331.
[7] Sassoon CSH,Caiozzo VJ,Manka A,et al. Altered diaphragm contractile properties with controlled mechanical ventilation [J]. J Appl Physiol,2002,92(6):2585-2595.
[8] Malbrain ML,Chiumello D,Pelosi P,et al. Prevalence of intra-abdominal hypertension in critically ill patients: a multicentre epidemio-logical study [J]. Intensive Care Med,2004, 30(5):822-829.
[9] Vidal MG, Ruiz Weisser J, Gonzalez F, et al. Incidence and clinical effects of intra-abdominal hypertension in critically ill patients [J]. Crit Care Med,2008,36(6):1823-1831.
[10] Brian DK,Louis AG,Edgar JJ,et al. Plateau and transpulmonary pressure with elevated intra-abdominal pressure or atelectasis[J]. J Surl Res,2010,159(1):e17-e24.
[11] Da Silva Almeida JR,Machado FS,Schettino GP,et al. Cardiopulmonary effects of matching positive end-expiratory pressure to abdominal pressure in concomitant abdominal hypertension and acute lung injury [J]. J Trauma,2010 ,69(2):375-383.
[12] Papavramidis TS, Kotidis E, Ioannidis K, et al. The effects of chronically increased intra-abdominal pressure on the rabbit diaphragm [J]. Obes Surg,2012,22(3):487-492.
[13] Zergeroglu MA,McKenzie MJ,Shanely RA,et al. Mechanical ventilation-induced oxidative stress in the diaphragm [J]. J Appl Physiol ,2003,95(3):1116-1124.
[14] Joseph M, McClung, Andreas N, et al. Caspase-3 regulation of diaphragm myonuclear domain during mechanical ventilation-induced atrophy [J]. Am J Respir Crit Care Med,2007, 175(2):150-159.
[15] Brancatisano A, Amis TC,Tully A,et al. Regional distribution of blood flow within the diaphragm [J]. J Appl Physiol,1991,71(2):583-589.
(收稿日期:2012-01-17)
(本文编辑:沈惠云)
DOI:10.3760/cma.j.issn.1671-0282.2012.08.012
基金项目: 浙江省教育厅科研基金资助项目(Y201017208)
作者单位:310016 杭州,浙江大学医学院附属邵逸夫医院 浙江大学邵逸夫医院临床医学研究所
通信作者:应可净,Email:Yingsrrsh@163.com
中华急诊医学杂志2012年8月第21卷第8期Chin J Emerg Med,August 2012,Vol.21,No.8
P851-854
