拟南芥抗旱突变体的筛选和鉴定
2012-09-28张娇娇慈凌坤卢云峰曹树青
张娇娇, 江 力, 杨 杰, 慈凌坤, 卢云峰, 曹树青
(1.合肥工业大学 生物与食品工程学院,安徽 合肥 230009;2.合肥师范学院 生命科学系,安徽 合肥 230061)
干旱是影响植物生长和发育的主要环境因子之一。全球约有43%的耕地为干旱、半干旱地区,严重影响植物的生长发育,造成树木和农作物严重减产。干旱已经成为世界范围内严重影响农作物产量的逆境胁迫之一[1-2],对抗旱作物的育种及抗旱机理的研究具有深远重大的意义。
拟南芥是分子生物学研究的模式植物,它的完整基因组已被成功测定,为研究新基因、基因功能方面提供很多依据。本实验利用甘露醇模拟干旱胁迫筛选拟南芥抗旱突变体,并通过对其形态学及生理生化指标的测定来鉴定抗旱突变体。该研究不仅为抗旱基因克隆及功能分析奠定基础,对于进一步探索水分胁迫信号转导及其应答干旱胁迫分子机制也具有重要的意义。
1 材料与方法
1.1 材料与培养
本实验所用拟南芥(Arabidopsis)生态型为Columbia,野生型(WT)和突变体(Mutant)来自美国拟南芥种质资源中心[3],实验采用2种方法培养植株[4-5]:
(1)培养基培养。种子经0.1%HgCl2消毒3min后,用无菌水冲洗4~5次,然后将种子点种在加入1.5% 蔗糖和0.8% 琼脂的培养基中;并用封口膜封装,于4℃条件下处理2d后转至光周期16h光/8h暗、光照100μmol/(m2·s2)、温度22~23℃的培养室。
(2)土壤培养。① 幼苗移至装有混合好的灭菌营养土的盆钵中,置于光周期16h光/8h暗、光照100μmol/(m2·s2)、温度22~23℃的培养室内,移栽和开花时各浇1次营养液,并根据植株生长需要浇以适量水;② 种子播种于装有灭菌土的盆钵中,浇含有不同浓度甘露醇的营养液,置于光周期16h光/8h暗、光照100μmol/(m2·s2)、温度22~23℃的培养室内培养。
1.2 筛选
1.2.1 确定抗旱突变体的筛选浓度
将野生型拟南芥种子分别点在甘露醇浓度为250、300、350、400mmol/L的 MS培养基上,每个浓度3个培养皿,每个培养皿中播种50粒种子,成5×10矩阵,水平放置培养。经过4℃冰箱黑暗2d春化、光照培养7~10d后,记录发芽率。以野生型几乎不能发芽或者发芽不能存活的甘露醇浓度为临界筛选浓度。
1.2.2 拟南芥抗旱突变体的筛选
以确定的筛选浓度配制培养基进行筛选。培养皿中央点野生型种子作为对照,其余部分点突变体种子,水平放置培养。定期观察并拍照,若有能生长的突变体幼苗,作为候选突变体,将之移栽到土壤中培养。
1.3 鉴 定
1.3.1 不同浓度甘露醇处理下发芽率比较
分别将野生型和突变体种子点种在含有不同浓度甘露醇(0、100、200、300mmol/L)的 MS培养基中,成5×10矩阵,培养皿封口后放入4℃冰箱中春化2d后置于培养室中培养,观察记录发芽率。
1.3.2 不同浓度甘露醇处理下根长比较
突变体和野生型均以20粒种子点种在含有不同浓度甘露醇(0、50、100、150mmol/L)的1/2MS培养基上成一直线,每个浓度做3个平行,经过4℃冰箱春化2d,置于培养室中竖直培养20~25d后,记录幼芽根长。
1.3.3 脯氨酸质量比的测定
取在浇有不同浓度甘露醇(0、100、200、300、400mmol/L)营养液的土壤中生长21d一致的拟南芥野生型和突变体幼苗,用分光光度法[6]测定脯氨酸质量比。测定重复3次。
1.3.4 叶绿素质量比的测定
野生型和突变体播种于浇有不同浓度甘露醇(0、200、300mmol/L)营养液的土壤中生长21d后,取形态大小相似的幼苗,测定叶绿素质量比[6]。测定重复3次。
1.3.5 相对电导率的测定
野生型和突变体播种于浇有不同浓度甘露醇(0、100mmol/L)营养液的土壤中生长21d后,取形态大小相似的幼苗,测定相对电导率[6]。测定重复3次。
2 结果与分析
2.1 筛选
2.1.1 拟南芥抗旱突变体的筛选浓度的确定
不同甘露醇浓度下拟南芥野生型发芽率情况如图1所示。从图1可以看出,随着甘露醇浓度的升高,拟南芥野生型种子发芽率逐渐降低,以野生型几乎不能发芽或者发芽不能存活的甘露醇浓度为临界筛选浓度,所以本实验确定甘露醇浓度为350mol/L为抗旱突变体的筛选浓度。
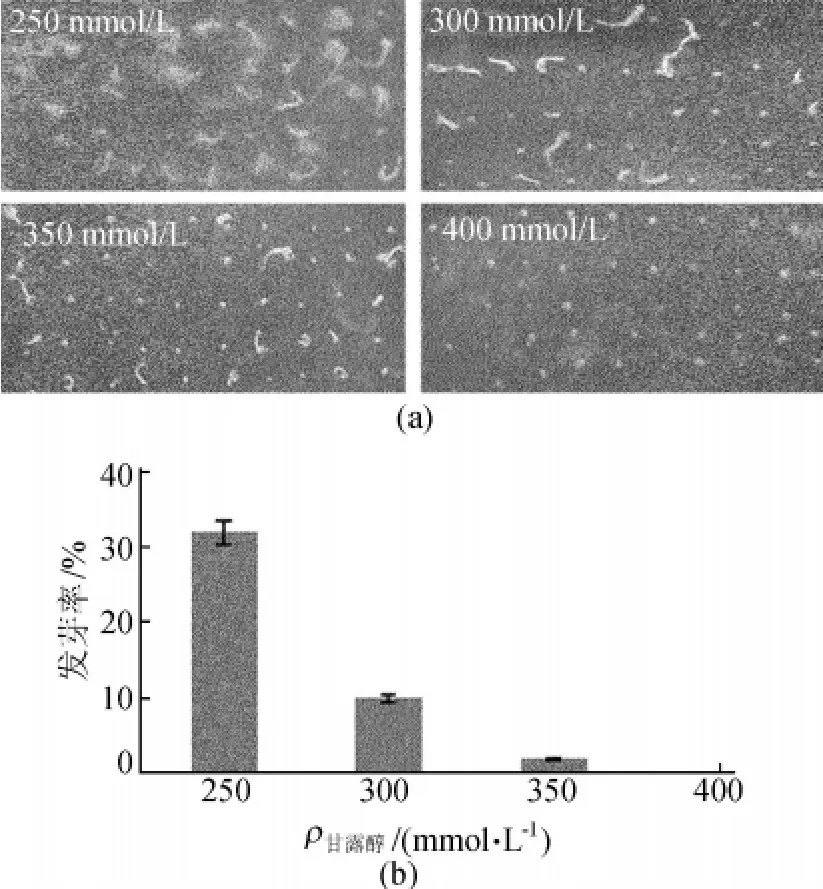
图1 不同甘露醇浓度下拟南芥野生型发芽率比较
2.1.2 拟南芥抗旱突变体的筛选
在甘露醇筛选浓度为350mmol/L下能萌发生长的突变体幼苗,作为候选突变体,如图2所示。

图2 甘露醇浓度为350mmol/L时筛选的2株候选突变体
图2箭头所示X1、X2为发芽较好的幼苗,挑选出来移栽到土壤培养基中作为候选突变体培养。
2.1.3 拟南芥候选抗旱突变体的土壤培养
由于基因突变的复杂性及环境等因素的影响,移栽到土壤培养基中的候选突变体,经过一段时间的培养,最后有1株候选突变体成活,命名为vem1。
vem1的整个生长周期如图3所示。

图3 候选突变体的生长周期
2.2 鉴定
2.2.1 不同浓度甘露醇处理下发芽率的比较
不同浓度甘露醇处理下野生型和vem1的发芽率情况如图4所示。
MS培养基中(甘露醇0mmol/L),突变体vem1与野生型发芽率无明显差异;甘露醇浓度为100、200、300mmol/L时,突变体vem1与野生型发芽率有明显差异,突变体vem1发芽率分别比野生型高22%、40%、22%。随着甘露醇浓度的提高,两者发芽率都有下降,但是突变体vem1发芽率降低的趋势远远低于野生型,说明在甘露醇模拟的干旱胁迫下,突变体vem1相比于野生型有较高的抗性。

图4 不同浓度甘露醇处理下野生型和vem1的发芽率
2.2.2 不同浓度甘露醇处理下根长的比较
不同浓度甘露醇处理下野生型和vem1的根长情况如图5所示,相同浓度甘露醇胁迫条件下,vem1植株平均根长比野生型长。在甘露醇浓度为0、50、100、150mmol/L时,vem1植株平均根长分 别 比 野 生 型 长 28.6%、49.4%、10.5% 和14.3%。这说明vem1在干旱条件下长势比野生型好,根长较长可增加植株吸收矿质营养,促进植株生长。

图5 不同浓度甘露醇处理下野生型和vem1的根长比较
2.2.3 不同浓度甘露醇处理下脯氨酸质量比
随着甘露醇胁迫浓度的提高,野生型和突变体拟南芥植株的脯氨酸质量比都随之增加,但突变体vem1的脯氨酸质量比增加十分显著,如图6所示。

图6 不同浓度甘露醇处理下脯氨酸质量比
甘露醇浓度为200、300mmol/L时,vem1的脯氨酸质量比分别比野生型增加了190.8%和180.9%。脯氨酸具有易于水合的趋势和较强的水合能力,植物在干旱胁迫下,通过提高体内脯氨酸含量,增加了细胞液的浓度,提高了细胞的渗透压,对细胞起保护作用。此外,脯氨酸作为活性氧的清除剂,保护蛋白质分子[7],故干旱胁迫下植株体内迅速累积脯氨酸,对提高植物的抗旱性具有重要意义[8]。
2.2.4 不同浓度甘露醇处理下叶绿素质量比
野生型和突变体vem1在不同浓度甘露醇处理下叶绿素质量比的变化如图7所示。

图7 不同浓度甘露醇处理下叶绿素质量比的变化
植物在干旱胁迫下,水分不足光合作用下降,叶片黄化,叶绿素质量比降低[9-10]。由图7可以看出,随着甘露醇胁迫浓度的提高,叶绿素质量比下降,300mmol/L甘露醇处理下下降最为明显。同等甘露醇浓度下,突变体vem1植株叶绿素质量比明显高于野生型,进一步验证了突变体vem1具有较好的抗旱性。
2.2.5 不同浓度甘露醇处理下相对电导率
野生型和突变体vem1在不同浓度甘露醇处理下相对电导率的变化如图8所示,甘露醇浓度为100mmol/L下,野生型和突变体vem1的相对电导率均高于0mmol/L下的电导率,这是由于植物在逆境下细胞膜容易破裂,膜蛋白受伤害使胞质液外渗,故相对电导率增大。突变体vem1的相对电导率比野生型低,表明突变体vem1膜蛋白受损较小,即突变体vem1较野生型更抗旱。

图8 不同浓度甘露醇处理下相对电导率的变化
3 讨 论
目前对干旱的研究主要集中在植物抗旱机理的揭示和抗旱植株的筛选与育种2个方面[11-12]。发现和克隆与干旱胁迫信号转导相关的组分是探索其分子机制和应用的首要条件,因此筛选与干旱胁迫相关的突变体并对其进行研究非常重要[13]。本实验采用以发芽率为指标、以甘露醇模拟水分胁迫来进行拟南芥抗旱突变体的筛选。
植物抗旱可通过渗透调节、质膜保护和抗氧化防御系统等应激反应来实现[14]。植物在经受干旱胁迫时,通过细胞对干旱信号的感知和传导,调节基因表达,产生新蛋白质,从而引起大量形态、生理和生化上的变化。干旱胁迫对植物在细胞、器官、个体及群体等水平上的形态指标有显著影响,也会影响其光合作用、渗透调节及抗氧化系统等生理生化指标。抗旱突变体相对野生型,其根部较为发达,含有较高水平的脱落酸和脯氨酸[15],具有较高的抗氧化胁迫的能力[16]。本实验中,突变体vem1相对于野生型表现出了较好的抗旱性,表现为发芽率、脯氨酸质量比、叶绿素质量比相对较高,根长抑制较轻,相对电导率较低等。通过实验可以确定vem1是拟南芥抗旱突变体。然而此突变体以何种信号途径调控其抗旱则有待下一步的研究,即利用Tail-PCR克隆出相应的基因,进一步解析干旱胁迫信号转导及其应答胁迫的分子机制。
[1]汤章城.植物对水分胁迫的反应和适应性:I.抗逆性的一般概念和植物的抗涝性[J].植物生理学通讯,1983(3):21-29.
[2]Lui G C,Fulvia R,Franz W,et al.Drought tolerance improvement in crop plants:An integrated view from breeding to genomics[J].Field Crops Research,2008,105:1-14.
[3]张 健,徐金相,孔英珍,等.化学诱导激活型拟南芥突变体库的构建及分析[J].遗传学报,2005,32(10):1082-1088.
[4]慈凌坤,江 力,狄东伟,等.拟南芥耐硒突变体的筛选和鉴定[J].合肥工业大学学报:自然科学版,2011,34(6):927-930.
[5]Murashige T,Skoog F.A revised medium for rapid growth and bioassays with tobacco tissue culture[J].Physiol Plant,1962,15:473-497.
[6]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006:134-283.
[7]张 彤,齐 麟.植物抗旱机理研究进展[J].湖北农业科学,2005(4):107-110.
[8]Alcazar R,Planas J,Saxena T,et al.Putrescine accumulation confers drought tolerance in transgenic Arabidopsis plants over-expressing the homologous Arginine decarboxylase2gene[J].Plant Physiology and Biochemistry,2010,48:547-552.
[9]Li R H,Guo P G,Michael B,et al.Evaluation of Chlorophyll content and fluorescence parameters as indicators of drought tolerance in Barley[J].Agricultural Science in China,2006,5:751-757.
[10]葛 培,郭广芳,晏月明.小麦抗旱机理研究进展[J].生物技术通报,2010(4):22-27.
[11]Zhao J S,Ren W,Zhi D Y,et.al.Arabidopsis DREB1A/CBF3bestowed transgenic tall fescue increased tolerance to drought stress[J].Plant Cell Reports,2007,26:1521-1528.
[12]Kantar M,Lucas S J,Budak H.MiRNA expression pat-terns of Triticum dicoccoides in response to shock drought stress[J].Planta,2011,233:471-484.
[13]Pose D,Castanedo I,Borsani O,et.al.Identification of the Arabidopsis dry2/sqe1-5mutant reveals a central role for sterols in drought tolerance and regulation of reactive oxygen species[J].The Plant Journal,2009,59:63-76.
[14]Ashrafa M.Inducing drought tolerance in plants:Recent advances[J].Biotechnology Advance,2010,28:169-183.
[15]徐云刚,詹亚光.植物抗旱机理及相关基因研究进展[J].生物技术通报,2009(2):11-17.
[16]Yu H,Chen X,Hong Y,et al.Activated expression of an Arabidopsis HD-START protein confers confers drought tolerance with improved root system and reduced stomatal density[J].Plant Cell,2008,20:1134-1151.
