早期微孔手术对30例脑出血后继发性脑损伤和预后的影响
2012-09-27张清涛宋春旺
张清涛,宋春旺,汪 峰,程 远
(重庆医科大学附属第二医院神经外科 400010)
高血压脑出血(hypertensive intracerebral hemorrhage,HICH)是一类极具破坏性、病死率和致残率极高的出血性脑血管性疾病,全世界每年患病人口超过千万[1-2]。其危害主要归因于发病时出血对神经系统的破坏性损伤和血肿代谢产物引起的继发性脑损伤[3-4],而脑水肿是继发性脑损伤的重要病理过程,也是导致脑出血后病情恶化的重要因素[5-6]。HICH手术的目的主要在于清除血肿,降低颅内压,更重要的是阻断和减少引起继发性脑损伤的病理毒性因子。以往研究主要是通过体外或动物实验证实上述理论,本文在严格筛选病例基础上,应用脑水肿相对增量(relative growth of perihematomal edema volume,RE)和日常生活活动量表,观察微孔血肿穿刺引流术对HICH患者RE和神经功能早、中期预后的影响,并进一步分析其相关性。
1 资料与方法
1.1 一般资料 选择2008年6月至2010年6月本院收治的高血压基底节脑出血患者60例。分为保守组(30例),其中男12例,女18例,平均年龄(58.53±12.76)岁;微孔组(30例),其中男15例,女15例,平均年龄(55.17±14.98)岁。两组患者的一般资料比较见表1。入选标准:(1)诊断符合第4届全国脑血管学术会议制定的高血压脑出血病诊断标准;(2)发病12h内入院,CT证实为基底节出血;(3)血肿量18~32mL;(4)有明显神经功能障碍(偏瘫、失语);(5)入院第6~8、12~16及19~23天均行头部CT检查;(6)随访时间大于3个月。排除标准:(1)血肿破入脑室伴脑室积血、蛛网膜下腔出血及颅内多发出血;(2)临床体征较轻(瘫痪侧肢肌力4级及以上、优势半球出血但Glasgow昏迷评分标准语言功能评分大于4分);(3)创伤、吸毒、服用抗凝药物、血液系统疾病等引发的颅内出血;(4)具有严重心、肺功能障碍者;(5)治疗或随访期间再出血患者;(6)失访、死亡者。
1.2 治疗方法 所有患者入院后予常规控制血压、营养神经、降颅压、防治感染等治疗[7]。微孔组于入院后24h内采用YL-1型一次性颅内血肿粉碎穿刺针按“颅内血肿微孔穿刺引流操作常规”行微孔穿刺清除血肿[8]。首次清除血肿量不大于术前CT血肿计算量的50%,当残余血肿量小于术前20%时即拔针。两组患者均于入院后第7~21天时给予早期康复治疗,康复次数为5~20次。
1.3 疗效评价 均使用美国GE公司生产的16排螺旋CT进行检查,并使用其自带DICOM软件和多田公式测量血肿和水肿血肿复合物体积。采用日常生活活动量表对患者预后进行评价。血肿或血肿水肿复合物体积均按多田公式计算:π/6长轴×短轴×出血层面或水肿层面高度,水肿量=血肿水肿复合体量-血肿量;日常生活活动量表增量(BS)=第n天日常生活活动量表-入院日常生活活动量表;第n天RE=(第n天水肿量-入院水肿量)/入院血肿量。
表1 两组患者的一般资料比较(±s)

表1 两组患者的一般资料比较(±s)
组别 入院时舒张压(mm Hg) 意识(分) GCS评分(分) 血肿量(mL) 血糖(mmol/L) 白细胞(×109/L)入院日常生活活动量表(分)保守组 108.67±14.34 2.10±0.55 11.43±2.86 23.10±6.77 6.85±1.26 8.75±2.26 33.03±7.20微孔组 102.37±14.09 2.67±0.71 9.63±2.76 27.43±10.51 6.48±1.28 10.26±3.50 26.83±7.06
1.4 统计学处理 应用SAS8.0USA软件进行统计数据分析,计量资料以±s表示,相关性研究分别采用相关性、简单线性回归和多重线性回归分析,计量资料之间比较均采用t检验,以P<0.05为差异有统计学意义。
2 结 果
入院后第1、2、3周RE比较见表2。不同时间点RE与BS的相关性比较见表3。以第3周BS为因变量,第1、2、3周的RE为自变量进行简单线性回归分析见表4和图1。以第3个月BS为因变量,第1、2、3周的RE为自变量进行简单线性回归分析见表5和图2。
表2 入院后第1、2、3周RE比较±s)
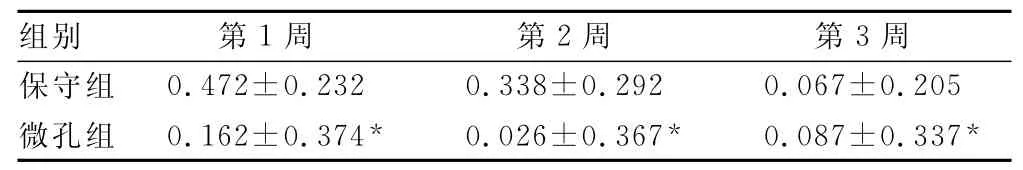
表2 入院后第1、2、3周RE比较±s)
*:P<0.05,与保守组比较。
组别 第1周 第2周 第3周0.472±0.232 0.338±0.292 0.067±0.205微孔组 0.162±0.374* 0.026±0.367* 0.087±0.337保守组*
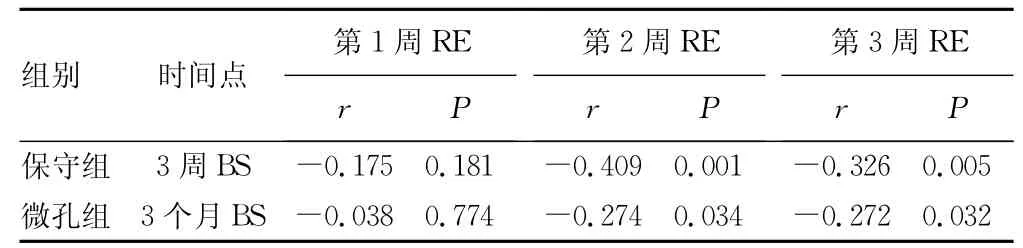
表3 不同时间点RE与BS的相关性比较

表4 以第3周BS为基因量,第1、2、3周的RE为自变量进行简单线性回归分析
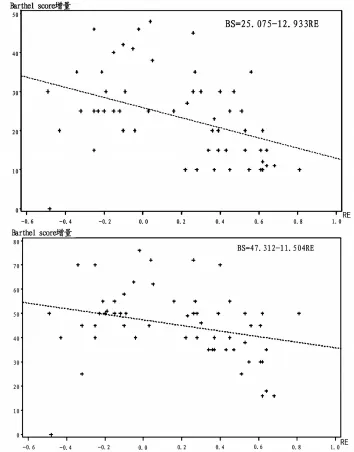
图1 以第2周RE为自变量和第3周BS为因变量的简单线性回归分析
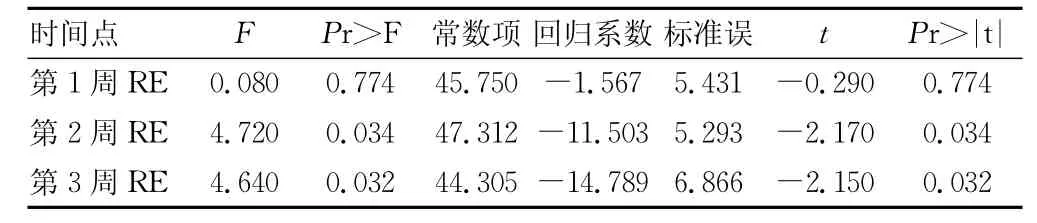
表5 以第3个月为基因量,第1、2、3周的RE为自变量进行简单线性回归分析
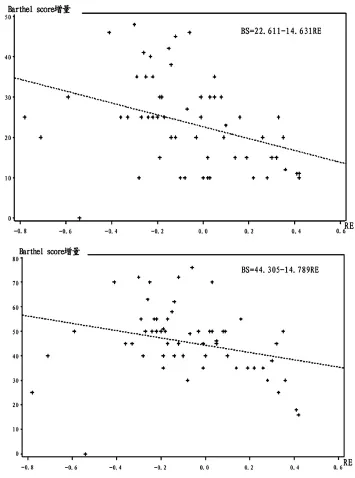
图2 以第3周RE为自变量和第3个月BS为因变量的简单线性回归分析
3 讨 论
有关自发性脑出血的外科干预一直存在争议,包括近期国内外针对HICH的手术指南认为幕上血肿手术指征血肿体积需大于30mL,但临床发现位于基底节的30mL左右的血肿经保守治疗,仍有相当部分患者遗留重残。而采用骨瓣成形开颅术虽可以清除血肿,有效降低颅内压,但对正常脑组织的创伤较大,反而加重了术后脑水肿的发生,不利于患者神经功能的恢复。微孔手术以其创伤极小,又可有效清除血肿,减轻血肿的占位效应及其继发性损害,已逐渐被接受和采用。
有研究证实,脑水肿是影响HICH预后的重要因素,凝血酶是脑出血后脑水肿形成中较为重要的物质[9-11]。凝血酶对神经细胞的毒性作用和对血脑屏障的破坏可能是脑出血后脑水肿形成的重要机制之一。红细胞的分解产物如血红蛋白和ADP等在脑出血后脑水肿形成的中、晚期起重要作用[12]。来源于血肿的血浆蛋白质,聚积于血肿周围白质并迅速引起血肿周围脑水肿[13]。血肿边缘缺血的高峰期是出血后的早期,而再灌注损伤是血肿边缘水肿形成的发病机制之一[14]。本研究证实,自发性脑出血的微孔手术能早期及时清除血肿。早期脑水肿的形成主要归因于血肿占位效应和血凝块回缩,血浆蛋白和纤维蛋白渗出改变血肿周围胶体渗透压所致,前3d脑水肿呈逐渐增加趋势,大部分在第3~7天达到高峰,微孔手术在脑水肿高峰期前通过减小血肿量,可明显缓解脑水肿,帮助患者意识、语言及肢体活动等神经功能早期恢复,改善预后,提高生活质量。而迟发性脑水肿与缺血后再灌注和血块继续收缩凝血酶生成及红细胞降解有关。微孔手术治疗HICH的目的即在脑水肿高峰期前通过减少血肿体积以减轻其对正常脑组织的机械压迫,改善局部循环,减少血细胞分解产物,减轻血肿导致的一系列继发性损伤,从而减轻脑水肿的发生。本研究发现RE越小,BS越高;治疗3周及3个月后,微孔组BS明显高于保守组;入院后第1、2、3周微孔组的意识、GCS评分、肢体活动及语言评分增量明显高于保守组,通过以上统计学分析证实微孔手术治疗可通过减轻RE明显改善HICH预后。故认为对于中小量高血压基底节血肿(18~32mL)采用微孔引流术治疗明显优于内科保守治疗,可以降低RE,促进患者意识及神经功能的早期恢复,改善预后。
综上所述,微孔穿刺引流术为简单、易行、创伤小、局部麻醉对患者生理状态影响较小、并发症发生率低的一种手术方式,对于中小量血肿的早期穿刺引流能够减轻继发性损伤,减轻脑水肿及RE,降低病残率,提高患者生活质量,明显缩短患者住院时间,降低医疗费用。为保证血肿穿刺的准确性,可以进行立体定向穿刺。因本研究病例数目有限,对于出血部位统归为基底节,未进一步划分为内囊、壳核、外囊、尾状核等出血,未对是否为优势半球出血进行更为系统的研究,且未对微孔组使用尿激酶等药物进行相关性研究,导致出现在语言及肢体瘫痪恢复的数值增量虽微孔组较保守组增高,但差异无统计学意义。同时本研究3个月以后回访资料不全,未能对患者远期恢复情况进行跟踪等,故其结论还需大规模多中心前瞻性研究证实。
[1] Qureshi AI,Tuhrim S,Broderik JP,et al.Spontaneous intracerebral hemorrhage[J].N Engl J Med,2001,311(19):1450-1460.
[2] Flaherty ML,Haverbusch M,Sekar P,et al.Long term mortality after intracerebral hemorrhage[J].Neurology,2006,66(8):1182-1186.
[3] Castillo J,Davalos A,Alvarezsabin J,et al.Molecular signatures of brain injury after intracerebral hemorrhage[J].Neurology,2002,58(4):624-629.
[4] Hua Y,Xi G,Keep RF,et al.Complement activation in the brain after experimental intracerebral hemorrhage[J].Neurosurgery,2000,92(6):1016-1022.
[5] Zazulia AR,Diringer MN,Derdeyn CP,et al.Progression of mass effect after intracerebral hemorrhage[J].Stroke,1999,30(6):1167-1173.
[6] Inaji M,Tomita H,Tone O,et al.Chronological changes of perihematomal edema of human intracerebral hematoma[J].Acta Neruochir Suppl,2003,86(3):445-448.
[7] 阳清伟,刘鸣.脑出血治疗指南及临床研究证据[J].中国神经精神疾病杂志,2003,29(6):82-84.
[8] 吕涌涛,张化一.微创清除术治疗基底节区出血的简易三维立体定位方法[J].中国急救医学,2001,21(2):106-108.
[9] Lee KR,Betz AL,Keep RF,et al.Intracerebral infusion of thrombin as a cause of brain edema[J].J Neurosurg,1995,83(6):1045-1050.
[10]Lee KR,Colon GP,Betz AL,et al.Edema from intracerebral hemorrhage:the role of thrombin[J].J Neurosurg,1996,84(1):91-96.
[11]Lee KR,Kawai N,Kim S,et al.Mechanisms of edema formation after intracerebral hemorrhage:effects of thrombin on cerebral blood flow,blood-brain barrier permeability,and cell survival in a rat model[J].J Neurosurg,1997,86(2):272-278.
[12]Xi G,Keep RF,Hoff JT.Erythrocytes and delayed brain edema formation following intracerebral hemorrhage in rats[J].J Neurosurg,1998,89(6):991-996.
[13]Wagner KR,Xi G,Hua Y,et al.Lobar intracerebral hemorrhage model in pigs:rapid edema development in perihematomal white matter[J].Stroke,1996,27(3):490-497.
[14]Mayer SA,Lignelli A,Fink ME,et al.Perilesional blood flow and edema formation in acute intracerebral hemorrhage:a SPECT study[J].Stroke,1998,29(9):1791-1798.
