分子印迹整体萃取柱的制备及其应用*
——介绍一个综合化学实验
2012-09-25张静王玲玲
张静 王玲玲
(陕西师范大学化学与化工学院 陕西西安 710062)
在武汉大学主编的《分析化学》(第4版)中增加了固相萃取和固相微萃取的内容,但在分析化学实验课的内容中,实验对象多为简单样品,多数情况下学生不需要进行复杂的样品前处理就可以直接进行测定。因此,我们在课堂教学中强调分析过程包括取样、试样的处理与分解、分离与富集、分析方法的选择与分析测定、分析结果的计算与评价,共5步。但在实验中,学生对此体会并不深刻。此外,传统实验以开设验证性实验和简单实验为主,设计性内容较少,涉及到的现代新技术、新应用的内容也比较少,这不利于调动学生学习的积极性和主动性,也不利于培养学生的综合能力。
综合实验是在学生完成基础课程学习的基础上开设的一门实验课程,在内容上不局限于一门课程的内容,可以包含在大学前几年中学习的所有内容,同时实验课时也比基础实验课时长,能为学生提供一个应用所学知识解决问题的体验过程,并在此过程中培养学生的学习兴趣,提高他们解决问题的能力。下面结合教师的科研工作介绍一个适合化学专业三、四年级学生的综合型实验。
1 实验目的
(1) 让学生从问题出发,完成从取样、样品制备、分析条件优化到样品测定及数据处理的分析全过程,培养学生综合分析问题和解决问题的能力。
(2) 了解分析化学的新内容及进展,学习固相萃取技术。
(3) 了解以士的宁为模板的分子印迹整体聚合物的原位制备方法。
2 实验原理
分子印迹技术(molecular imprinting technique, MIT)是指为获得在空间结构和结合位点上与某一特定目标分子(也称模板分子或印迹分子)完全匹配的聚合物的制备技术,具有构效预定性、识别专一性和广泛实用性3大特性[1]。其基本原理如图1所示。模板分子先与功能单体相互结合形成超分子复合物,然后在交联剂作用下,形成三维交联高分子聚合物;当在一定洗脱条件下除去模板分子后,即可得到具有识别空腔的分子印迹聚合物(molecularly imprinted polymers,MIPs)。这种聚合物与含有模板分子的待测溶液接触时,能对模板分子显示出高选择性的结合能力,即分子识别能力[2]。MIPs具有特异选择性、识别专一性和广泛实用性,同时又具有物理化学稳定性和机械强度好、保存方便、使用寿命长和制备简单等特点[3]。因此,MIPs在色谱分离、固相萃取、临床药物分析、膜分离、模拟酶催化和仿生传感器等领域的应用日益广泛,尤其在样品前处理领域显示出独特的优势。
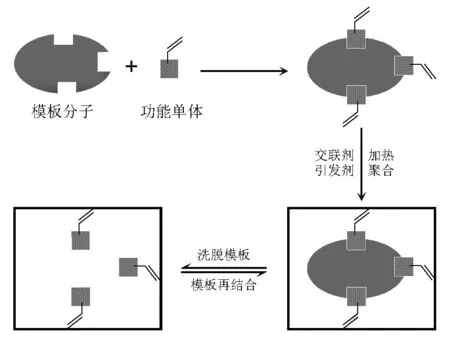
图1 分子印迹聚合物的制备原理
3 实验仪器及药品
3.1 药品
士的宁标准品,马钱子碱标准品;α-甲基丙烯酸(MAA),使用前减压蒸馏;乙二醇二甲基丙烯酸酯(EDMA),使用前用10%氢氧化钠溶液萃取3次,再用去离子水洗涤3次,最后用无水硫酸镁干燥;偶氮二异丁腈(AIBN),使用前用乙醇重结晶;三甲氧基丙烯基硅烷;十二醇,甲醇,乙腈,磷酸二氢钾,乙酸,盐酸,磷酸,氯仿,三乙胺,氢氧化钠,甲苯,无水硫酸钠,以上试剂均为分析纯。
市售的万通筋骨片、风湿关节炎片、胃尔康片和腰痛宁胶囊等药品。
3.2 仪器
HSS-1(B)型恒温浴槽(成都仪器厂);PHS-3C型PH计(上海精密科学仪器有限公司);KQ2200DA型数控超声波清洗器(昆山市超声仪器有限公司);BS124S电子天平(常州万泰天平仪器有限公司);日本岛津20A液相色谱系统:包括两台LC-20AT、一台SPD-20A和六通进样阀,工作站:N2000;Eclipse XDB-C18柱。
4 实验内容
4.1 分析条件的建立及标准曲线的绘制
色谱条件为:色谱柱,Eclipse XDB-C18柱;流动相:甲醇-乙腈-KH2PO4(10mmol/L)-三乙胺(用H3PO4调pH至2.50)(体积比为5:10:85:0.5)等度洗脱,流速0.5mL·min-1;检测波长254nm,进样体积为20μL;柱温30℃。在此色谱条件下,分别取质量浓度0.010、0.025、0.050、0.10、0.25、0.50和0.75g·L-1的士的宁标准溶液进样,记录色谱图;以标准溶液的峰面积对浓度绘制标准工作曲线,并计算工作曲线的线性范围及线性相关系数。每个浓度样品重复测定3次,并计算相对标准偏差(RSD)。
4.2 分子印迹整体聚合物的制备
4.2.1 玻璃管的预处理
先用水洗干净玻璃管(d=0.5cm,L=5.0cm,尺寸可以根据实际情况调节,也可用玻璃滴管),再用1mol·L-1氢氧化钠溶液浸泡2小时,取出水洗后,用2.0mol·L-1盐酸溶液浸泡2小时,取出用去离子水洗至中性,放入烘箱烘2~3小时后取出备用[4]。向处理好的玻璃管中加入通氮气除氧的5%硅烷化试剂的甲苯溶液,密封两端,在90℃下静置2小时。
4.2.2 士的宁分子印迹聚合物的合成
将25.5mg模板分子士的宁、0.025mL单体甲基丙烯酸、0.22mL交联剂乙二醇二甲基丙烯酸酯、致孔剂(0.07mL甲苯、0.39mL十二醇)依次加入容器中,超声处理使其成为均一体系,加入2.4mg引发剂偶氮二异丁腈超声处理至完全溶解,通氮气5分钟,然后将上述溶液加入硅烷化处理过的玻璃管中,用硅胶头密封两端,在50℃恒温水浴条件下聚合[5]。反应12小时后,打开两端的密封头,采用如图2的装置,用甲醇-乙酸(体积比为4:1)溶液冲洗玻璃管柱,直至洗脱液中检测不出模板分子士的宁(用紫外-可见分光光度计或液相色谱对洗脱液进行检测)。
制作空白柱时,除不加模板分子外,均按照上述方法制备。

图2 洗涤模板装置
4.3 洗脱条件的优化
4.3.1 甲醇比例
准确吸取0.50mL质量浓度为1.0g·L-1的士的宁水溶液,加到制备的萃取柱中,用甲醇比例(体积分数)分别为30%、40%、50%、60%、70%的水溶液0.50mL作清洗液和洗脱液(清洗总体积均为2.0mL),收集洗脱液,空气流吹干,定容到0.10mL,取20μL用液相色谱测定其含量,通过与标准溶液的峰面积比例计算回收率。以回收率最低的甲醇比例作为清洗液中的甲醇比例;以回收率最高的甲醇比例作为洗脱液的甲醇比例。
4.3.2 pH
同4.3.1,以pH分别为2.0、3.0、4.0、5.0、6.0、7.0、8.0的磷酸缓冲液和甲醇混合液(体积分数为50%)为洗脱液测定回收率,以回收率最低的pH作为清洗液的酸度;以回收率最高的pH作为洗脱液的酸度。
4.4 回收率测定
分别取0.050、0.10和0.15mL质量浓度为1.0g·L-1的士的宁水溶液,加到制备的萃取柱中,用4.3确定最佳条件的清洗液洗4次,每次0.50mL,再用4.3确定最佳条件的洗脱液洗脱4次,收集洗脱液,空气流吹干,定容到0.10mL,取20μL,用液相色谱测定含量,每个浓度的样品测定3次,计算回收率及标准偏差。非印迹柱的回收率同法测定。
4.5 识别能力考查
选取与士的宁结构相似的马钱子碱作为竞争分子,同4.3的方法,测定马钱子碱在固相萃取小柱上的回收率,通过比较马钱子碱和士的宁的回收率考察得到的固相萃取小柱的专属性。
4.6 样品制备
选取含士的宁的中药(如万通筋骨片、风湿关节炎片、胃尔康片和腰痛宁胶囊等)去除糖衣后研细,准确称取1.0000g,置于带塞的锥形瓶中,加3.0mL氢氧化钠溶液,调节pH=9.0,放置30分钟;然后加20mL氯仿,分3次萃取,收集萃取液,用铺有无水硫酸钠的滤纸过滤,置水浴中蒸干氯仿。加2.0mL甲醇溶解,得萃取溶液[6]。
4.7 样品测定
准确吸取0.50mL萃取液,注入制备的萃取柱中,同4.4的方法测定,记录色谱图并计算样品中的士的宁含量。图3为实际样品的色谱分离图,图中约8分钟处的峰为士的宁的色谱峰。对比图3中的线段2和3,可以清楚地看到士的宁分子印迹固相萃取柱可以有效地纯化和富集样品中的士的宁。
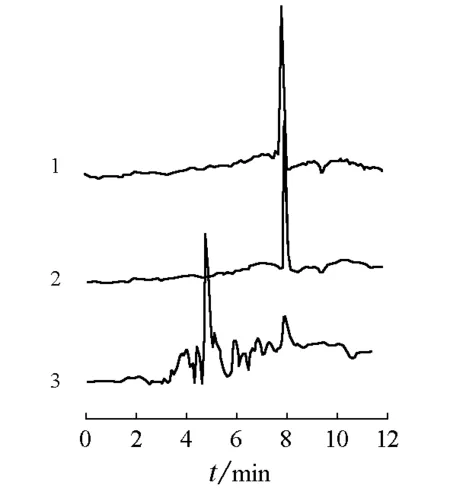
图3 实际样品的色谱分离图1 标准士的宁溶液;2 经过固相萃取柱后的样品;3 未经处理的样品
色谱柱:Eclipse XDB-C18柱;流动相:甲醇-乙腈-KH2PO4(10mmol/L)-三乙胺(pH2.5,体积比5:10:85:0.5)等度洗脱,流速0.5mL/min;检测波长254nm,柱温30℃
5 数据处理
(1) 在建立的色谱条件下绘制士的宁的工作曲线,包括线性范围、线性相关系数、标准偏差。
(2) 分别计算士的宁和马钱子碱在印迹柱和非印迹柱上的回收率。
(3) 计算样品中的士的宁含量。
6 实验注意事项
(1) 对玻璃管进行预处理是为了防止整体柱柱床与玻璃管内壁间产生裂缝。由于硅烷化试剂易与水和醇反应而失效,所以应干燥保存;在处理玻璃管时,一定要保证玻璃管内壁干燥。
(2) 在合成聚合物时,如果室温较高(超过25℃),加入引发剂偶氮二异丁腈后,在进行超声处理和通氮气时,最好将反应混和液放在冰浴中,以防止在容器中发生聚合反应。
7 总结
分子印迹整体萃取柱的制备及其应用作为化学相关专业学生的综合实验,能使学生从解决生活中的实际问题出发,通过取样、样品制备、分析条件优化、样品测定及数据处理等步骤,体验从提出问题到解决问题的全过程。本实验能引发学生进行思考,使他们更全面地理解和运用课堂知识,有利于培养学生分析问题和解决问题的能力;同时,实验中使用的样品直接来自生活,在实验内容中融合了样品前处理领域的新技术和新方法,可以有效地激发学生的科研积极性和学习兴趣。
[1] Jafari M T,Rezaei B,Zaker B.AnalChem,2009,81(9):3585
[2] Haupt K,Mosbach K.ChemRev,2000,100(7):2495
[3] Haupt K.ChemCommun,2003(2):171
[4] 张静,贺浪冲,傅强.分析化学,2005,33(1):113
[5] Zhang J,Yue X F,Liang P P.JLiqChromatogrRelatedTechnol,2010,33(6):770
[6] 刘刚,周健,罗毅.广东药学院学报,2003,19(3):211
