桦木酸对小鼠免疫器官抗氧化能力的影响
2012-09-20易金娥
易金娥 屠 迪 邬 静 袁 慧
(湖南农业大学动物医学院,长沙 410128)
随着现代饲养业集约化程度的不断提高,氧化应激在畜禽生产中的危害已大量显现,如何减少或缓解畜禽的氧化应激已成为现代养殖业的重大课题。一些具有抗氧化、清除自由基作用的植物源性免疫调节剂可望能有效地调控机体的氧化应激进程,进而保障机体细胞内外环境的平衡和生理机能健康。桦木酸(betulinic acid,BA)属于羽扇豆烷型五环三萜类化合物,可从多种植物中分离得到,如桦木科、桃金娘科、鼠李科、五加科等,主要分布于桦木科桦木属植物中,尤其以桦树的外皮中最为丰富[1]。国外对BA的研究主要集中在抗肿瘤、抗艾滋病、抗菌以及其他药理作用[2]方面,国内对BA的研究主要集中在对肿瘤细胞凋亡的影响[3-4]方面,而其对正常细胞的作用未见系统研究。BA对正常细胞或机体具有保护作用,该保护作用可能与抗氧化应激有一定的关系。BA能调控细胞周期调节蛋白,通过降低活性氧(ROS)的生成和核转录因子 -κB(NF-κB)的活性,抑制高糖诱导的人主动脉平滑肌细胞和人脐静脉内皮细胞的增殖,并对血管具有保护作用,能有效预防动脉粥样硬化[5-6]。BA对甲醇致肝星状细胞损伤具有保护作用,如抗氧化作用,抑制细胞因子的分泌,抑制转化生长因子 - β(TGF-β)、NF-κB、c-jun氨基末端激酶(JNK)信号转导[7]。作者前期的研究发现,BA能激活小鼠腹腔巨噬细胞,提高其吞噬能力和能量代谢水平,增强机体抗氧化能力[8];进一步的研究发现,BA具有一定的免疫调节作用,对小鼠的细胞免疫、体液免疫和非特异免疫功能有明显的增强作用[9-10]。BA药理作用的发挥可能与提高机体的免疫能力和抗氧化应激有关,不一定直接作用于感染或肿瘤细胞。因此,本试验拟采用体内给药途径,系统研究BA对小鼠免疫器官抗氧化能力的影响,为BA的抗氧化应激研究提供一定的理论依据。
1 材料与方法
1.1 试验材料
试验用BA是以白桦树皮(2009年春季收集于波兰弗罗兹瓦夫市,经60℃烘干后贮藏在黑暗、干燥处备用)为原料,按参考文献[11]的方法在波兰弗罗兹瓦夫环境与生命科学大学自制获得。具体方法如下:称取白桦树皮粉末15 g,用200 mL甲醇70℃加热回流3 h,减压干燥并用二氯甲烷溶解,再加2 mol/L氢氧化钠(NaOH)200 mL搅拌分层,收集下层液,减压蒸干并用适量乙醚溶解,加适量的水充分摇匀,收集上层液,减压干燥得桦木醇粗品3.452 g。取桦木醇粗品,硅胶柱层析后减压干燥得桦木醇纯品。桦木醇纯品用适量丙酮溶解并快速搅拌冷却至5~10℃后,逐滴加入新制的琼斯试剂,使桦木醇与琼斯试剂的摩尔比为1∶6,20℃反应3 h,过滤除去墨绿色沉淀,减压蒸干丙酮,残液用乙酸乙酯萃取,水洗,10%碳酸氢钠(NaHCO3)洗涤,有机相用无水硫酸镁(MgSO4)干燥,所得淡黄色固体即为桦木酮酸粗品。桦木酮酸粗品用乙醚溶解,快速柱色谱分离,减压干燥,得桦木酮酸纯品。取桦木酮酸纯品用硼氢化钠/四氢呋喃(NaBH4/THF)还原,将所得固体溶于20 mL甲醇并煮沸15~20 min,冷却重结晶得BA。
1.2 试验动物与饲粮
选用体重18~22 g、5~6周龄的雄性昆明(KM)小鼠为试验动物。试验饲粮为小鼠专用饲料,由湖南斯莱克景达实验动物有限公司提供,其主要营养水平如下:粗蛋白质(CP)20.50%、粗脂肪(EE)4.62%、钙(Ca)1.23%、磷(P)0.91%、赖氨酸(Lys)1.30%、蛋氨酸+胱氨酸(Met+Cys)0.68%。
1.3 试验设计
将28只KM小鼠于温度为21~25℃、相对湿度为60%的饲养房中饲养1周后,随机分为4组,每组7只。1组为对照组,每天每只通过灌胃给予1%可溶性淀粉溶液0.2 mL;2、3、4组为试验组,每天每只通过灌胃给予含不同剂量BA的1%可溶性淀粉溶液(分别按每千克体重0.25、0.50、1.00 mg的剂量将BA混悬于1%可溶性淀粉溶液中)0.2 mL。通过预试验确定试验期为14 d。
1.4 样品采集
试验结束后,各组小鼠禁食(自由饮水)12 h,颈椎脱臼处死,解剖后取出脾脏和胸腺。将脾脏和胸腺用预冷生理盐水漂洗,滤纸吸干水分后称重,按组织与预冷生理盐水1∶10的质量体积比制成10%组织匀浆,3 000 r/min离心15 min,收集上清液待测。
1.5 测定指标与方法
测定脾脏和胸腺中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性,丙二醛(MDA)含量以及总抗氧化能力(T-AOC)。其中,SOD活性采用黄嘌呤氧化酶法测定;GSH-Px活性采用二硫代二硝基苯甲酸(DTNB)法测定;MDA含量采用硫代巴比妥酸显色法测定;T-AOC采用FRAP(化学比色法)法测定。采用考马斯亮蓝法测定脾脏和胸腺中总蛋白含量。总蛋白、MDA、SOD、GSH-Px与T-AOC测定试剂盒均购自南京建成生物工程研究所。
1.6 数据分析和处理
采用SPSS 16.0软件进行数据处理,结果以平均值±标准差表示。采用t检验分析组间差异显著性。
2 结果
2.1 BA对小鼠免疫器官中SOD活性的影响
由表1可知,各试验组脾脏和胸腺中SOD活性较对照组均有所升高,并随BA剂量的增加而升高,呈量效递增关系。与对照组相比,4组脾脏中SOD活性显著升高(P<0.05),同时胸腺中SOD活性极显著升高(P<0.01)。
2.2 BA对小鼠免疫器官中GSH-Px活性的影响
由表2可知,各试验组脾脏和胸腺中GSH-Px活性较对照组均有所升高,但不呈量效递增关系。与对照组相比,3和4组脾脏中GSH-Px活性均显著升高(P<0.05);3组胸腺中GSH-Px活性显著升高(P<0.05)。
2.3 BA对小鼠免疫器官中MDA含量的影响
由表3可知,各试验组脾脏和胸腺中MDA含量较对照组均有所降低,并随BA剂量的增加而降低,呈量效递减关系。与对照组相比,3组脾脏中MDA含量显著降低(P<0.05),4组脾脏中MDA含量极显著降低(P<0.01);2、3和4组胸腺中MDA含量均极显著降低(P<0.01)。
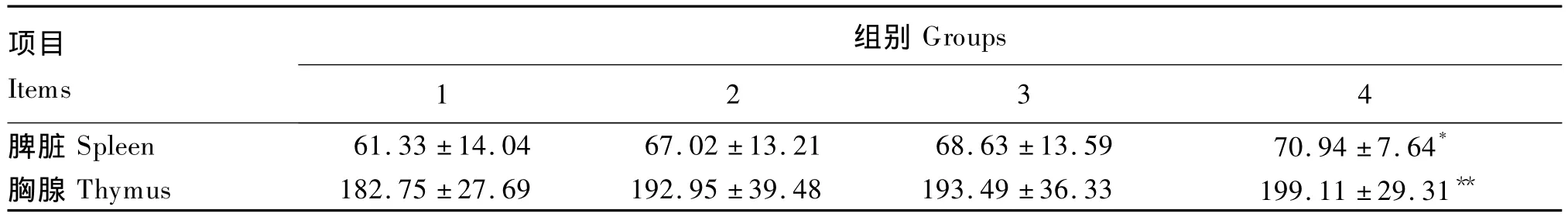
表1 BA对小鼠脾脏和胸腺中SOD活性的影响Table1 Effects of BA on SOD activity of spleen and thymus in mice(n=7) U/mg prot

表2 BA对小鼠脾脏和胸腺中GSH-Px活性的影响Table2 Effects of BA on GSH-Px activity of spleen and thymus in mice(n=7) U/mg prot

表3 BA对小鼠脾脏和胸腺中MDA含量的影响Table3 Effects of BA on MDA content of spleen and thymus in mice(n=7) nmol/mL
2.4 BA对小鼠免疫器官中T-AOC的影响
由表4可知,各试验组脾脏和胸腺中T-AOC较对照组均有所升高,并随BA剂量的增加而升高,呈量效递增关系。与对照组相比,3组脾脏中T-AOC显著升高(P<0.05),4组脾脏中T-AOC极显著升高(P<0.01),3和4组胸腺中T-AOC均极显著升高(P<0.01)。
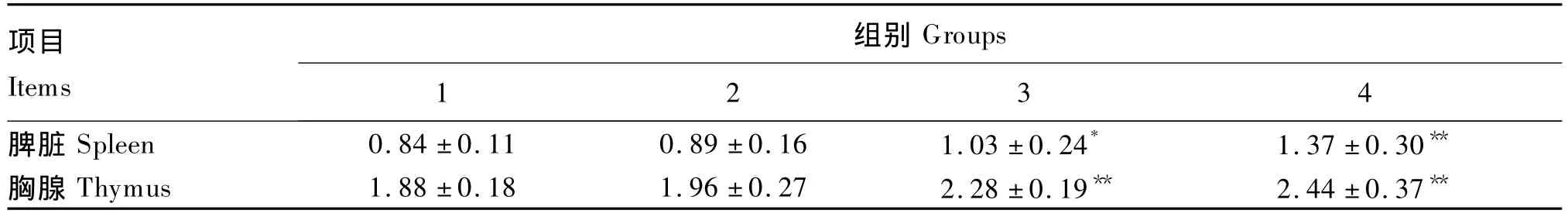
表4 BA对小鼠脾脏和胸腺中T-AOC的影响Table4 Effects of BA on T-AOC of spleen and thymus in mice(n=7) U/mg prot
3 讨论
SOD和GSH-Px是机体内广泛存在的、重要的催化过氧化氢(H2O2)分解的酶[8]。SOD是机体代谢的关键酶,可调节机体的氧化与抗氧化的平衡,其活性的高低反映了机体清除氧自由基能力的强弱,在机体抗氧化损伤、抗衰老与免疫调节过程中发挥着重要作用[8,12]。GSH-Px 是 H2O2防御系统成员,可以清除活细胞内过氧化物,在保护细胞免受自由基损伤的过程中起着关键作用[12]。据报道,BA能显著降低由甲醇或镉诱导的人中性白细胞中超氧阴离子数量[13],刺激巨噬细胞吞噬能力增强,提高巨噬细胞中肿瘤坏死因子-α(TNF-α)水平以及 SOD、GSH-Px 活性[8],增强淋巴细胞活性和改变T、B淋巴细胞数目或亚群,增加绵羊红细胞(SRBC)免疫小鼠溶血空斑数[9],混合调控Th1/Th2类细胞因子[10],说明BA具有细胞免疫、体液免疫和非特异性免疫的功能。本试验显示,BA可提高小鼠脾脏和胸腺中SOD和GSH-Px活性,表明BA可通过增强SOD和GSHPx活性来保护小鼠免疫器官免受自由基的损伤,从而提高免疫器官的抗氧化能力。
MDA是不饱和脂肪酸过氧化产物之一,其产量的高低可反映过氧化程度的强弱。生物膜中的不饱和脂肪酸易被自由基攻击而发生过氧化,导致结构和功能发生变化,这些变化势必影响细胞基本的生命活动,最终导致淋巴细胞功能低下[12]。本试验中,BA可降低小鼠胸腺和脾脏中MDA含量,表明BA可以通过调节脂质过氧化程度而影响小鼠免疫器官的抗氧化能力。
T-AOC代表体内酶类和非酶类抗氧化物质的总和,是反映机体抗氧化能力的重要指标,其强弱与健康状况和疾病状态之间存在着密切的联系,当其降低时,会引起炎性反应、肿瘤和免疫系统疾病等[14]。本试验发现,BA能提高小鼠脾脏和胸腺中T-AOC,并随BA剂量的增加而升高,呈量效递增关系。这说明BA可增加小鼠免疫器官中酶类或非酶类抗氧化物质的合成,进而增强免疫器官的抗氧化能力。
4 结论
BA可提高小鼠脾脏和胸腺中SOD、GSH-Px活性以及T-AOC,降低脾脏和胸腺中MDA含量,进而增强免疫器官的抗氧化能力。
[1]PISHA E,CHAI H,LEE I S,et al.Discovery of betulinic acid as a selective inhibitor of human melanoma that functions by induction of apoptosis[J].Nature Medicine,1995,1(10):1046-1051.
[2]ROBERT H C,SAMIR A K.Chemistry,biological activity,and chemotherapeutic potential of betulinic acid for the prevention and treatment of cancer and HIV infection[J].Medicinal Research Reviews,2004,24(1):90-114.
[3]叶银英,何道伟,叶文才,等.2,3-二羟基桦木酸体外和体内抗黑色素瘤作用的研究[J].中国肿瘤临床与康复,2001,22(4):163-166.
[4]李清,王晓宇,李杨,等.人参皂甙Rh2提高人源肝癌细胞HepG2对桦木酸敏感性的作用机制[J].中国生物制品学杂志,2011,24(5):531-533.
[5]YOON J J,LEE Y J,KIM J S,et al.Betulinic acid inhibits high glucose-induced vascular smooth muscle cells proliferation and migration[J].Journal of Cellular Biochemistry,2010,111(6):1501-1511.
[6]YOON J J,LEE Y J,KIM J S,et al.Protective role of betulinic acid on TNF-alpha-induced cell adhesion molecules in vascular endothelial cells[J].Biochemical and Biophysical Research Communications,2010,391(1):96-101.
[7]SZUSTER-CIESIELSKA A,PLEWKA K,DANILUK J,et al.Betulin and betulinic acid attenuate ethanol-induced liver stellate cell activation by inhibiting reactive oxygen species(ROS),cytokine(TNF-α,TGF-β)production and by influencing intracellular signaling[J].Toxicology,2011,280(3):152-163.
[8]易金娥,OBMINSKA-MRUKOWICZ B,杜金艳,等.桦木酸对巨噬细胞免疫功能和抗氧化作用的研究[J].营养学报,2010,32(3):281-285.
[9]YI J E,OBMINSKA-MRUKOWICZ B,YUAN L Y,et al.Immunomodulatory effects of betulinic acid from the bark of white birch on mice[J].Journal of Veterinary Science,2010,11(4):305-313.
[10]易金娥,袁莉芸,文利新,等.桦木酸对小鼠淋巴细胞及巨噬细胞的影响分析[J].畜牧兽医学报,2011,42(1):124-130.
[11]易金娥,文利新,袁莉芸,等.白桦树中桦木醇的提取与桦木酸合成研究[J].湖南农业大学学报,2010,36(5):574-580.
[12]帅学宏,胡庭俊,陈炅然,等.鬼臼多糖对小鼠免疫功能和抗氧化能力的影响[J].畜牧兽医学报,2008,39(7):1000-1004.
[13]AGNIESZKASC,MARTYNA K S.Protective effects of betulin and betulinic acid against ethanol-induced cytotoxicity in HepG2 cells[J].Pharmacological Reports,2005,57(5):588-595.
[14]俸家富,赵平武,王东.血液中总抗氧化态与疾病的关系[J].国际检验医学杂志,2009,30(6):571-573.
