黄瓜雌性性状的QTL定位分析
2012-09-20厉建梅秦智伟周秀艳
厉建梅,辛 明,秦智伟,武 涛,周秀艳
(东北农业大学园艺学院,哈尔滨 150030)
黄瓜(Cucumis sativus L.)在自然群体中存在纯雌株、强雌株、纯雄株(或强雄株)、雌雄同株、纯全株、雌全雄同株、全同株、雌雄全同株等8种不同的性型[1-2],其性别类型复杂多样,被认为是研究植物性别决定的经典模式植物。黄瓜全雌性是保护地黄瓜品种选育中重要的目标性状,而且利用全雌性品系配制一代杂种无需人工去雄,可极大地简化杂交种的生产程序。有关黄瓜雌性性状分子标记已有相关报道,时秋香等获得与黄瓜性别决定基因M紧密连锁的三个共显性标记:SSR19914、SSR23487、SCAR123,其中 SSR19914与SCAR123位于M基因同侧,与M基因遗传距离分别为3.2和0.94 cM,SSR23487位于M基因另一侧,与M基因遗传距离为0.28 cM,从而最终将M基因定位于1.22 cM的遗传区间内[3]。苗晗等利用F9代RILs群体进行复雌花QTL定位分析[4]。共检测到8个控制复雌花性状的QTL,分布在第1、2、3、6、7染色体上。位于第3染色体的Mp3.2贡献率最大;位于第6染色体的Mp6.2在春秋两季位置都很稳定。获得紧密连锁(<10 cM)的特异标记(SSR04635、 SSR13466、 SSR00584、 SSR10449)4个。
本试验参照已构建的黄瓜高密度遗传图谱[5],试图找到更多与黄瓜雌性性状紧密连锁的分子标记,以期为开展黄瓜雌性性状研究和分子辅助选择育种提供技术支持,为黄瓜雌性系和新品种选育提供理论依据。
1 材料与方法
1.1 供试材料
试验材料均由东北农业大学园艺学院黄瓜课题组提供,包括有雌性系P1(D0420)、强雄株系P2(D06103)、组合“D0420×D06103”及组合“D0420×D06103”构建的 F2、B1、B2群体,所得的6 个参试世代为 P1、P2、F1、F2、B1、B2。
1.2 试验方法
试验在东北农业大学香坊实验实习基地温室内进行。亲本材料于2009年3月1日播种育苗,4月15日定植于日光温室,两行区,株行距35 cm×60 cm,每区定植36株,常规管理。
2009年7月初采收的F1组合种子热处理后,于7月15日播种育苗。8月15日定植,每区定植36株。将其F1组合D0420×D06103自交获得F2代,并将F1世代分别与两个亲本回交,获得(D0420×D06103)×D0420和(D0420×D06103)×D06103两个回交世代。2010年3月2日春播种6个世代,4月18日定植。
1.3 性型调查
性型调查样本容量:每个亲本15株,F1组合45株,F2202株、B174株、B279株。
黄瓜花性型调查方法:当植株长到10节以上时,统计10节以下每节所开花的性型,当植株长到20节以上时,统计10~20节每节所开花的性型,植株长到30节以上时,统计20节以上每节所开花的性型。雌花节率:结果盛期,主蔓上着生雌花的节位数占总节位数的百分率[6]。雌花节率(%)=主茎25节内雌花节数+雌雄混合节数/25节×100%。
1.4 DNA提取及近等基因池的构建
黄瓜叶片总DNA提取采用CTAB法[7],略有改动,提取的DNA在含有0.5 μg·mL-1EB的1%琼脂糖凝胶中电泳30 min,UVP凝胶成像系统进行拍照记录;从F2分离群体中选取雌花节率处于两个极端的各10个单株的DNA,将同类型单株的DNA进行混合,构建全雌、强雄基因池用于筛选在亲本中有多态性的标记。
1.5 PCR反应及其电泳检测
SSR 反应体系为 20 μL,其中含有 11.3 μL ddH2O,2.0 μL 10 ng·μL-1的模板,0.25 μL 10 pmol·μL-1的引物,2.0 μL 2.5 mmol·L-1的 MgCl2,2.0 μL 10×buffer,2.0 μL 2 mmol·L-1dNTP, 0.2 μL 2.5 U·μL-1Taq DNA聚合酶。PCR扩增反应程序:94℃预变性6 min;94℃变性30 s;56℃(因引物而异)退火1 min;72℃延伸1 min;35个循环;72℃延伸10 min;4℃保存。扩增产物利用6%变性聚丙烯酰胺凝胶进行电泳、银染和记录带型。
1.6 连锁分析
分子标记的记录采用常规的Mapmaker软件记录方法—ABH法。父本型D06103的纯合带型记为A,母本型D0420的纯合带型记为B,两亲本的杂合带型记为H,数据缺失或模糊不清的记为“-”,用卡方检验法对统计得到的F2群体中SSR带型分布结果进行分析。使用Mapmaker/EXP V3.0b遗传连锁分析软件构建连锁群,使用MapChart作图软件生成连锁图。
1.7 QTL定位
使用Windows QTL Cartographer V2.5遗传位点构图软件进行QTL定位。将“.map”和“.raw”文件导入软件,生成“.mcd”格式文件。对“.mcd”文件数据采用复合区间作图法进行QTL扫描定位,以似然比LR(Likehood ratio)大于11.5,即LOD值大于2.5作为QTL存在的阈值。
2 结果与分析
2.1 黄瓜雌性性状遗传分析
雌性系 P1(D0420)和强雄性系 P2(D06103)杂交、自交及回交6个世代的雌花节率调查结果列入表1。P1、P2雌花节率的次数分布具有明显差异,F1代平均值为80.6%,趋向于雌性系亲本P1,即大部分表现强雌株,全雌性对强雄性表现为不完全显性特征,B1代呈单峰分布,B2及F2代呈双峰连续分布,且B2及F2代变异范围较大,表明控制全雌性状有主效基因,还存在着微效基因的影响;雌花节率频次分布如图1所示,偏度=│-0.97│<1,而峰度Kurtosis=0.72,表现出偏向两侧,呈现偏态分布。

表1 黄瓜组合(D0420×D06103)6世代雌花节率的次数分布Table1 Frequency distribution of female flowers proportion in six generations of combination D0420×D06103
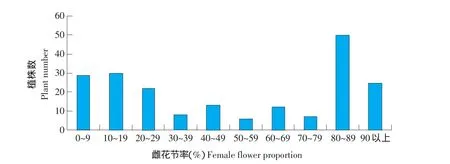
图1 D0420×D06103组合的F2群体雌花节率次数分布Fig.1 Frequency distribution of female flowers proportion of F2isolated population of combination D0420×D06103
2.2 多态性引物的筛选
本研究选用214对SSR引物,通过父本D06103和母本D0420组合的筛选,两亲本间具多态性的引物为51对,多态率为23.83%,进一步利用这51对引物对全雌和强雄2个基因池筛选,得到21个多态性引物标记,6%变性聚丙烯酰胺凝胶筛选结果见图2。
2.3 黄瓜遗传连锁图谱的构建
SSR为共显性标记,根据孟德尔遗传规律,每个多态性标记在F2群体中的分布均应符合1∶2∶1的理论值,基因频率均应符合1∶1的期望比。对获得的21个多态性位点在F2群体的分离数据进行X2适合性检测,由卡方检验结果可知,3个标记带型分布出现了偏分离(CSWCT13Balt、CSWCT17、SSR23265、SSR29622),比率为14.29%。对获得的21个多态性标记位点进行连锁分析,构建遗传连锁图,其中20个标记位点进入4个连锁群(LOD≥2.5),1个位点(CSWCT11)未定位到连锁群上,连锁群总长度为98.5 cM,标记间平均距离4.9 cM,最短的连锁群0.5 cM(LG1),最长的连锁群53.4 cM(LG2);标记间最小距离0.2 cM,最大距离25.2 cM,标记总体在整个连锁群中分布比较均匀,没有标记聚集在一起的现象。用MapChart软件生成连锁群如图3所示。

图2 引物SSR11633在F2群体中SSR扩增产生的带型Fig.2 SSR amplification results generated by prmier SSR11633 in the F2population

图3 使用D0420×D06103的F2群体构建的遗传连锁群Fig.3 Linkage group based on the F2population from the cross D0420×D06103
2.4 黄瓜雌性性状的QTL定位
用Windows QTL Cartographer V2.5软件以复合区间作图法进行QTL分析,在连锁群LG3共检测出2个与黄瓜性状相关的QTL(QTL1,QTL2):SSR00134-QTL1-SSR18956、SSR15482-QTL2-SSR21936(见表2)。QTL1距离标记SSR00134较近,为2.1 cM,LOD值为50.04,可解释15.36%的表型变异;QTL2距离标记SSR21936较近,为1.4 cM,LOD值为6.48,可解释5.69%的表型变异。QTL位点加性效应值分别为0.38和0.12,对提高黄瓜雌性性状来说表现为增效加性效应。QTL在目标连锁群上的位置如图4所示。

表2 黄瓜雌性性状QTL分析Table2 QTL analysis of gynoecious in cucumber
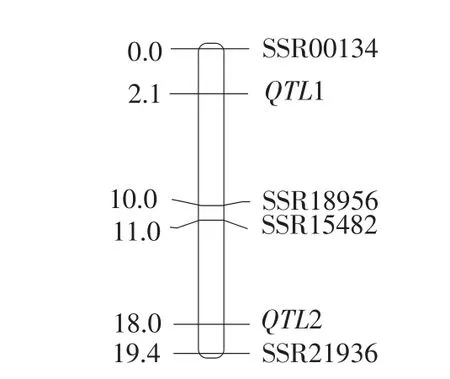
图4 黄瓜雌性QTL定位Fig.4 QTL localization of gynoecious of cucumber
3 讨论

偏分离是指遗传标记的观察频率偏离预期频率的现象,对单个位点遗传标记的试验数据进行经典的X2检测可以发现,偏分离是遗传标记的一种普遍现象[9],并被认为是生物进化的动力之一。本试验的F2群体的表型观察也偏向于双亲,可能是在构建群体时,定植的过程中虽然是每一号植株随机拿取一株,但也可能存在一定的误差。偏分离机制是非常复杂的,目前主要归纳为以下几点:①遗传搭车效应,与配子体选择基因相连锁的标记位点可能产生偏分离;②在分子标记连锁图上存在偏分离的热点区域(Segregation distortion region,SDR),在这些区域可能有与偏分离相关的特定基因;③染色体片段的重组和倒位,造成减数分裂时期染色体不配对或亲和力降低,减少重组率,使连锁分离产生偏离;④环境因素、非同源重组、基因转换、转座因子等可能引起标记位点的偏分离;⑤标记位点数据缺失导致的偏分离;⑥作图群体亲本某些位点的杂合;⑦群体构建过程中的人为选择也会造成部分偏差等[10-11]。本研究的F2群体的偏分离究竟是受哪些原因的影响,有待于进一步深入研究。
SSR技术被认为是构建真核生物高度饱和遗传图谱的标准分子标记[12]。本研究检测得到与黄瓜雌性性状相关的QTL位点2个:SSR00134-QTL1-SSR18956、SSR15482-QTL2-SSR21936,距离最近的标记分别为2.1和1.4 cM,具有一定的代表性。试验检测到的QTL位点距离两侧标记的距离较大,还应继续开发、加大引物密度,同时此QTL位点的贡献率为15.36%和5.69%,说明此位点对黄瓜雌性代表性一般,应进一步筛选引物,找到与目标性状紧密连锁的标记。此外,本试验采用F2分离群体、214对引物进行QTL定位,虽然检测到了QTL位点,但检测到的QTL是否是“一致性QTL”尚不能确定,本试验只进行了一个季节的QTL定位,由于F2群体是暂时性群体,难以用其进行重复性研究,将来的试验过程中可以采用永久性群体(如重组自交系RIL)进行检验。
黄瓜雌性性状与产量密切相关,但是由于黄瓜的开花结果期持续时间长,传统方法对雌性状进行表型选择极为耗时。而通过分子标记辅助育种,利用与性状紧密连锁的分子标记,在复杂的环境影响中进行辅助育种是改良作物复杂性状的有效手段[13-14]。在植株生长早期进行选择,则能大大缩短育种周期,提高育种效率。在黄瓜中,Fazio等已证明对于侧枝、瓜长径比和雌花率的分子标记辅助选择是有效的(侧枝:每轮选择大约0.3个;长径比:每轮选择大约增加0.1个单位;雌花比率:每轮选择增加5.6%~9.8%)[13,15]。选择其中稳定且高贡献率的位点进行进一步的MAS试验将是一项非常有效的工作。本研究中QTL定位结果为进行分子标记辅助选择,实现雌花优良等位基因的快速转移奠定基础。
4 结论
本研究以黄瓜雌性系D0420×强雄性系D06103的211株F2单株为作图群体,应用SSR分子标记技术,得到与黄瓜雌性性状相关的标记位点21个,分属4个连锁群,连锁群全长为98.5 cM,标记间平均距离4.9 cM,最短的连锁群0.5 cM(LG1),最长的连锁群53.4 cM(LG2);标记间最小的遗传距离0.2 cM,最大的遗传距离25.2 cM;采用复合区间定位分析,检测到与黄瓜雌性性状相关的QTL位点2个,均位于第3连锁群上,距离最近标记的遗传距离分别为2.1和1.4 cM,LOD值分别为50.04和6.48,贡献率分别为15.36%和5.69%。
[1]梁永宏,李广林,郭韬,等.黄瓜性型分化的分子机制[J].生命科学,2010,22(11):1177-1183.
[2]谭其猛.蔬菜育种[M].北京:农业出版社,1980.
[3]时秋香,刘世强,李征,等.与黄瓜M基因连锁的三个共显性标记[J].园艺学报,2009,36(5):737-742.
[4]苗晗,顾兴芳,张圣平,等.黄瓜复雌花性状QTL定位分析[J].园艺学报,2010,37(9):1449-1455.
[5]Ren Y,Zhang Z,Liu J,et al.An integrated genetic and cytogenetic map of the cucumber genome[J].PloS One,2009,4(6):5795.
[6]李锡香,朱德蔚.黄瓜种质资源描述规范和数据标准[M].北京:中国农业出版社,2005:20-21.
[7]王关林,方宏筠.植物基因工程[M].2版.北京:科学出版社,2002:743-744.
[8]邹晓艳.黄瓜性型遗传规律及性别决定相关基因的分布和表达研究[D].北京:中国农业科学院,2007:1-55.
[9]谭军.水稻F2群体SSRs连锁分析及分子标记作图模型研究[D].杭州:浙江大学,2001.
[10]姜树坤,钟鸣,徐正进,等.水稻相关序列扩增多态性反应体系的建立及其多态性位点在F2群体中的分离分析[J].中国水稻科学,2007,21(5):464-468.
[11]严建兵,汤华,黄益勤,等.玉米F2群体分子标记偏分离的遗传分析[J].遗传学报,2003,30(10):913-918.
[12]辛明,秦智伟,周秀艳.黄瓜植株高度遗传分析及其分子标记[J].东北农业大学学报,2008,39(5):34-38.
[13]Fan Z C,Robbins M D,Staub J E.Population development by phenotypic selection with subsequent marker-assisted selection for line extraction in cucumber(Cucumis sativus L.)[J].Theoretical and Applied Genetics,2006,112(5):843-855.
[14]Zhu B G,Sun Y R.Inheritance of the four-seeded-pod trait in a soybean mutant and marker-assisted selection for this trait[J].Plant Breeding,2006,125(4):405-407.
[15]Faz Z C,Chung S M,Staub J E.Comparative analysis of response to phenotypic and marker-assisted selection for multiple lateral branching in cucumber(Cucumis sativus L.)[J].Tag Theoretical and Applied Genetics,2003,107(5):875-883.
