黑穗醋栗多糖抗氧化及抑制非酶糖基化活性的研究
2012-09-20于泽源任中杰徐雅琴李兴国
于泽源,任中杰,徐雅琴,李兴国
(1.东北农业大学园艺学院,哈尔滨 150030;2.东北农业大学理学院,哈尔滨 150030)
黑穗醋栗(Ribes nigrum L.)又称黑豆果、黑加仑,系虎耳草科茶藨子属一种多年生小灌木,其果实营养丰富,富含多糖、有机酸、维生素、黄酮、矿物质、氨基酸、脂肪酸等营养成分[1-2]。多糖是指由10个或10个以上单糖聚合而成的一类生物大分子。研究发现多糖不仅具有抗癌、抗炎、抗病毒、抗衰老等多方面药理活性,加之多糖本身低毒、来源广泛,已成为近年来的研究热点。黑穗醋栗多糖具有一定抗氧化作用,可改善血液循环、降血压、阻遏血栓形成、延缓衰老、保护视力和神经系统,能很好地预防心脏病和癌症等多种疾病[3]。国内对黑穗醋栗抗氧化活性方面的报道较少。在非酶促条件下,蛋白质游离氨基与还原糖的羰基经过一系列反应可以产生稳定的糖基化终产物AGEs(Advanced glycosylation end products)。非酶糖基化及AGEs与衰老过程中发生的多种组织器官衰退,以及多种老年疾病的发生有密切联系,对人体造成严重危害[4-5]。研究表明,玄参、丹参、番泻叶、柴胡、麻黄等中药类多糖对非酶糖基化有不同程度的抑制作用[6-7]。石榴、仙人掌、黄精多糖等多糖类物质对蛋白质非酶糖基化过程也有一定的抑制作用[8-10]。但至今尚未有关于黑穗醋栗多糖抑制非酶糖基化的报道。
本文研究黑穗醋栗多糖的抗氧化性以及非酶糖基化反应中Amodori产物形成阶段、二羰基化合物形成阶段和终产物AGEs形成阶段的抑制作用,旨在为合理利用黑穗醋栗植物资源,进一步开发黑穗醋栗保健效用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 样品与主要试剂
黑穗醋栗(黑丰)采于东北农业大学园艺实验站;牛血清蛋白(购自华美生物工程公司);1,1-二苯基苦基苯肼(DPPH)(购自Sigma公司);NBT(氯化硝基四氮唑兰)及其他试剂均为分析纯。
1.1.2 仪器
T6新悦-可见分光光度计(北京普析通用仪器有限责任公司),TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司),JY92-2D超声波细胞粉碎机(宁波新芒生物科技),隔水式电热恒温培养箱(上海市跃进医疗器械一厂),荧光/磷光发光光度计LS45(美国PerkinElmer)。
1.2 方法
1.2.1 黑穗醋栗粗多糖的提取
称100 g黑穗醋栗果实,按液料比1∶20加入去离子水,在功率400 W下超声法提取25 min,得到多糖提取液进行离心,抽虑,浓缩;用80%乙醇沉淀,沉淀真空干燥,得固体黑穗醋栗多糖,样品呈灰白色。
1.2.2 抗氧化活性研究方法
1.2.2.1 羟基自由基(·OH)清除
参照Fenton反应建立反应体系[11],在5个试管中分别加入2 mL浓度为0.20、0.40、0.60、0.80和1.00 mg·mL-1的多糖提取液,8 mmol·L-1FeSO42 mL,8 mmol·L-1水杨酸-乙醇2 mL,加8.8 mmol·L-1H2O22 mL启动反应,37℃反应30 min,在510 nm下测定各浓度的吸光度A1。以2 mL蒸馏水代替2 mL H2O2溶液作空白调零,以2mL蒸馏水代替多糖溶液测定吸光值A0。以VC作阳性对照,计算清除率。

1.2.2.2 超氧阴离子自由基(O2-·)清除
采用邻苯三酚自氧化法[12],略有改动。取pH 8.2的50 mmol·L-1Tris-HCl缓冲溶液5 mL,加4.7 mL H2O,混匀后25℃水浴保温30 min。然后加入3 mmol·L-1的25℃预热的邻苯三酚0.3 mL,迅速混匀后于320 nm处每隔30 s记录一次吸光度(A0),持续5 min,计算每分钟吸光度的增加值(V0)。配置不同浓度的黑穗醋栗多糖溶液(0.2、0.4、0.6、0.8、1.0 mg·mL-1),各取2 mL于试管中,试验方法同上。计算每分钟吸光度的增加值(Vt)。以VC作阳性对照,按照公式计算清除率。

1.2.2.3 DPPH自由基清除试验[13]
取不同浓度黑穗醋栗多糖溶液(0.2、0.4、0.6、0.8、1.0 mg·mL-1)各2 mL于试管中,加入0.3 mmol·L-1DPPH 2 mL,避光反应30 min,于517 nm波长处测定吸光度(Ai);再取上述多糖液2 mL,加入2 mL无水乙醇,反应30 min测吸光度(Aj);取2 mL DPPH,加入2 mL无水乙醇,反应30 min测吸光度(A0)。以VC做阳性对照,按照下式计算清除率。

1.2.3 糖基化活性研究[14]
1.2.3.1 体外非酶糖基化体系的建立
在无菌条件下,向无菌细胞培养瓶中加入用0.2 μm除菌膜除菌后的20.00 g·L-1牛血清白蛋白溶液和0.50 mol·L-1葡萄糖溶液各5 mL,加入含1%叠氮钠的0.20 mol·L-1pH 7.4的磷酸盐缓冲液10.00 mL,建立完整糖基化体系对照组a,同时设立不加多糖溶液和不加葡萄糖溶液的对照组b;加多糖溶液不含蛋白的对照组c;加多糖溶液不加葡萄糖溶液的对照组d。设置溶液中多糖终浓度分别为 0.05、0.1、0.15、0.20 mg·mL-1的干预组,在37℃恒温培养箱内培养14 d。分别于第0、2、4、6、8、10、12、14天取样进行试验。
1.2.3.2 NBT还原试验
取0.5 mL糖基化物质和0.3 mmol·L-1NBT 2.0 mL在100 mmol·L-1pH 10.35碳酸钠缓冲溶液2.5 mL,于室温孵化20 min,530 nm处测定吸光度。用碳酸钠缓冲溶液代替糖基化物质作空白,计算抑制率(IR)。

1.2.3.3 二羰基化合物含量测定
取糖基化体系溶液0.4 mL与0.2 mL 500 mmol·L-1吉拉德-T储备液和3.4 mL pH 2.9甲酸钠溶液在室温下孵化1 h,294 nm处测定吸光度,以甲酸钠溶液代替糖基化物质为空白。以乙二醛标准曲线计算二羰基化合物含量,计算抑制率(IR)。
1.2.3.4 糖基化终产物荧光强度的测定
取出0.5 mL培养液,稀释至10 mL,测定糖基化终产物在激发波长370 nm,发射波长440 nm处的荧光值F,计算对非酶糖基化的抑制率(IR)。

1.2.4 数据处理分析
所有试验数据均以3次结果的平均数±标准误(mean±SD)表示。并用SPSS 10.0软件进行差异显著性分析,P<0.05为差异显著。
2 结果与分析
2.1 多糖对羟自由基的清除能力
由图1可知,多糖和VC对羟自由基清除能力都随浓度增加而逐渐增强,VC对羟自由基清除率高于多糖。黑穗醋栗多糖与VC的各浓度之间的清除率差异显著(P<0.05,n=5),黑穗醋栗多糖IC50=0.976 mg·mL-1,VC 的 IC50=0.501 mg·mL-1。

图1 对羟自由基的清除能力Fig.1 Scavenging ability of hydroxyl radicals
2.2 多糖对超氧阴离子(O2-·)自由基清除能力
由图2可知,黑穗醋栗多糖对O2-·自由基清除率随浓度增加而上升,当浓度为1.0 mg·mL-1时,清除率是71.85%。VC的浓度为0.2 mg·mL-1时,清除率已高达89.69%,随浓度增加清除率变化不大,逐渐趋于平衡。黑穗醋栗多糖的IC50=0.3931 mg·mL-1,VC的IC50=0.111 mg·mL-1。黑穗醋栗多糖对O2-·自由基清除能力虽略低于VC,但仍表现出较强的抗氧化能力,且各浓度间的清除率差异显著(P<0.05,n=5)。
2.3 黑穗醋栗多糖对DPPH自由基清除能力
由图3可知,黑穗醋栗多糖浓度在0.2~0.6 mg·mL-1时对DPPH自由基的清除能力逐渐增强但低于VC,当浓度为0.8 mg·mL-1时清除率39.31%略高于VC的抑制率36.87%,当浓度为1.0 mg·mL-1时,清除率分别为46.20%和44.47%,可见黑穗醋栗多糖对DPPH自由基的清除能力与VC相近。黑穗醋栗多糖与VC的各浓度之间的清除率差异显著(P<0.05,n=5)。

图2 对O2-·的清除能力Fig.2 Scavenging ability of superoxide anion radicals

图3 对DPPH自由基清除能力Fig.3 Scavenging ability of DPPH radicals
2.4 黑穗醋栗多糖的抗非酶糖基化活性
2.4.1 对Amadori产物生成的影响
在糖基化反应初期,葡萄糖的羰基可以与蛋白质、核酸、氨基酸等大分子物质的游离氨基发生作用生成西弗碱,西弗碱经过化学重排,形成较稳定的酮胺化合物,又称Amadori产物。由图4和表1可知,在0~8 d内,不同浓度多糖在糖基化体系中,对Amadori产物的产生都有一定抑制作用,且随着多糖浓度增加抑制作用逐渐增加。8~14 d内变化逐渐趋于平衡。浓度为0.2 mg·mL-1时,抑制率达34.78%,浓度为0.2 mg·mL-1时与0.15 mg·mL-1之间的清除率具有显著差异(P<0.05)。

图4 对Amadori产物生成的抑制作用Fig.4 Inhibitory effects of Amadori product
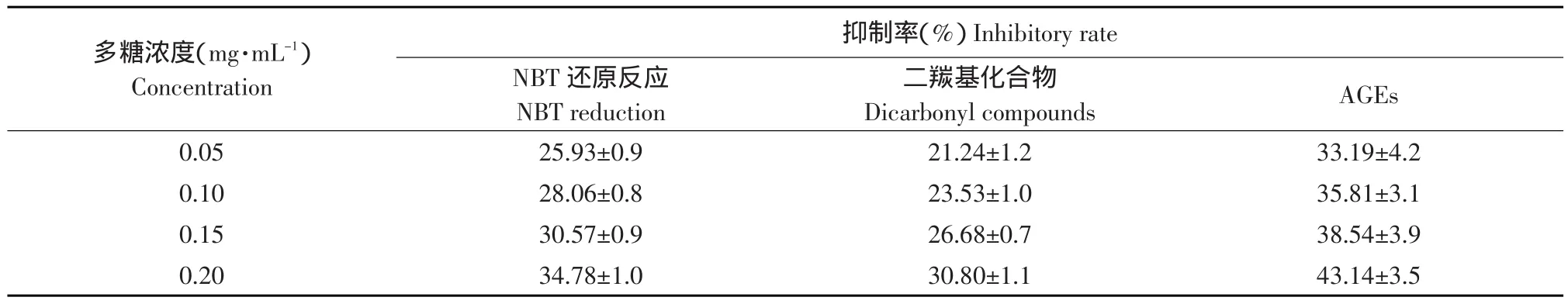
表1 多糖对葡萄糖/BSA体系Amadori产物、二羰基化合物及GAEs形成的抑制作用Table1 Inhibitory effects of polysaccharides on the formation of amadori product,dicarbonyl compounds and GAEs in glucose/BSA system
2.4.2 二羰基化合物含量测定
由图5和表1可知,在0~10 d内二羰基化合物含量增加趋势显著,在10~14 d二羰基化合物含量逐渐趋于平衡,各浓度多糖对二羰基化合物都有一定的干预作用,随着浓度升高,抑制率升高,呈现剂量效应依赖关系。多糖浓度为2.0 mg·mL-1时抑制二羰基化合物的能力最大,抑制率达30.80%。
2.4.3 非酶糖基化终产物荧光强度测定
蛋白质糖基化终产物在最大激发波长370 nm,最大发射波长440 nm处有荧光吸收。通过测定反应后的荧光强度可以衡量蛋白质非酶糖基化的程度,从而反映样品抑制作用的强弱。由图6和表1可知,在0~4 d黑穗醋栗多糖的糖基化体系中AGEs荧光强度增加缓慢;6~14 d荧光强度有明显增长,在浓度为0.2 mg·mL-1时,抑制率达43.14%(P<0.05,n=4)。

图5 对二羰基化合物产生的抑制作用Fig.5 Inhibitory effects of dicarbonyl compounds

图6 非酶糖基化终产物荧光强度Fig.6 Fluorescence intensity of AGEs
3 讨论与结论
自由基是人体氧化过程中的副产物[15]。自由基清除剂可直接清除体内过剩自由基,能够有效地防止或减轻体内自由基所导致的氧化损伤,增强机体免疫力,延缓衰老[16]。近20年来,由于生物学、化学等学科飞速发展,对多糖及其化合物活性作用认识加深,已有大量研究表明,一大部分从天然产物中分离得到的多糖类化合物具有清除自由基、抑制脂质过氧化作用。现已提取的水果中多种多糖均有较强的体外抗氧化功能,如李雪花等研究表明,荔枝粗多糖有清除活性氧自由基的作用[17];孟繁磊和陈瑞战等研究发现五味子多糖对O-2·和·OH具有一定的抗氧化能力[18]。
黑穗醋栗多糖在抗氧化试验中,对不同自由基表现出不同的清除作用,黑穗醋栗多糖与VC相比,清除DPPH·的效果最好,当黑穗醋栗多糖浓度为1.0 mg·mL-1时,清除率46.20%高于相同浓度下VC的清除率44.48%;而对羟自由基和超氧自由基清除率虽低于VC,但仍表现出较好的清除能力,IC50分别为0.9760和0.3931 mg·mL-1。说明黑穗醋栗多糖在体外对活性氧自由基有清除作用,从而能够清除体内产生的过多自由基,阻断体内自由基反应链的作用。不是所有碳水化合物都具有抗氧化活性。多糖抗氧化活性与多糖的结构、分子质量及单糖种类和连接方式有关[19]。
新疆医科大学王晓燕等对黑加仑多糖进行抗氧化性研究,初步证明黑加仑多糖具有一定还原能力,并具有较强的羟自由基清除活力[20]。而本试验黑穗醋栗多糖清除DPPH·的效果却最好,导致结论差异的原因可能是由于果实品种不同,因此在下一步试验中将探讨黑穗醋栗多糖结构和活性的关系。
蛋白质非酶糖基化是指蛋白质中氨基酸的N末端氨基或侧链氨基与还原糖的醛基缩合,产生可逆的Shiff氏碱中间体,进而形成稳定且可逆的糖-蛋白复合物,即Amadori产物。Amadori产物或Amadori产物降解的各种高度活性的羰基化合物,再与其他游离氨基基团反应,并经过一系列的化学重排和脱水反应,生成不可逆的深度糖基化终产物AGEs。AGEs不仅可以通过促进蛋白质发生直接的化学交联作用而影响组织的结构和功能,还可通过氧化应激造成组织损伤,其在体内长期累积,可引发一系列病理变化,最终导致动脉硬化、衰老、糖尿病慢性并发症及老年痴呆等疾病的发生发展。目前有很多药物通过对非酶糖基化反应的抑制发挥对糖尿病并发症的治疗作用。
黑穗醋栗多糖对非酶糖基化反应中Amadori产物形成阶段,二羰基化合物形成阶段,AGEs形成过程均有抑制作用,且随多糖浓度增加而增强。试验证明,黑穗醋栗多糖在Amadori产物形成阶段作用明显,在浓度为0.2 mg·mL-1时,抑制率为34.78%。糖基化中期,Amadori产物通过氧化、水解反应降解成乙二醛、甲基乙二醛和脱氧葡萄糖醛酮等二羰基化合物。这些化合物比葡萄糖更容易与游离氨基发生反应,形成糖基化终产物[12]。在浓度为0.2 mg·mL-1时,两个阶段的抑制率分别为30.80%和43.14%。黑穗醋栗多糖在第三阶段对AGEs的形成表现出较强的抑制作用,黑穗醋栗对糖基化过程的抑制作用从而确定。
[1]张海慧,徐雅琴,李兴国.微波辅助法提取黑穗醋栗中黄酮类物质的研究[J].东北农业大学学报,2008,39(9):32-35.
[2]霍俊伟,李著花,秦栋.黑穗醋栗营养成分和保健功能及产业发展前景[J].东北农业大学学报,2011,42(2):139-144.
[3]Takata R,Yamamoto R,Yanai K,et al.Immunostimulatory effects of a polysaccharide-rich substance with antitumor activity isolated from black currant(Ribes nigrum L.)[J].Bioscience Biotechnology and Biochemitry,2005,69(11):2042-2050.
[4]Wirasathiena L,Pengsuparpa T,Suttisria R,et al.Inhibitors of aldose reductase and advanced glycation end-products formation from the leaves of Stelechocarpus cauliflorus[J].Phytomedicine,2007,14:546-550.
[5]Nessar A.Advanced glycation endproducts-role in pathology of diabetic complications[J].Diabetes Research and Clinical Practice,2005,67:18-21.
[6]黄达明,张志才,连宾,等.22种中药醇提物抑制蛋白质非酶糖基化作用的研究[J].食品科学,2007,28(5):41-44.
[7]Wang X,Zhang L S,Dong L L.Inhibitory effect of polysaccharides from pumpkin on advanced glycation end-products formation and aldose reductase activity[J].Food Chemistry,2012,130:821-825.
[8]Rout S,Banerjee R.Free radical scavenging'anti-glycation and tyrosinase inhibition properties of a polysaccharide fraction isolated from the rind from Punica granatum[J].Bioresource Technology,2007,98:3159-3163.
[9]杨宁,赵谋明,杨宝,等.仙人掌多糖对蛋白质糖基化终产物和糖醛还原酶的抑制效应[J].天然产物研究与开发,2007,19(4):568-571.
[10]Hsieh C L,Lin Y C,Yen G C,et al.Preventive effects of guava(Psidium guajava L.)leaves and its active compounds against a-dicarbonylcompounds-induced blood coagulation[J].Food Chemistry,2007,103:528-535.
[11]陈宏伟,陈安徽,邵颖,等.蛹虫草胞外锌多糖抗氧化能力的研究[J].食品与发酵工业,2009,35(6):54-58.
[12]翁敏劼,甘纯矶,周学划,等.大球盖菇多糖生物活性的研究[J].食用菌学报,2010(3):98-100.
[13]马利华,秦卫东.生姜多糖抗氧化性及其组分的研究[J].食品工业科技,2010,31(3):120-124.
[14]Zhang L S,Wan X,Dong L L.Antioxidation and antiglycation of polysaccharides from misgurnus anguillicaudatus[J].Food Chemistry,2011,124:183-187.
[15]Rikan S L E,Hornbrook K R.Lipid peroxidation,antioxi-dant protection and aging[J].Biochem Biophys Acta,1997,1362:116-127.
[16]游育红,林志彬.灵芝多糖肽的抗氧化作用[J].药学学报,2003,8(2):85-88.
[17]吴华慧,李雪花,邱莉.荔枝、龙眼果肉及荔枝、龙眼多糖清除活性氧自由基的研究[J].食品科学,2004,25(5):166-169.
[18]孟繁磊,陈瑞战,张敏,等.刺五加多糖的提取工艺及抗氧化活性研究[J].食品科学,2010,31(10):168-174.
[19]Zhang Y L,Zhang J B,Mo X Y,et al.Modification,characterization and structure-anticoagulant activity relationships of persimmon polysaccharides[J].Carbohydrate Polymers,2010,82:515-520.
[20]王晓燕,李莉,吐尔逊,等.黑加仑多糖抗氧化活性研究[J].中外医疗,2009,3(9):6-7.
