石灰石循环分离CO2过程活性下降原因分析
2012-09-19陈江涛危日光陈鸿伟
陈江涛,危日光,陈鸿伟,陈 龙
(华北电力大学 能源动力与机械工程学院,河北 保定 071003)
0 引言
温室气体CO2的大量释放所引起的全球气候变暖,受到了各国政府和研究人员的广泛关注。研究表明:化石能源的利用是引起大气中CO2浓度升高的主要原因。因此研究发展高效的CO2分离技术,特别是煤燃烧过程中排放的CO2捕捉技术,减少燃煤CO2的排放量刻不容缓。近年来,出现了用石灰石等钙基吸收剂循环煅烧/碳酸化(cyclic calcinations/carbonation reaction,CCCR)吸收CO2的方法,可以实现电站在煤燃烧或煤气化制氢中大规模CO2高效、经济分离[1~7]。由于石灰石分布广泛、价格低廉,而且能实现CO2和SO2的同时脱除,因此引起了研究者的关注。
目前,制约CCCR法应用于工业实践的重要原因是钙基吸收剂的性能在循环利用的过程中会发生衰减,需要在运行过程中补充新鲜的吸收剂。因此,分析引起吸收剂性能衰减的原因,具有非常重要的意义。本文通过对循环碳酸化转化率进行分段研究,并利用扫描电镜观察不同循环次数下样品表面结构的差异,力求得到石灰石在循环煅烧/碳酸化过程中活性衰减的原因,为改善及制备高效、稳定的钙基CO2吸收剂提供依据。
1 实验部分
1.1 实验系统
整个实验在自建的热重分析仪上完成,其灵敏度为0.1 mg,称重范围±200 g,测温范围0~1 000℃,重复性实验误差±1%,满足实验精度要求。试样的热重数据由系统软件自动实时记录和保存,通过后续的数据处理软件得到转化率X-t曲线。石灰石煅烧气氛为N2,碳酸化气氛为N2和CO2按照一定的比例混合而成,N2和CO2的纯度均大于99.9%,混合的比例通过控制两个转子流量计实现。实验装置如图1所示。
1.2 实验样品
实验样品为保定天然石灰石,经破碎和筛分,取粒度在48~62 μm区间的颗粒。试样分析前在105℃下干燥至恒重,然后置于干燥器中冷却至室温密封保存。样品中所含的化学成分采用X射线原子荧光光谱仪 (XRF,EAGLEⅢ型)进行测定,结果见表1。

图1 实验装置图Fig.1 Experimental apparatus

表1 石灰石样品化学成分分析Tab.1 Chemical composition of limestone %
1.3 石灰石CCCR实验
实验在常压下进行,每次取用(0.2±0.02)g样品,为减小样品颗粒间的扩散阻力,将样品平铺在坩埚底面,形成厚度均匀的薄层。为减小反应气与样品间的扩散阻力,煅烧和碳酸化反应均采用大的反应气流量1 000 mL/min。为使实验过程更接近真实的反应过程,实验采用等温法。石灰石煅烧温度为900℃,碳酸化温度为700℃,碳酸化气氛由15%CO2和85%N2组成。对样品进行预备性试验以确定完全煅烧时间和充分碳酸化时间,分别为4 min和15 min。具体的实验过程如下:首先在设定煅烧温度和气氛下对石灰石进行煅烧实验,煅烧实验完毕后,将温度调节到设定的碳酸化温度,并在设定的碳酸化气氛下进行碳酸化实验,至此完成一个循环。为了更直观的比较不同循环次数下样品表面结构的差异,引入扫描电镜 (scanning electron microscopy,SEM,JSM-7500F)对样品形貌进行直接放大照相分析。
1.4 CaO转化率的计算
CaO碳酸化转化率X的计算公式如下:
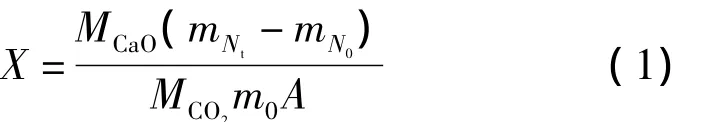
式中:MCaO和MCO2分别为CaO和CO2的摩尔质量;m0为反应前样品的质量;A为初始样品中CaO的含量;mNt为第N次循环碳酸化反应进行tmin后样品的质量;mN0第N次循环煅烧后样品质量,试验中样品每次循环煅烧后的质量基本相同。
2 实验结果与讨论
2.1 石灰石循环反应特性
图2为石灰石在经历7次煅烧/碳酸化循环后的初始TGA曲线。如图所示,阶段A为石灰石在高温下的煅烧分解过程,释放大量的气体质量快速降低;阶段B为煅烧产物的快速碳酸化过程,主要为 CaO对 CO2的吸收反应,初次煅烧使得CaO表面有着丰富的微孔,有利于CO2的快速扩散与CaO颗粒的充分反应,TG曲线显示样品质量快速增加。然而,随着固体样品碳酸化反应的进行,CaO颗粒表面生成的CaCO3会堵塞部分孔隙,从而阻碍了CO2与孔隙内部CaO的进一步碳酸化反应,使得反应速度大幅度减小,也就是图中的阶段C,此时1个循环结束。而随着循环的进行,CaO吸收CO2的能力显著降低。

图2 石灰石循环反应特性初始TGA曲线Fig.2 Initial TGA curve of limestone cyclic reaction characteristics
具体的循环碳酸化过程如图3所示。不同循环次数下CaO碳酸化反应特性相似,在反应的初期首先是反应速率非常快的化学反应控制阶段,然后反应转化率的增加速率明显降低,最后变化趋势趋于平缓,进入产物层扩散控制阶段[8]。但是,随着循环次数的增加,化学反应控制阶段逐渐缩短,CaO碳酸化反应较早地进入到产物层扩散控制阶段,导致碳酸化最终转化率减小。这种变化在前3次循环中尤为明显,在之后的循环反应中缩减幅度较小,例如a工况下前3次循环化学反应控制阶段结束时间分别约为2.7 min,1.9 min和1.6 min,而后4次循环化学反应控制阶段结束时间则为 1.4 min,1.3 min,1.1 min和1 min。

图3 CaO循环碳酸化转化率随时间的变化关系Fig.3 CaO cycle carbonation conversion rate changes with time
2.2 循环过程中样品的表面形貌
扫描电镜分析能直观地展现不同循环次数下煅烧产物的孔隙形态变化。如图4所示,石灰石在未煅烧前为片层状或大颗粒状,几乎看不到孔的存在。第1次煅烧反应后,煅烧产物具有发达的孔隙,各种类型的孔存在,以中孔和大孔居多,各孔道连接成网状,颗粒表面比较粗糙和复杂,碳酸化时CO2在孔隙内的扩散相对容易,因此第1次循环碳酸化转化率较高。而第7次煅烧反应后,烧结作用导致其孔隙大量减少,孔隙之间的连通性变差,其表面也变得相对平滑,CO2在这样的孔隙中扩散,受到较大的阻力,不利于CO2的捕捉。因此烧结所引起的空隙结构变化是循环碳酸化转化率降低的根本原因。

Fig.4 Sample surface structure of different cycle number
2.3 CaO反应活性降低原因分析
为了得到石灰石循环分离CO2过程活性下降的原因,给出了反应不同阶段CaO转化率随循环次数的变化情况,如图5所示。图中X1代表化学反应控制阶段CaO的转化率;X2为整个反应阶段的最终转化率;△X1为从化学反应控制阶段结束后到产物层控制阶段开始时的转化率;△X2为从产物层控制阶段开始时到最终的转化率。从图5中可以看出,CaO最终转化率主要由X1组成,△X1和△X2所占份额较少。观察曲线变化可知,X1随循环次数的增加呈指数规律降低,而△X1和△X2变化不明显,因此CaO反应活性降低主要由X1的下降引起。
从上述的分析可知,CaO活性降低主要发生在化学反应控制阶段;在产物层扩散控制阶段,烧结对CaO转化率的影响较小,这与文献[9]的研究结果一致。化学反应控制阶段的提前结束导致X1随循环次数而降低,而引起化学反应控制阶段缩短的根本原因是CaO颗粒的烧结。在每次循环的煅烧反应中,CaO颗粒发生烧结,孔隙结构变差,扩散逐渐成为碳酸化反应的主要阻力,化学反应控制区随着烧结程度的加重不断缩短,最终导致石灰石循环分离CO2过程活性逐渐下降。
3 结论
(1)CaO碳酸化反应主要由化学反应控制阶段和产物层扩散阶段组成,化学反应控制阶段结束时间随循环次数的增加而缩短,导致反应缓慢的产物层扩散阶段提前出现,最终导致碳酸化转化率随循环次数的增加而减小。
(2)随着煅烧反应的进行,煅烧产物发生烧结,烧结程度随循环次数增加而加重。烧结导致孔隙大量减少,孔隙之间的连通性变差,不利于CO2的捕捉。
(3)石灰石循环反应活性降低,主要由化学反应控制阶段CaO转化率的下降引起,而其根本原因是循环反应过程中烧结所引起的孔隙结构变化导致CaO反应活性降低。
[1]Li Zhenshan,Cai Ningsheng,Yang Jingbiao.Continuous production of hydrogen from sorption-enhanced steam methane reforming in two parallel fixed-bed reactors operated in a cyclic manner[J].Ind Eng Chem Res,2006,45(26):8788-8793.
[2]Han C,Harrison D P.Simultaneous shift reaction and carbon dioxide separation for the direct production of hydrogen[J].Chem Eng Sci,1994,49(24):5875-5883.
[3]Kato Y,Saku D,Harada N,et al.Utilization of high temperature heat from nuclear reactor using inorganic chemical heat pump[J].Prog Nucl Energy,1998,32(3-4):563-570.
[4]Abanades J C,Anthony E J,Wan G J,et al.Fluidized bed combustion systems integrating CO2capture with CaO[J].Environ Sci Technol,2005,39(8):2861-2866.
[5]Salvador C,LU D,Anthony E J,et al.Enhancement of CaO for CO2capture in an FBC environment[J].Chem Eng J,2003,96(3):187-195.
[6]Stanmore B R,Gilot P.Review calcinations and carbonation of limestone during thermal cycling for CO2sequestration[J].Fuel Process Technol,2005,86(16):1707-1743.
[7]冯垚飞,尚建宇.CaO颗粒表面形貌的多重分形研究[J].电力科学与工程,2011,27(10):61-64.Feng Yaofei,Shang Jianyu.Multifractal study for surface morphology of CaO particles[J].Electric Power Science and Engineering,2011,27(10):61-64.
[8]陈小华,郑 瑛,郑楚光,等.CaO再碳酸化的研究[J].华中科技大学学报:自然科学版,2003,31(4):54-55.Chen Xiaohua,Zheng Ying,Zheng Chuguang,et al.Research on the carbonation reaction of CaO[J].Huazhong Univ of Sci& Tech(Nature Science Edition),2003,31(4):54-55.
[9]李振山,蔡宁生,赵旭东,等.CaO与CO2循环反应动力学特性[J].燃烧科学与技术,2006,12(6):481-486.Li Zhenshan,Cai Ningsheng,Zhao Xudong,et al.Kinetic characteristic of the multiple carbonation cycle reactions of CaO with CO2[J].Journal of Combustion Science and Technology,2006,12(6):481-486.
