扇贝贝壳所含生物活性物质对促进脂肪分解的体外作用探讨
2012-09-19阎旭一刘云春
阎旭一,刘云春
(1.大理学院药学与化学学院,云南大理 671000;2.大理学院基础医学院,云南大理 671000)
保护海洋资源,充分利用已得到的资源,是有志者的共识和责任。扇贝贝壳是水产废弃物,扇贝贝壳含有的成分95%以上是碳酸钙,有机成分不足5%,在日本和其他欧美国家多作为墙壁涂料、土壤改良剂来加以利用。扇贝贝壳和珍珠的形成机制相似。在我国珍珠粉作为美容原料及中药成分使用广泛,价格不菲。为提高扇贝贝壳有效利用的附加值,我们对扇贝贝壳成分进行了较为详细的实验研究。扇贝贝壳的抽出成分含有数种生物活性成分已被前期实验研究所证实〔1〕。我们使用扇贝贝壳所含的生物活性物质对3T3-L1脂肪细胞的影响进行了体外作用评价;使用对脂肪分解有促进作用的异丙肾上腺素,作为扇贝贝壳所含生物活性物质有无促进脂肪分解作用的对比;使用珍珠所含生物活性物质进行同样的实验,来明确脂肪分解作用是否为扇贝贝壳所特有。
1 材料与方法
1.1 材料
1.1.1 扇贝贝壳甲醇抽出成分的提取 取200 g扇贝贝壳粉碎后,装入透析袋(MD25),在5%的醋酸溶液中进行透析,溶解除去扇贝贝壳中的碳酸钙;再用脱离子水透析,除去醋酸;除去醋酸的扇贝贝壳成分进行浓缩干燥后,加入70%甲醇溶解离心,取上清液浓缩干燥,得到扇贝贝壳的甲醇溶解成分。实验时,用70%甲醇溶解成不同浓度的样品〔2〕。
1.1.23T3-L1脂肪细胞株 JCRB9014(上海研谨生物科技有限公司提供)。
1.1.3 药品及试剂 DMEM、NaHCO3、 抗生素( penicillin-streptomycin)、牛胎儿血清( FCS)、维生素C、地塞米松、3-异丁基-1-甲基黄嘌呤、胰岛素、Oil Red“ O”染色剂、3.7%甲醛、trtonX-100、葡萄糖及牛血清蛋白(BSA)等,以上试剂均为分析纯,由上海泛柯生物科技有限公司和海德创业(北京)生物科技有限公司提供。
1.1.4 实验仪器 CO2培养箱(美国SHELLAB)、紫外分光光度仪(日本岛津)、生物显微镜(奥林巴斯)、24孔细胞培养皿、10 cm直径细胞培养皿。
1.2 实验方法
1.2.1 细胞培养液的组成及配制 ①基础培养液:取DMEM 1.348 g、NaHCO30.37 g、 抗生素溶液200 μL、FCS 5 mL、维生素C 3.5 mg,脱离子水定容至100 mL,溶解后滤过灭菌备用;②无血清培养液:取DMEM 1.348 g、NaHCO30.37 g、 抗 生 素 溶 液200 μL、维生素C 3.5 mg,加脱离子水容积至100 mL,溶解后滤过灭菌备用;③分化诱导培养液:取DMEM 1.348 g、NaHCO30.37 g、 抗生素溶液200 μL、FCS 5 mL、维生素C 3.5 mg、25 mM地塞米松0.25 μL、3-异丁基-1-甲基黄嘌呤11.1 mg、胰岛素1 mg,加脱离子水定容至100 mL,溶解后滤过灭菌备用;④细胞成熟培养液:取DMEM 1.348 g、NaHCO30.37 g、抗生素溶液200 μL、FCS 5 mL、 维生素C 3.5 mg、 胰岛素5 mg,加脱离子水定容至100 mL,溶解后滤过灭菌备用。
1.2.2 PBS和KRP缓冲液的组成及配制 ①PBS缓冲液:NaCl 4 g、Na2HPO40.55 g、KCl 0.1 g、KH2PO40.1 g,加脱离子水定容至500 mL,高压灭菌后备用;②KRP缓冲液:NaCl 0.7 g、KCl 35.8 mg、CaCl214.7 mg、MgSO429.6 mg、Na2HPO422.3 g、NaH2PO4104.3 mg、葡萄糖193 mg、BSA 2 g,维生素C 10 mg,加脱离子水定容至100 mL,溶解后滤过灭菌备用。
1.2.3 3T3-L1脂肪细胞的分化培养〔2〕将3T3-L1脂肪细胞解冻复苏,置入10 cm直径细胞培养皿,加入基础培养液8 mL,放入CO2培养箱( 37 ℃、5%CO2)中培养,直至细胞对数生长期;使用24孔细胞培养皿,将呈对数生长期的3T3-L1脂肪细胞按每孔3.5×104个细胞的数量注入,每孔添加基础培养液1.5 mL,放入CO2培养箱( 37 ℃、5%CO2) 中培养12 h;12 h后,去除上清液,用PBS溶液洗净培养细胞2次,添加无血清培养液1.5 mL,放入CO2培养箱(37℃、5%CO2)中培养12 h;12 h后,去除上清液,添加分化诱导培养液1.5 mL,放入CO2培养箱( 37 ℃、5%CO2)分化培养45 h后,除去上清液,用PBS缓冲液2次洗净培养细胞,添加细胞成熟培养液1.5 mL,3 d交换一次成熟培养液,持续一周,得到分化成熟的实验用3T3-L1脂肪细胞。
1.2.4 3T3-L1脂肪细胞释放出的游离甘油值测定使用上述分化成熟的3T3-L1脂肪细胞,每孔内分别加入KRP缓冲溶液200 μL,再按不同浓度加入扇贝贝壳( 70%甲醇溶解)抽出液10 μL,( 6孔一组浓度)。对照组加入70%的甲醇溶液10 μL,放入CO2培养箱(37 ℃、5%CO2)中反应2 h;反应结束后,回收上清液,使用甘油测定试剂盒(购于上海泛柯生物科技有限公司,日本进口)测定3T3-L1脂肪细胞释放的甘油值(按试剂盒所示方法进行测定)。同样方法,使用分化成熟的3T3-L1脂肪细胞,加入不同浓度的异丙肾上腺素、珍珠甲醇抽出成分,测定3T3-L1脂肪细胞释放的甘油值〔3〕。
1.2.5 3T3-L1脂肪细胞的Oil Red“O”染色 ①配制染色液:取Oil Red“ O”染色剂15 mg、丙醇5 mg,加脱离子水5 mL混合,滤纸过滤备用;②配制3.7%甲醛-PBS溶液:取37%甲醛溶液500 μL,加入PBS溶液4.5 mL;③配制0.1%trtonX-100-PBS溶液:取trtonX-1005 μL,加入PBS 5 mL;④细胞染色:使用上述分化培养成熟的3T3-L1脂肪细胞,分别加入KRP溶液200 μL,实验组加入2.4 mg/mL扇贝贝壳甲醇抽取液10 μL(70%甲醇溶解),对照组加入70%甲醇10 μL,放入CO2培养箱( 37 ℃、5%CO2) 中反应2 h;反应结束后除去上清液,用PBS缓冲液2次洗净,分别加入3.7%甲醛-PBS溶液200 μL,室温下固定细胞5 min;用PBS洗净细胞,除去甲醛;分别加入0.1%trtonX-100-PBS溶液200 μL,室温反应5 min;用PBS洗净细胞,分别加入Oil Red“ O”染色液200 μL,室温下染色10 min,染色结束后,用脱离子水洗净细胞,于显微镜下观察实验脂肪细胞中脂肪的染色情况。
2 结果
实验数据采用t检验方法进行统计学处理。
2.1 扇贝贝壳生物活性物质促进脂肪分解作用使用分化成熟的3T3-L1细胞,加入扇贝贝壳的抽取成分的实验结果显示出脂肪分解增强的作用,测定得出的甘油值与对照组相比有明显的增高,差异具有统计学意义(P<0.05),升高程度呈浓度依存性。在浓度为4.9 mg/mL处,升高程度接近对照组的2倍,见图1A。在对3T3-L1细胞脂肪细胞脂肪进行Oil Red“O”染色后的结果也显示加入扇贝贝壳抽出成分的脂肪细胞内被染成红色的脂肪(甘油三酯)与对照组相比明显减少,见图2。
2.2 异丙肾上腺素促进脂肪分解的作用 使用分化成熟的3T3-L1细胞,加入异丙肾上腺素的实验结果显示脂肪分解增强的作用,差异具有统计学意义(P<0.05)。在浓度为10 nM时,与对照组相比,升高程度接近1.5倍,见图1B。
2.3 珍珠抽出成分对脂肪分解的结果 与扇贝贝壳内层有着同样结构机制构成的珍珠抽出成分进行的实验结果却没有显示出促进脂肪分解的作用,见图3。
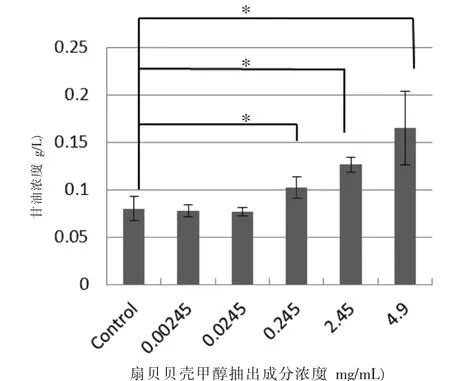
图1A 扇贝贝壳生物活性成分对脂肪分解的促进作用
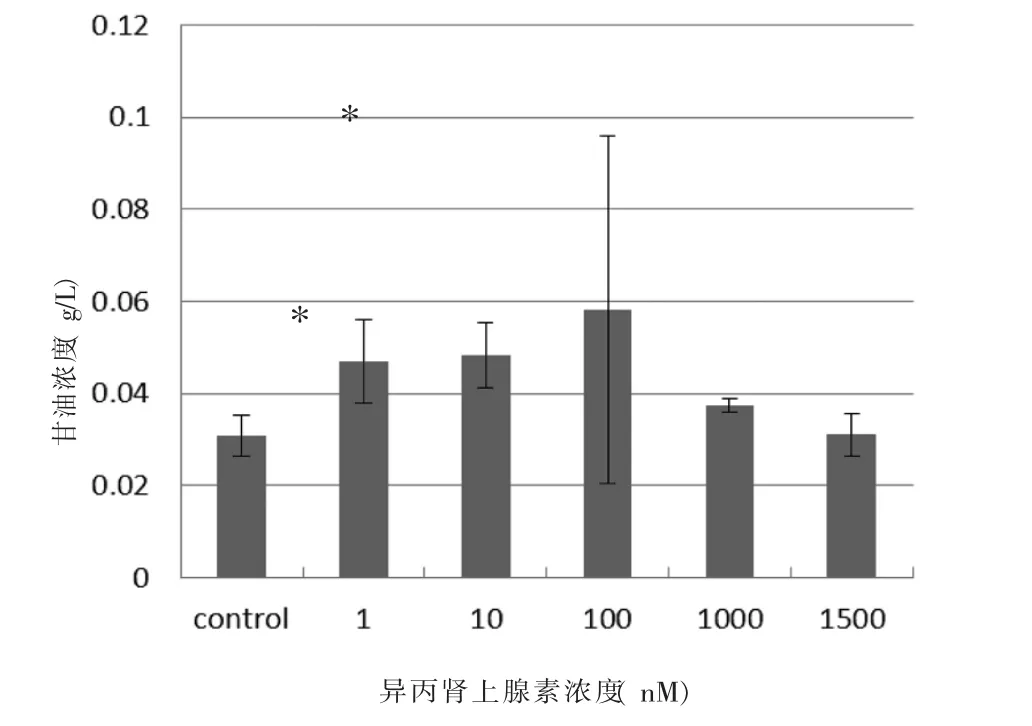
图1B 异丙肾上腺素的促进脂肪分解作用

图2 3T3-L1脂肪细胞Oil Red“ O”染色
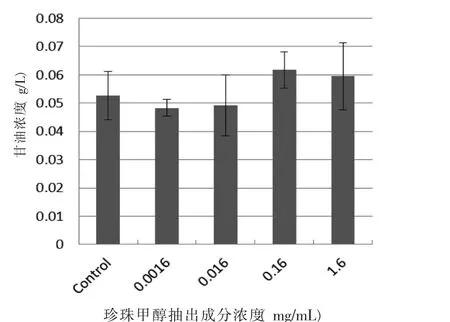
图3 珍珠抽出成分对脂肪分解的作用
3 讨论
传统认为脂肪组织是一种起着贮存中性脂肪、供应能量、调节体温等功能的组织,近年来发现脂肪组织还是一个代谢活跃、功能复杂的内分泌器官。人体的脂肪细胞能分泌数十种脂肪因子(adipocytokrilles)及蛋白质因子,对全身各器官、组织(包括脂肪组织本身)有着重要的调节功能,故脂肪组织被称为人体内最大的内分泌腺体〔4〕。脂肪组织分为白色脂肪组织和褐色脂肪组织,白色脂肪组织的功能以储存甘油三酯(脂肪)为主,是构成动物皮下脂肪和内脏脂肪的主要成分。本实验中使用的3T3-L1脂肪细胞,是一种能分化成白色脂肪细胞的细胞株,我们使用扇贝贝壳的甲醇(70%)抽出成分对3T3-L1脂肪细胞进行的体外实验结果显示,扇贝贝壳的抽出成分中含有促进脂肪分解的生物活性成分,其对脂肪分解的活性程度不亚于异丙肾上腺素对脂肪的分解活性。在对实验脂肪细胞3T3-L1进行的Oil Red“O”染色的结果,也直观的显示了扇贝贝壳抽出成分对脂肪细胞内脂肪的促分解作用。
脂肪分解需要激素敏感性甘油三酯脂酶(HSL)的参与,激素敏感性甘油三酯脂酶(HSL)的活化机制与细胞内cAMP的浓度增加、cAMP蛋白激酶的活化有关〔5〕,扇贝贝壳所含生物活性成分的促进脂肪分解的机制是否与激活激素敏感性甘油三酯脂酶(HSL)机制有关尚不清楚,确切的作用机制有待进一步的研究。
另一方面,我们用同样的评价方法对珍珠的甲醇抽出成分进行了评价,结果显示,珍珠抽出成分对脂肪细胞未显示出促进脂肪分解的作用(P>0.05,图3)。珍珠的构成是霰石结晶,而扇贝贝壳的构成是方解石结晶,可能由于构成成分有异而显示不同的作用〔6-8〕。由此推断,促进脂肪分解的活性成分可能仅存在于扇贝贝壳中。
〔1〕Y C Liu, K.Uchiyama, N Natsui, et al.In vitro activities of the components from scallop shells〔J〕.Fisheries Sci,2002( 68): 1330-1336.
〔2〕刘云春.水产系廃棄物ホタテガイ贝殻に含まれる生理活性物質〔D〕.室兰工业大学博士论文,2006:3-7.
〔3〕Shimizu M,Blaak E E,Lonnqvist F,et al.Agonist and antagonist properties of 3-adrenoceptors in human omental and mouse 3T3-L1 adipocytes〔J〕.Pharmacol.Toxicol,1996( 78) :254-263.
〔4〕张杰涛,穆琳,陈亭云,等.脂肪激素和脂肪因子〔J〕.滨洲医学院学报, 2004,27( 6):442-444.
〔5〕S G McKnight, D E Cummings, P S Amieux, et al.Cyclic AMP,PKA,and the physiological regulation of adiposity〔J〕.Rec.Progr.Horm.Res, 1998( 53) : 139-158.
〔6〕Sudo S,Kujikawa T,Nagakura T,et al.Structure of mollusc shell framework proteins〔J〕.Nature, 1997( 387):563-564.
〔7〕MiyashitaT,TakagiR,OkushimaM,etal.A complementary DNA cloning and characterization of pearlin,a new class of matrix protein in the nacreous layer of oyster pearls〔J〕.Mar.Biotechnol.2000( 2): 409-418.
〔8〕Kono M,Hayashi N,Samata T.Molecular mechanism of the nacreous layer formation in Pinctada maxima〔J〕.Biochem.Biophys.Res.Commun., 2000( 269): 213-218.
