光肩星天牛对寄主植物萜烯类化合物触角活性和电位反应1)
2012-09-18范丽清严善春
范丽清 严善春 程 红
(东北林业大学,哈尔滨,150040)
孙宗华
(延边州林业管理局)
光肩星天牛(Anoplophoraglabripennis(Motsch.))隶属于鞘翅目天牛科(Cerambycidae),是多种阔叶树的重要蛀干害虫[1]。随着种群数量增多,分布范围不断扩大,寄主种类在扩增,已给林业生产和园林建设造成了严重损失[2-6]。其中槭、杨、柳、榆和桦等属的部分树种受害严重,复叶槭为其嗜好寄主。光肩星天牛已侵入森林[7],对其进行有效防控迫在眉睫,然而现有的方法很难取得满意的效果,急需开发高效环保的防控措施。随着昆虫化学生态学的迅速发展,昆虫与植物之间的化学信息联系越来越受到国内外相关学者重视。寄主所释放的挥发性化学物质直接决定成虫对补充营养和产卵寄主的选择[8-9]。分析寄主植物挥发物成分,筛选和利用植物源挥发性物质制备相应的引诱剂已成为防控蛀干害虫的主要研究方向。从昆虫寄主植物中筛选引诱性挥发物质是制备引诱剂的一般原则,利用常规的电生理方法可以检测出挥发物是否会引起昆虫生理反应[10-12]。研究表明,植物释放的特定的挥发性气味物质能够对天牛起到引诱或驱避作用[13]。
许多研究者对光肩星天牛寄主复叶槭、旱柳、合作杨、毛白杨、新疆杨、五角枫、华北五角枫和挪威槭等挥发物组成进行了分析报道[14-18]。李建光等[14]对复叶槭挥发物部分组分糠醛、青叶醛、青叶醇、甲基糠醛、苯甲醇、己醛、己醇、乙酸丁酯、丙酸丁酯、丁酸乙酯、反-2-己烯醇11种单体进行了EAG测定。笔者参考以上相关研究,结合本人对其它寄主挥发物成分分析,选择其中12种植物挥发性气味物质进行如下研究:①光肩星天牛触角敏感部位;②离体触角活性随时间变化规律;③植物源挥发物单体对光肩星天牛的电生理反应及其差异性,筛选有效单体。以期为进一步的光肩星天牛电生理测试和后续的引诱剂和驱避剂的开发提供基础资料。
1 材料与方法
1.1 供试昆虫
试验用光肩星天牛雌、雄成虫于2010年8月采自东北林业大学校园内的白桦林,采集后将其分别置于养虫罐中饥饿12 h,待用。
1.2 供试植物源挥发性物质及其配制
根据寄主植物各种挥发物的含量,参照同类试验的研究[18-19],确定 2 mol·L-1为测试浓度。将各种挥发物标准品分别溶于液体石蜡中,用涡旋混合器使其充分混合,配制成基本浓度为2 mol·L-1的溶液;以液体石蜡(天津市百世化工有限公司)做对照。
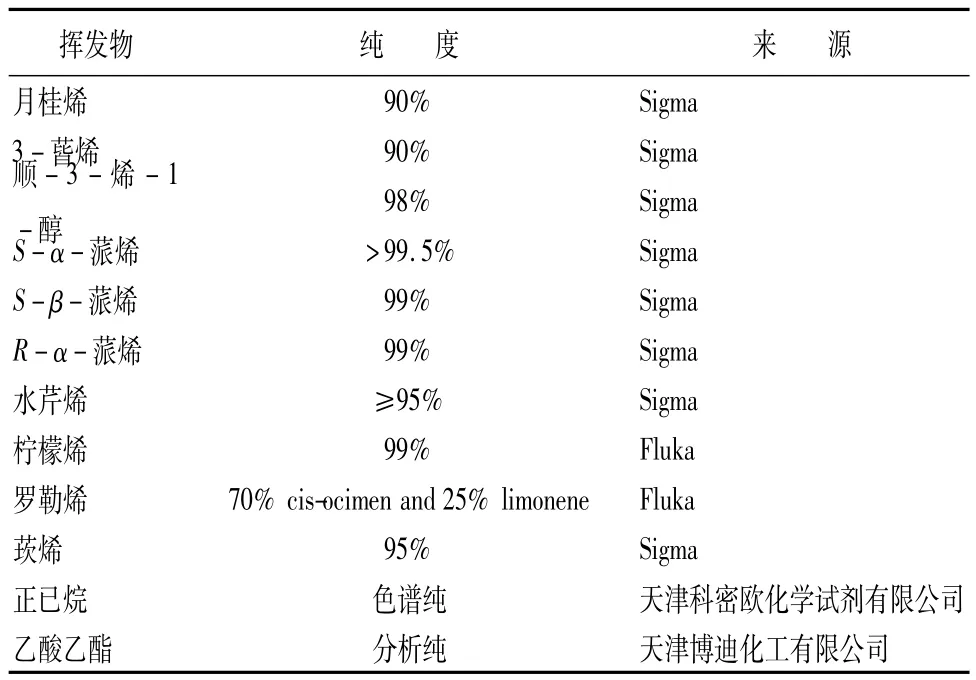
表1 12种标准挥发物的名称、纯度和来源
1.3 试验方法
触角电位仪由荷兰Syntech公司智能化数据获取控制器IDAC-4、微动操作仪Syntech MN-151、刺激气流控制器Syntech CS-55及Syntech软件处理系统组成。测定方法参照方宇凌等[20]、严福顺等[21]的测试方法。刺激气流流速、持续气流均设定为400 mL·min-1,刺激时间 0.5 s,2 次刺激间隔60 s。将剪成1.5 cm×0.8 cm的定性滤纸纸条折成1.5 cm×0.4 cm作为试验用挥发物的载体,测试剂量为 10 μL。
选择活跃的光肩星天牛,用手术刀片将整根触角从鞭节基部切下,再切除端节的少许末梢,然后用一端连有银丝的2根导电管(内部充满导电液的自制细玻璃管)连接到两电极上,相对端连接触角的两端,调整气味混合管与触角间距离为1 cm[19]。
触角的活性因离体时间的延长而降低,测试过程中需定时标定触角的活性。标定方法:在每种挥发物EAG测定的前后各做一次2 mol·L-1顺-3-烯-1-醇标样的EAG测定,这样不仅可以随时观察触角活性降低情况,及时更换触角,还可以通过测试单体和前后2次标样平均值的比值消除触角活性随时间的延长而降低给测试结果带来的影响[14]。
触角敏感部位测定:以顺-3-烯-1-醇和月桂烯2种挥发物(初步测试EAG反应明显的2种挥发物)为刺激源,每种挥发物测试3根触角,刺激顺序从触角基节至端节,每节重复测试3次,取其平均值。
离体触角活性随时间变化规律测定:雌、雄虫分别测定3根触角,测试间隔时间为24 min,刺激源为2 mol·L-1顺 -3- 烯 -1- 醇,刺激部位为触角最敏感节,3次重复,直至触角失去活性测试结束。
触角电位(EAG)测定:测定光肩星天牛雌、雄成虫对12种植物挥发物2 mol·L-1的触角电位(EAG)反应。刺激部位为触角最敏感节,以液体石蜡为对照,3次重复。
利用SPSS 17.0统计软件对试验数据进行方差分析和Duncan多重比较。EAG反应均值用方差分析检验其显著性(P<0.05),采用独立样本T检验检测雌、雄成虫对挥发物 EAG反应的差异显著性[22-23]。
2 结果与分析
2.1 触角敏感部位测定
由图1可知,光肩星天牛(雌、雄)不同个体的触角各节对顺-3-烯-1-醇和月桂烯EAG反应敏感度不尽相同;但均呈现相似的规律性,端部第2节EAG反应强度最大,第1节次之,3~9节逐渐变小,即触角各节EAG反应曲线均在第2节出现最大峰值。
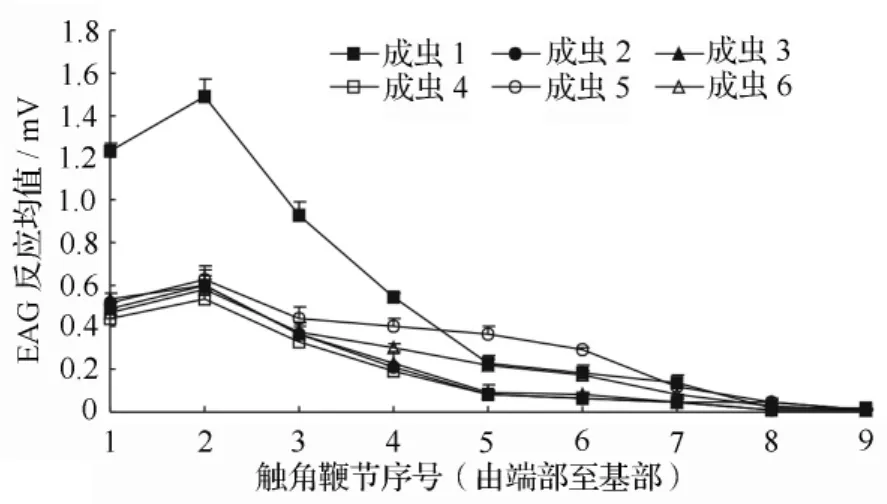
图1 触角各节对顺-3-烯-1-醇(成虫1、2、3)和月桂烯(成虫 4、5、6)的 EAG 反应
2.2 雌、雄成虫离体触角活性随时间变化规律
由图2可知,光肩星天牛雌、雄成虫离体触角活性随时间的变化趋势是一致的,均呈现随着时间的延长逐渐减弱的趋势,并呈波浪式递减。区别在于,雌性随时间延长活性平缓减弱,活性保持时间较长,以触角电位值减到近0.02 mV(认定基本失去活性)计,用时达10 h;而雄性离体触角活性0.8 h内呈现陡减趋势,而后进入平缓减弱状态,电位值减到近0.02 mV 仅用时 2.8 h。

图2 光肩星天牛触角活性随时间变化规律
2.3 2 mol·L-1挥发物的触角电位
由表2可知,与对照相比,雌虫触角对12种单体的EAG反应均达极显著水平(P<0.01);其中,顺-3-烯-1-醇最强,达到0.816 mV;其次是月桂烯、乙酸乙酯和水芹烯;正己烷最弱,为0.23 mV;最强和最弱相差值为0.586 mV,较悬殊;12种挥发物EAG反应差异显著性由大到小依次为:顺-3-烯-1-醇、月桂烯、乙酸乙酯、水芹烯、3-蒈烯、S-α-蒎烯、莰烯、R-α-蒎烯、S-β-蒎烯、柠檬烯、罗勒烯、正己烷。雄虫触角EAG反应,除S-α-蒎烯无明显反应外(P>0.05),其余11种挥发物均达到显著或极显著水平(P<0.05或P<0.01),其中乙酸乙酯EAG反应最强,达到1.014 mV;其次是顺-3-烯-1-醇和R-α-蒎烯;柠檬烯最弱,仅为0.160 mV;最强和最弱差值为0.854 mV,相差较雌成虫更为悬殊;12种挥发物EAG反应差异显著性由大到小依次为:乙酸乙酯、顺-3-烯-1-醇、R-α-蒎烯、S-β-蒎烯、水芹烯、罗勒烯、正己烷、莰烯、月桂烯、3-蒈烯、柠檬烯、S-α-蒎烯。独立样本T检验表明:光肩星天牛雌、雄成虫触角对12种挥发物单体的EAG反应,除雌、雄成虫对S-β-蒎烯EAG反应差异不显著(P>0.05)外;对顺-3-烯-1-醇和正已烷差异显著(P<0.05),对其余9种挥发物差异达极显著水平(P<0.01)。雌、雄虫之间EAG反应存在显著差异的11种挥发物中,雌虫对月桂烯、3-蒈烯、S-α-蒎烯、水芹烯、柠檬烯、莰烯和顺-3-乙烯醇7种挥发物的EAG反应强于雄虫;雄虫对R-α-蒎烯、罗勒烯、乙酸乙酯和正己烷4种挥发物的EAG反应强于雌虫。
3 结论与讨论
触角是昆虫主要感觉器官,昆虫化学感受器主要分布在触角上,触角对昆虫的求偶、觅食等行为起关键作用[24]。不同昆虫之间,嗅觉感受器的大小、分布和数量变化很大,在果蝇中,嗅觉感受器位于触角的第3节和口器的下颚须上[25]。利用电生理方法研究昆虫对其寄主挥发物的生理反应试验,掌握昆虫触角嗅觉敏感部位是关键,尤其是触角比较长的天牛类昆虫。测试结果证明,光肩星天牛雌、雄虫触角嗅觉最敏感部位均为触角端部第2节,这一结论与李建光等[14]报道的结论相吻合。
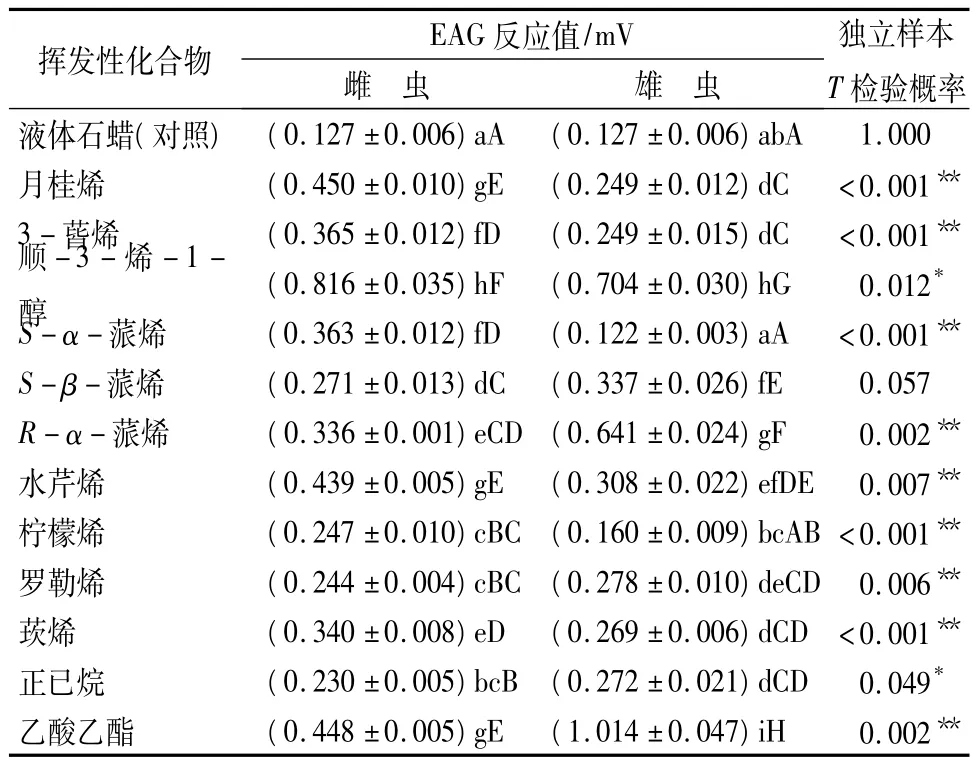
表2 光肩星天牛雌、雄成虫对2 mol/L的不同挥发物单体的EAG反应
昆虫离体触角随时间延长活性会逐渐降低。试验结果证明,光肩星天牛雌、雄离体触角随时间的延长活性的变化不尽相同,雌虫触角活性随时间的延长呈现逐渐减弱的趋势,活性保持时间较长,可长达10 h;雄虫触角在离体后短时间内活性陡降,而后呈现缓慢降低,活性保持时间仅为2.8 h。电生理测试中,需根据情况灵活掌握具体更换时间。建议光肩星天牛雌虫每只离体触角使用时间在7 h之内,雄虫在2 h之内。利用昆虫触角进行电生理测试之前,首先测试该种昆虫离体触角活性随时间变化规律是必要的,可为电生理试验过程中及时更换触角提供依据,使测试结果更为准确可靠。
不同性别的昆虫在寻找寄主、繁殖后代等行为中所起的作用不同,反映出雌、雄成虫触角感受器可能存在特殊的与性别有关的数量上的差异,或存在嗅觉生理方面的定性差异[26-27]。电生理测试表明,光肩星天牛对测试的12种挥发物均有明显的EAG反应,雄虫除对S-α-蒎烯不显著外,其余均显著(P<0.01),并且雌、雄虫之间存在明显的差异性(P<0.05)。说明光肩星天牛雌、雄两性对来自环境中的气味具有不同的选择性和敏感性,预示着雌、雄成虫触角感受器可能存在数量和类型上的差异,或存在嗅觉生理上的差异。这一结果与阎雄飞等[28]报道的光肩星天牛雌、雄个体之间触角感受器的类型没有明显差异,但感受器的分布存在性二型现象是相符合的。
[1]萧刚柔.中国林业昆虫[M].2版(增订版).北京:中国林业出版社,1992.
[2]唐晓琴,李亮明,臧建成,等.西藏外来林业有害生物的发生与防范[J].中国森林病虫,2011,30(1):44 -46,5.
[3]李国宏,高瑞桐,Smith M T,等.光肩星天牛种群扩散规律的研究[J].林业科学研究,2010,23(5):678 -684.
[4]徐茂华,刘满光.光肩星天牛为害悬铃木情况调查及防治研究初报[J].河北林业科技,2009(1):10,12.
[5]Giuseppino S,Pio Federico R.Feeding and oviposition of Anoplophora chinensis on ornamental and forest trees[J].Phytoparasitica,2010,38(5):421 -428.
[6]Carter M,Smith M,Harrison R.Genetic analyses of the Asian longhorned beetle(Coleoptera,Cerambycidae,Anoplophora glabripennis),in North America,Europe and Asia[J].Biol Invasions,2010,12(5):1165 -1182.
[7]高瑞桐,Baode W,Mastro V C,等.光肩星天牛对白桦林的危害及药剂防治效果[J].林业科学,2009,45(2):163 -166.
[8]杜家纬.植物—昆虫间的化学通讯及其行为控制[J].植物生理学报,2001,27(3):193 -200.
[9]江望锦,嵇保中,刘曙雯,等.天牛成虫信息素及嗅觉感受机制研究进展[J].昆虫学报,2005,48(3):427 -436.
[10]WilliamsⅢ L,Rodriguez-Saona C,Castle S C,et al.EAG-active herbivore-induced plant volatiles modify behavioral responses and host attack by an egg parasitoid[J].Journal of Chemical E-cology,2008,34(9):1190 -1201.
[11]Allison J D,Cardé R T.Male pheromone blend preference function measured in choice and no-choice wind tunnel trials with almond moths,Cadra cautella[J].Animal Behaviour,2008,75:259-266.
[12]Ngumbi E,Chen Li,Fadamiro H Y.Comparative GC-EAD responses of a specialist(Microplitis croceipes)and a generalist(Cotesia marginiventris)parasitoid to cotton volatiles induced by two caterpillar species[J].Journal of Chemical Ecology,2009,35(9):1009-1020.
[13]Allison J D,Borden J H,Seybold S J.A reviewof the chemicalecology of the Cerambycidae(Coleoptera) [J].Chemoecology,2004,14:123 -150.
[14]李建光,骆有庆,金幼菊.复叶槭挥发性物质对光肩星天牛的触角电位反应[J].北京林业大学学报,1999,21(4):1 -5.
[15]李建光,金友菊,骆有庆,等.光肩星天牛不同寄主树种挥发性物质的比较分析[J].北京林业大学学报,2002,24(5/6):165-169.
[16]李继泉,樊慧,金幼菊,等.光肩星天牛取食后复叶槭挥发物的释放机制[J].北京林业大学学报,2002,24(5/6):170-174.
[17]张风娟,金幼菊,陈华君,等.光肩星天牛对4种不同槭树科寄主植物的选择机制[J].生态学报,2006,26(3):870 -877.
[18]张风娟,武晓颖,杨莉,等.超临界CO2萃取五角枫挥发物及其对光肩星天牛的嗅觉行为反应[J].林业科学,2007,43(6):146-150.
[19]严善春,程红,杨慧,等.青杨脊虎天牛对植物源挥发物的EAG 和行为反应[J].昆虫学报,2006,49(5):759 -767.
[20]方宇凌,张钟宁.植物气味化合物对棉铃虫产卵及田间诱蛾的影响[J].昆虫学报,2002,45(1):63 -67.
[21]严福顺,阎云花,张瑛,等.两种蚜茧蜂及其寄主蚜虫对大豆植株挥发性次生物质的触角电位反应[J].昆虫学报,2005,48(4):509-513.
[22]Hern A,Dorn S.A female-specific attractant for the codling moth,Cydia pomonella,from apple fruit volatiles[J].Naturwissenschaften,2004,91(2):77 -80.
[23]Tooker J H,Crumrin A L,Hanks L M.Plant volatiles are behavioral cues for adult females of the gall wasp Antistrophus rufus[J].Chemoecology,2005,15(2):85 -88.
[24]李照会.园艺植物昆虫学[M].2版.北京:中国农业出版社,2011.
[25]Stocker R F.The organization of the chemosensory system in Drosophila melanogaster:a review[J].Cell Tissue Res,1994,275:3-26.
[26]Raguso R A,Light D M,Pickersky E.Electroantennogram responses of Hyles lineata(Sphingidae:Lepidoptera)to flord volaliles compounds from Clarkia breweri(Onagraceae)and other moth2pollinated flowers[J].J Chem Ecol,1996,22:1735 -1766.
[27]金凤,嵇保中,刘曙雯,等.昆虫产卵分泌物的产生方式、成分及功能[J].昆虫学报,2009,52(9):1008 -1016.
[28]阎雄飞,孙月琴,刘永华,等.光肩星天牛触角感受器的环境扫描电镜观察[J].林业科学,2010,46(11):104-109.
