重组表达乙肝病毒x蛋白的腺病毒构建及在HepG2细胞的表达*
2012-09-17张红飞李军锋张慧娜鲍春旸王凯娟周育森
张红飞,李军锋,户 义,张慧娜,鲍春旸,王凯娟#,周育森
1)郑州大学公共卫生学院流行病学教研室郑州450001 2)军事医学科学院微生物流行病研究所病原微生物生物安全国家重点实验室北京100071
重组表达乙肝病毒x蛋白的腺病毒构建及在HepG2细胞的表达*
张红飞1,2),李军锋2),户 义2),张慧娜1),鲍春旸2),王凯娟1)#,周育森2)
1)郑州大学公共卫生学院流行病学教研室郑州450001 2)军事医学科学院微生物流行病研究所病原微生物生物安全国家重点实验室北京100071
#通讯作者,女,1964年10月生,博士,教授,研究方向:肿瘤流行病学,E-mail:kjwang@163.com
腺病毒载体;HBx基因;肝癌细胞
目的:构建重组表达HBx的腺病毒,并通过感染细胞建立HBx高表达的细胞模型。方法:首先将HBx基因插入腺病毒穿梭质粒pAdTrack中,限制性酶切鉴定正确后将其用PmeⅠ酶切线性化,转到BJ5183感受态细菌进行同源重组,重组后的腺病毒载体pAd-HBx经PacⅠ酶切线性化后,转染到QBI-293A细胞中,根据EGFP的表达判断重组腺病毒的包装情况。RT-PCR鉴定重组腺病毒的HBx基因表达。根据GFP的表达检测病毒滴度和感染效率。将病毒感染人肝癌HepG2细胞,48 h后收集裂解细胞,Western blot检测HBx蛋白的表达。结果:重组腺病毒载体pAd-HBx经酶切鉴定确认构建成功。将pAd-HBx转染到QBI-293A细胞,荧光检测提示病毒获得成功包装,RT-PCR检测到细胞中HBx基因的表达。重组病毒感染人肝癌HepG2细胞,Western blot检测到HBx蛋白表达。结论:成功构建了携带HBx基因的重组腺病毒,感染肝癌HepG2细胞后检测到了HBx蛋白的表达,提示建立了HBx高表达的细胞模型,为后续的HBx的功能研究奠定了基础。Military Medical Sciences,Beijing 100071
乙肝病毒x(HBx)蛋白是乙肝病毒致肝细胞癌变的重要相关分子[1],具有多种生物学功能,可通过反式激活作用调节基因的转录,与宿主细胞的多种蛋白相互作用[2],调控宿主细胞基因表达,进而影响宿主细胞的信号转导、细胞增殖与分化和细胞凋亡、蛋白降解过程及遗传稳定性[3-5]等。为了深入研究HBx的功能,建立HBx多种高表达的细胞模型和(或)小鼠模型,进而研究HBx参与调控的信号通路,作者构建了HBx的重组腺病毒载体,经过包装得到高滴度的HBx重组腺病毒,并用其感染肝癌HepG2细胞,检测HBx表达,为深入研究HBx的生物学功能提供所需的材料。
1 材料与方法
1.1 材料 腺病毒载体系统 pAdTrack、含pAdEasy-1载体的 BJ5183细菌、HepG2细胞、QBI-293A细胞以及空腺病毒均来自该教研室;含HBV1.3的pAAV-HBV1.3载体由中国疾病预防控制中心病毒病预防控制所谭文杰教授惠赠;pMD18-T载体系统购自TaKaRa公司;DH5α感受态、DNA标准Marker、小量质粒提取试剂盒和DNA凝胶回收试剂盒均购自北京全式金生物技术有限公司;限制性内切酶PmeⅠ、PacⅠ购自NEB公司;胎牛血清、高糖型DMEM培养液(C12430)购自Gibco公司;PMSF购自Amresco公司;HBx多克隆抗体为作者先期使用原核表达的HBx蛋白免疫大耳白兔所制备;HRP标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司;Western blot显色试剂盒购自北京普利莱基因技术有限公司;Lipofectamine 2000购自Invitrogen公司。
1.2 重组表达HBx腺病毒的制备
1.2.1 重组穿梭质粒pAdTrack-HBx载体的构建和鉴定 设计 HBx编码基因扩增的引物 P1:5’-AAGCTTGCCACGATGGCTGCTAGGTTG-3’,P2:5’-TTATGCAGAGGTGAAAAAGTTG-3’,引物由生工生物工程(上海)有限公司合成;以pAAV-HBV1.3为模板,PCR扩增HBx的编码基因,扩增产物大小为474 bp。扩增产物进行10 g/L的琼脂糖凝胶电泳,切胶回收目的基因片段,连接入pMD18-T克隆载体,在含氨苄青霉素平板上培养选取单克隆菌落,扩增后,提取质粒进行序列测定(由北京奥科鼎盛生物科技公司完成),将序列正确的克隆以HindⅢ和SmaⅠ酶切,回收HBx基因片段后连接入经HindⅢ和EcoRⅤ酶切回收的pAdTrack载体中。挑取卡那霉素选择性培养基筛选的阳性克隆,提取质粒,使用BamHⅠ进行酶切鉴定(正确重组载体应含有3个BamHⅠ位点,其中一个为pAdTrack载体所含有的位点,另外一个为HBx编码区N端所含有的位点,第3个位点为pMD18-T-HBx载体编码下游T载体所含有的位点)。正确的克隆被切开为3条带,其中5 171 bp和3 885 bp为载体片段,468 bp为含HBx的目的片段,正确克隆命名为pAdTrack-HBx。
1.2.2 HBx重组腺病毒载体的构建 将上述构建的穿梭质粒pAdTrack-HBx使用PmeⅠ酶切线性化后转化入含腺病毒骨架质粒pAdEasy-1的BJ5183感受态细菌中。卡那霉素选择性培养基筛选阳性克隆,挑取10个菌落较小的克隆扩增培养,依据文献[6]使用快速裂解法初步筛选重组克隆。选择2个DNA条带最大的克隆,提取质粒,转化入DH5α感受态扩增质粒,用PacⅠ酶切鉴定质粒,切下3.0 kb或4.5 kb条带的克隆载体,为正确重组的表达HBx腺病毒载体克隆,命名为pAd-HBx重组载体。
1.2.3 细胞培养和转染 QBI-293A细胞及HepG2细胞培养于DMEM培养基。培养基中添加体积分数10% 胎牛血清(FBS),2 mmol/L谷氨酰胺,100 U/mL青霉素和100 mg/L链霉素,体积分数5%CO2、37℃恒温孵箱培养。按Lipofectamine 2000说明书进行转染。
1.2.4 pAd-HBx重组腺病毒的包装和滴度测定pAd-HBx重组质粒经PacⅠ酶切后,回收大片段后转染入QBI-293A细胞,转染6~8 d后,在荧光显微镜下监测细胞绿色荧光蛋白(GFP)的表达情况,如果细胞中的绿色荧光充满视野则说明重组腺病毒载体在细胞中包装成病毒。收集包装后的细胞,一部分加入1 mL的DMEM培养液重悬细胞,-70℃/37℃反复冻融3次裂解细胞,离心后取含病毒的上清液-70℃保存。一部分以未包装细胞和空腺病毒感染细胞为阴性对照,用Trizol法提取RNA,逆转录得到cDNA,以pMD18-T-HBx为阳性对照,PCR扩增鉴定HBx的转录表达。取重组病毒和空腺病毒上清液再次感染QBI-293A细胞进行病毒扩增,经过3次扩增,倍比稀释病毒上清并感染细胞,以感染细胞GFP阳性数目计算病毒滴度以及感染复数(MOI)。
1.3 重组表达HBx腺病毒在HepG2细胞中表达的Western blot检测 接种2孔(2.5×105个/孔)HepG2细胞于6孔板中,用含体积分数10%FBS的DMEM培养液37℃培养18 h,吸去细胞培养基,每孔加新鲜培养基500μL,并按MOI为20的标准加入重组腺病毒(表达HBx的腺病毒和空病毒对照),吸附1 h后,加入1.5 mL培养液继续培养,感染72 h后,荧光显微镜检测含绿色荧光的腺病毒是否感染HepG2。收集细胞,冰上裂解30min,进行SDSPAGE电泳,然后电转移至PVDF膜上,转移后的膜于封闭液中封闭,先后与前期制备的抗-HBx多克隆抗体(按1∶2 000稀释)和HRP标记的山羊抗兔IgG(按1∶10 000稀释)共孵育,洗膜后,加入化学发光剂ECL,在暗室中曝光,显影,定影,在胶片上获得相应的条带,分析结果。
2 结果
2.1 重组表达HBx的腺病毒构建结果
2.1.1 穿梭载体pAdTrack-HBx的构建 HBx扩增产物电泳结果如图1A所示,回收PCR产物连接入pMD18-T载体中,鉴定连接成功后,进行序列测定,结果与GenBank序列完全一致。HBx片段连接入pAdTrack载体中应用BamHⅠ酶切鉴定结果如图1B,切开大小与理论一致,证明HBx被正确连接入pAdTrack载体中,命名为pAdTrack-HBx。
2.1.2 pAdTrack-HBx与pAdEasy的同源重组 穿梭载体pAdTrack-HBx与腺病毒骨架质粒pAdEasy-1在BJ5183感受态细菌中同源重组后的质粒用PacⅠ酶切鉴定结果如图1C,切下4.5 kb大小的条带。符合腺病毒说明书穿梭质粒与骨架载体重组后的酶切特征,说明含HBx基因的腺病毒载体pAd-HBx重组成功。
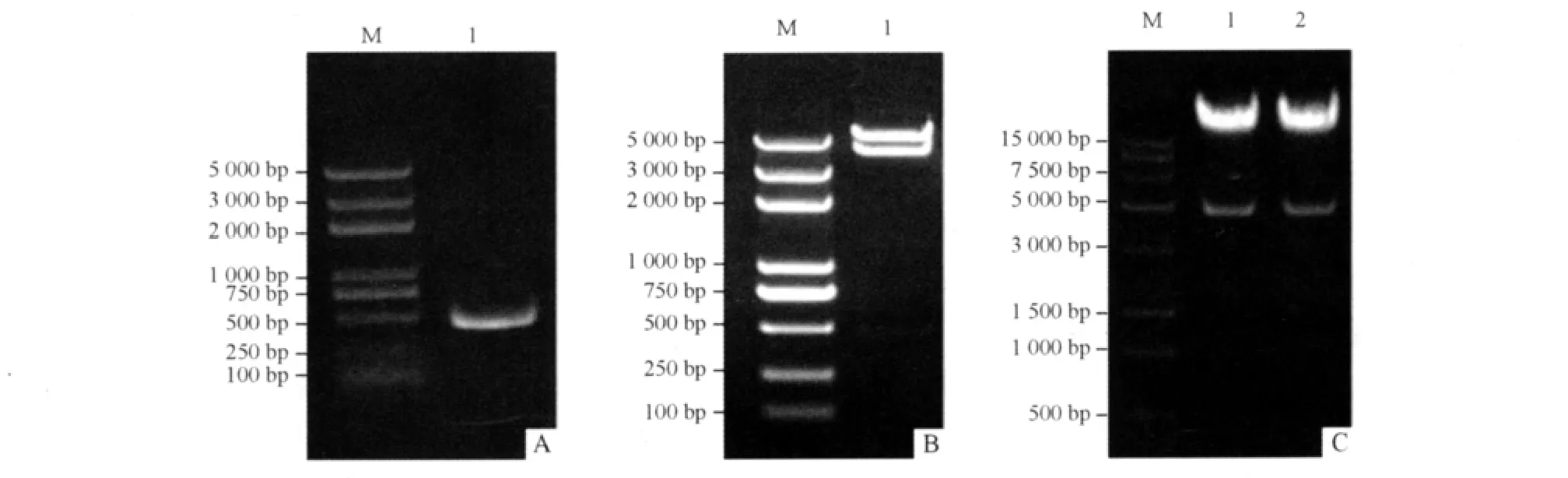
图1 重组表达HBx腺病毒的构建
2.1.3 重组腺病毒在QBI-293A细胞内的包装、扩增和鉴定 将经PacⅠ酶切线性化的重组腺病毒质粒pAd-HBx转染到QBI-293A细胞后第8天后,检测到绿色荧光充满视野中的绝大多数细胞,提示病毒已经包装成功。以未感染以及感染空腺病毒感染QBI-293A细胞为对照,RT-PCR结果为HBx重组腺病毒细胞组扩增出HBx基因,而对照的未感染细胞以及空腺病毒感染细胞未扩增出HBx基因(图2)。
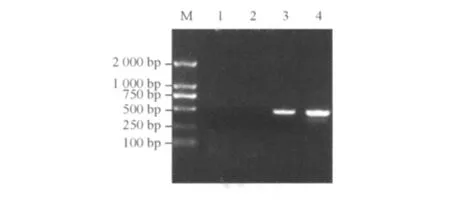
图2 RT-PCR结果
2.2 HBx重组腺病毒在HepG2中的表达 将扩增的HBx重组腺病毒和对照空腺病毒感染HepG2细胞72 h后荧光显微镜观测细胞中GFP的表达,结果可见视野中细胞GFP的表达,说明HepG2细胞被腺病毒成功感染。Western blot方法检测感染病毒后的2组细胞HBx蛋白的表达,发现空载体感染细胞组不表达HBx蛋白,而HBx重组腺病毒感染细胞组表达HBx蛋白(图3)。
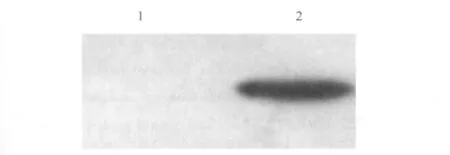
图3 HepG2细胞感染后HBx表达的Western blot检测
3 讨论
原发性肝癌是我国常见的恶性肿瘤之一,占癌症死亡率第二位。乙肝病毒感染是引起肝癌的主要原因之一。乙肝病毒编码的x蛋白是一种反式作用因子,它通过增强各种转录和调控因子的表达影响肝细胞的增殖和凋亡,在原发性肝癌的发生发展中发挥重要的作用[7]。
该研究在前期实验中发现了多种可能受到HBx调控表达的基因,为了从多方面验证HBx的过表达调节靶基因的通路,拟建立HBx的多种高表达细胞系,为此构建了pCDNA3.1-HBx载体,然而瞬时转染细胞的效率不高,不能产生均一、高效表达HBx的细胞系。如果使用稳定转染的方法,则存在建立周期长,整合位点不确定,表达效率不均一等缺点。考虑到腺病毒具有感染效率高,宿主广泛,容易制备表达,不整合入染色体,表达效率高等优点,作者构建了HBx重组腺病毒载体,并将构建的病毒载体转染后,成功组装成表达HBx的腺病毒,使用制备的病毒感染肝细胞HepG2,荧光检测可见细胞全部受到感染,而普通的质粒瞬时转染HepG2效率仅能达到10%~30%。通过Western blot检测病毒感染后的细胞裂解液,证明HBx在HepG2得以高效表达,说明作者制备的重组腺病毒可以在HepG2细胞中高效均一地表达HBx蛋白。
总之,该实验成功构建了HBx腺病毒载体,包装得到表达HBx蛋白的腺病毒,制备的腺病毒可以高效感染HepG2细胞,高效表达HBx,为后续HBx功能的深入研究奠定了基础。
[1] Hong A,Han DD,Wright CJ,et al.The interaction between hepatitis B virus X protein and AIB1 oncogene is required for the activation of NFκB signal transduction[J].Biochem Biophys Res Commun,2012 May 22[Epub ahead of print]
[2] Martin-Vilchez S,Lara-Pezzi E,Trapero-Marugán M,et al.The molecular and pathophysiological implications of hepatitis B X antigen in chronic hepatitis B virus infection[J].Rev Med Virol,2011 Jul 14.doi:10.1002/rmv.699[Epub ahead of print]
[3]卢宏柱,周建华.乙型肝炎病毒X蛋白通过激活细胞外蛋白调节激酶转导机制上调大鼠系膜细胞肿瘤坏死因子-α的表达[J].实用儿科临床杂志,2009,24(10):738
[4] Srisuttee R,Koh SS,Kim SJ,et al.Hepatitis B virus X(HBX)protein upregulates β-catenin in a human hepatic cell line by sequestering SIRT1 deacetylase[J].Oncol Rep,2012,28(1):276
[5]刘凯歌,高红艳,赵慧,等.HBx和VEGF与乙肝相关性肝癌组织血管生成及转移的关系[J].吉林大学学报:医学版,2010,36(2):372
[6]范晶,梁梓,伏秦超,等.一种经济、简便和准确鉴定重组质粒的方法[J].生物技术,2010,20(3):54
[7] Benhenda S,Cougot D,Buendia MA,et al.Hepatitis B virus X protein molecular functions and its role in virus life cycle and pathogenesis[J].Adv Cancer Res,2009,103:75
(2011-10-16收稿 责任编辑赵秋民)
Construction and expression of recombinant HBx-expressed adenovirus and HBx expression in HepG2
ZHANG Hongfei1,2),LI Junfeng2),HU Yi2),ZHANG Huina1),BAO Chunyang2),WANG Kaijuan1),ZHOU Yusen2)
1)Department of Epidemiology,College of Public Health,Zhengzhou University,Zhengzhou 450001 2)State Key Laboratory of Pathogen and Biosecurity,Institute of Microbiology and Epidemiology,Academy of
adenovirus vector;HBx gene;hepatoma cell
Aim:To construct recombinant HBx-expressed adenovirus,and establish a cell culture model with highlevel HBx expression by infection.Methods:HBx gene was cloned into the shuttle vector pAdTrack.After confirmed by restriction digestion,the resultant plasmid was linearized by digestion with PmeⅠ and was subsequently transformed into competent E.coli cells BJ5183 for homologous recombination.The recombination vector pAd-HBx was linearized with PacⅠ and transfected into QBI-293A cells.The packing of adenovirus was determined by the expression of EGFP.The expression of HBx gene in recombinant adenovirus was identified by RT-PCR.Viral titer and infection efficiency of adenovirus were detected according to the expression of GFP.HepG2 cells were infected by recombinant adenovirus.Forty-eight hours later,cells were collected and lysed to detect the expression of HBx protein by Western blot.Results:Restriction digestion showed that the recombinant adenovirus vector pAd-HBx was successfully constructed.After pAd-HBx transfected into QBI-293A cells,fluorescence detection indicated that the adenovirus was successfully packed.The expression of HBx gene was detected by RT-PCR.After infection to the hepatoma HepG2 cells,the expression of HBx protein was detected by Western blot.Conclusion:The recombinant adenovirus expressing HBx gene has been successfully constructed.After infecting HepG2 cell,the HBx protein expression is detected,suggesting cell culture model with high-level expression of HBx is established.
R575.1
10.3969/j.issn.1671-6825.2012.04.008
*国家自然科学基金青年科学基金资助项目 30900753
