壳寡糖螯合铬对糖尿病小鼠降血糖作用的研究
2012-09-15曲婉秋唐晓琳王秀武
曲婉秋,唐晓琳,王秀武
辽宁师范大学生命科学学院,大连 116029
壳寡糖螯合铬对糖尿病小鼠降血糖作用的研究
曲婉秋,唐晓琳,王秀武*
辽宁师范大学生命科学学院,大连 116029
探讨壳寡糖螯合铬(Cos-Cr)的降血糖作用。选择发育相近的健康雄性小鼠10只为正常对照组,糖尿病小鼠30只随机分为糖尿病对照组、壳寡糖组(Cos)和螯合铬组(Cos-Cr),每组各10只,实验期4 w,测定小鼠血糖值。壳寡糖螯合铬可以降低糖尿病小鼠血糖,增加体重,增加脾脏指数,明显缓解糖尿病小鼠饥饿和烦渴的症状。肝脏损伤明显减轻。同时观察肝组织病理变化。壳寡糖螯合铬对糖尿病小鼠有降糖,改善糖尿病症状的作用。
壳寡糖螯合铬;四氧嘧啶;糖尿病;血糖;肝脏;脾脏
铬(chromium)是人和动物体中脂类、蛋白质和碳水化合物正常代谢所必须的微量元素之一[1]。补铬对治疗包括I型糖尿病、II型糖尿病、妊娠糖尿病和类固醇引起的糖尿病都有效[2-7]。美国医学家Mertz和Schwarz早在1957年就发现并证实Gr3+是葡萄糖耐受因子(GTF)中的活性因子。无机铬的吸收率很低为0.4%~3%[8],而有机铬的吸收率可达10% ~25%[9]。壳寡糖是壳聚糖的降解产物,大量研究发现它具有免疫调节[10]、抗肿瘤[11]及降血糖[12]等功能。目前,国内外对壳寡糖用于糖尿病治疗[13-18]的相关研究不断增多。有研究对分子量为1200 Da的壳寡糖及其铬配合物[19]进行了研究,本实验首次以分子量为1000 Da的六碳壳寡糖和无机铬(CrCl3)为原料螯合制备成易于吸收的有机铬形式,目的在于产生协同作用,提高降糖活性,并进一步探讨了其对糖尿病小鼠的降糖作用。壳寡糖螯合铬可用于开发新型的保健食品、医药,具有广阔的应用和开发前景。
1 材料与方法
1.1 材料
1.1.1 壳寡糖螯合铬
选择平均分子量为1000 Da,脱乙酰度>90%的壳寡糖(大连化物所1805室)和三氯化铬为原料,按本研究室的方法制备成壳寡糖螯合铬。
1.1.2 试验动物
昆明种小鼠,雄性,体重为20±2 g,购自大连医科大学实验动物中心。
1.1.3 试剂和仪器
四氧嘧啶、苦味酸,购自Sigma公司;其余试剂均为国产分析纯试剂;血糖仪,德国罗氏公司。
1.2 方法
1.2.1 壳寡糖螯合铬的制备
称取壳寡糖和氯化铬用蒸馏水溶解配制成壳寡糖3%溶液,氯化铬1%溶液,静止20 min,将两种液体等体积混合,用氢氧化钠调节pH值为9,静止20 min,加入3倍体积的无水乙醇,经40 min的螯合后,抽滤,并用蒸馏水冲洗沉淀物1-5次,除去残留的滤液,将沉淀物置于70℃的烘箱中5~6 h除去水分后得到墨绿色粉末状固体即为壳寡糖螯合铬。
1.2.2 四氧嘧啶糖尿病小鼠模型建立
选择体重相近(20±2 g),昆明种雄性小鼠75只,自由采食基础日粮1 w,随机选取10只为正常对照组,其余小鼠禁食16 h后,用生理盐水配制1%四氧嘧啶按100 mg/kg·bw进行腹腔注射,正常对照组注射等剂量的生理盐水,1 h后恢复正常采食和饮水。次日,用同样方法二次建模。3 d后断尾取血,测量血糖值,血糖值在13.8 mmol/L以上,认为是造模成功。
1.2.3 实验设计及实验过程
将合格实验动物分为正常对照组、糖尿病对照组、壳寡糖组和螯合铬组,每组各10只,共计40只。实验期4 w。正常对照组和糖尿病对照组饲喂基础日粮,壳寡糖组和螯合铬组是在基础日粮中分别添加壳寡糖和壳寡糖螯合铬0.7 g/kg。每日上午9时测定各组小鼠的摄食量和饮水量,每周测定一次小鼠的体重,同时尾部采血,测量血糖值。
实验4 w结束时,将各组小鼠脱臼处死,立即分离肝脏和脾脏,并用生理盐水清洗,擦干后脾脏称重并计算脾指数,肝脏拍照,用Bouin液固定肝脏进行H.E.染色,作病理组织学光镜检查。
1.2.4 数据处理
2 结果与分析
2.1 壳寡糖螯合铬对糖尿病小鼠体重的影响
实验开始时,各组小鼠的体重差异不明显。实验期间,糖尿病组小鼠随实验时间的延长体重逐渐下降(P<0.05)。壳寡糖组和螯合铬组小鼠体重试验期各周均比糖尿病组增加,而螯合铬组的小鼠体重随实验时间的延长体重增加显著(P<0.05)。结果如表1所示。
表1 壳寡糖螯合铬对糖尿病小鼠体重的影响(g,±s)Table 1 Effect of chitooligosaccharide-chromium(Ⅲ)complex on body weight of diabetic mice(g,±s)
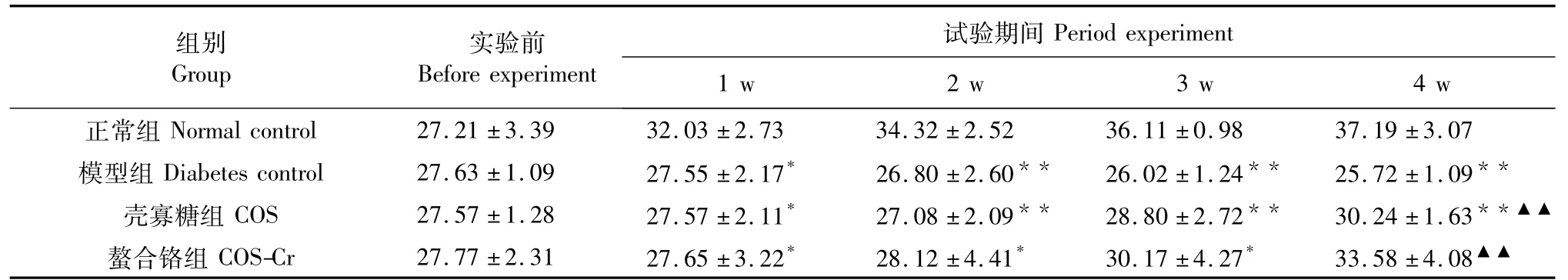
表1 壳寡糖螯合铬对糖尿病小鼠体重的影响(g,±s)Table 1 Effect of chitooligosaccharide-chromium(Ⅲ)complex on body weight of diabetic mice(g,±s)
注:n=10;与正常组比较,*P<0.05;**P<0.01。与模型组比较,▲▲P<0.01。下同。Note:n=10;Compare with normal control,*P<0.05;**P<0.01.Compare with diabetes control,▲▲P<0.01.The same below.
组别Group实验前Before experiment试验期间Period experiment 1 w 2 w 3 w 4 w正常组Normal control 27.21±3.39 32.03±2.73 34.32±2.52 36.11±0.98 37.19±3.07模型组 Diabetes control 27.63±1.09 27.55±2.17*26.80±2.60**26.02±1.24**25.72±1.09**壳寡糖组COS 27.57±1.28 27.57±2.11*27.08±2.09**28.80±2.72**30.24±1.63**▲▲螯合铬组COS-Cr 27.77±2.31 27.65±3.22*28.12±4.41*30.17±4.27*33.58±4.08▲▲
2.2 壳寡糖螯合铬对小鼠摄食量、饮水量的影响
实验开始时,各组小鼠的摄食量、饮水量差异不明显。实验开始后糖尿病组小鼠摄食量、饮水量不断增加,壳寡糖组和螯合铬组随实验时间的延长小鼠采食量、饮水量逐渐下降,自实验开始后第3 w螯合铬组小鼠采食量显著减少(P<0.05),饮水量也显著较少(P<0.05),螯合铬组比壳寡糖组的饮水量减少趋势明显。结果如表2~3所示。
表2 壳寡糖螯合铬对糖尿病小鼠摄食量的影响(g/d,±s)Table 2 Effect of chitooligosaccharide-chromium(Ⅲ)complex on the content of food intake of diabetic mice(g/d,±s))
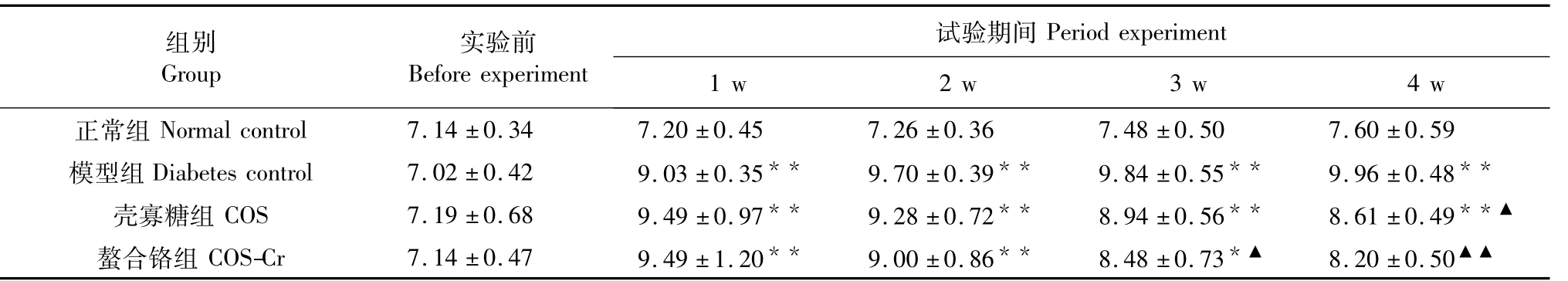
表2 壳寡糖螯合铬对糖尿病小鼠摄食量的影响(g/d,±s)Table 2 Effect of chitooligosaccharide-chromium(Ⅲ)complex on the content of food intake of diabetic mice(g/d,±s))
注:与模型组比较,▲P<0.05。下同。Note:Compare with diabetes control,▲P<0.05.The same below.
组别Group实验前Before experiment试验期间Period experiment 1 w 2 w 3 w 4 w正常组Normal control 7.14±0.34 7.20±0.45 7.26±0.36 7.48±0.50 7.60±0.59模型组Diabetes control 7.02±0.42 9.03±0.35**9.70±0.39**9.84±0.55**9.96±0.48**壳寡糖组COS 7.19±0.68 9.49±0.97**9.28±0.72**8.94±0.56**8.61±0.49**▲螯合铬组COS-Cr 7.14±0.47 9.49±1.20**9.00±0.86**8.48±0.73*▲8.20±0.50▲▲
表3 壳寡糖螯合铬对糖尿病小鼠饮水量的影响(mL/d,±s)Table 3 Effect of chitooligosaccharide-chromium(Ⅲ)complex on the content of water intake of diabetic mice(mL/d,±s)
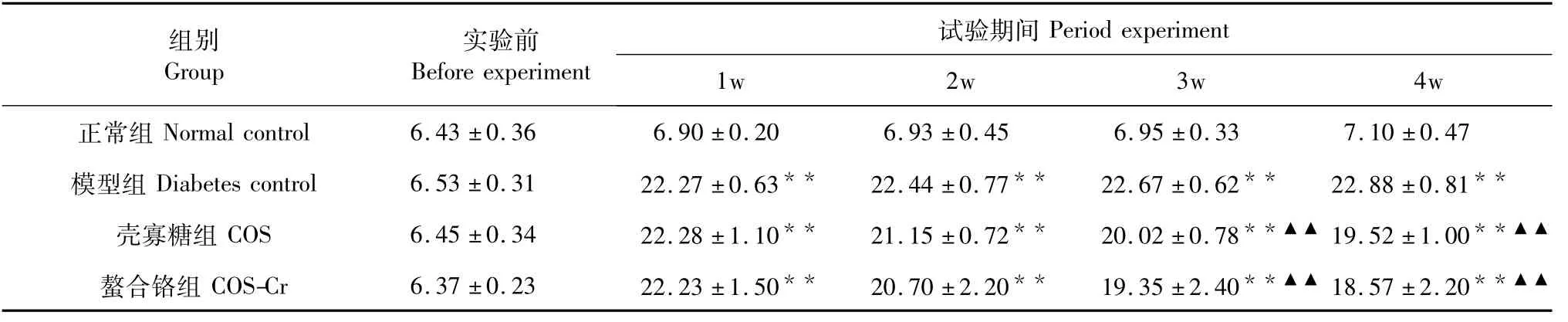
表3 壳寡糖螯合铬对糖尿病小鼠饮水量的影响(mL/d,±s)Table 3 Effect of chitooligosaccharide-chromium(Ⅲ)complex on the content of water intake of diabetic mice(mL/d,±s)
组别Group实验前Before experiment试验期间Period experiment 1w 2w 3w 4w正常组Normal control 6.43±0.36 6.90±0.20 6.93±0.45 6.95±0.33 7.10±0.47模型组 Diabetes control 6.53±0.31 22.27±0.63**22.44±0.77**22.67±0.62**22.88±0.81**壳寡糖组COS 6.45±0.34 22.28±1.10**21.15±0.72**20.02±0.78**▲▲19.52±1.00**▲▲螯合铬组COS-Cr 6.37±0.23 22.23±1.50**20.70±2.20**19.35±2.40**▲▲18.57±2.20**▲▲
2.3 壳寡糖螯合铬对糖尿病小鼠血糖的影响
实验开始时,各组小鼠空腹血糖值差异不显著。实验期间,糖尿病组小鼠空腹血糖一直维持在较高水平,而壳寡糖组和螯合铬组的小鼠血糖水平在不断下降,其中实验第2 w(P<0.05)和第4 w(P< 0.01)下降显著,而螯合铬组下降极显著。实验4 w同1 w相比,壳寡糖组血糖平均值下降了1.99 mmoL/L,螯合铬组血糖平均值下降了2.76 mmoL/ L。表明壳寡糖螯合铬具有明显降低糖尿病小鼠空腹血糖值的作用。结果如表4所示。
表4 壳寡糖螯合铬对糖尿病小鼠血糖的影响(mmol/L·d,±s)Table 4 Effect of chitooligosaccharide-chromium(Ⅲ)complex on the content of blood glucose of diabetic mice(mmol/L·d,±s)
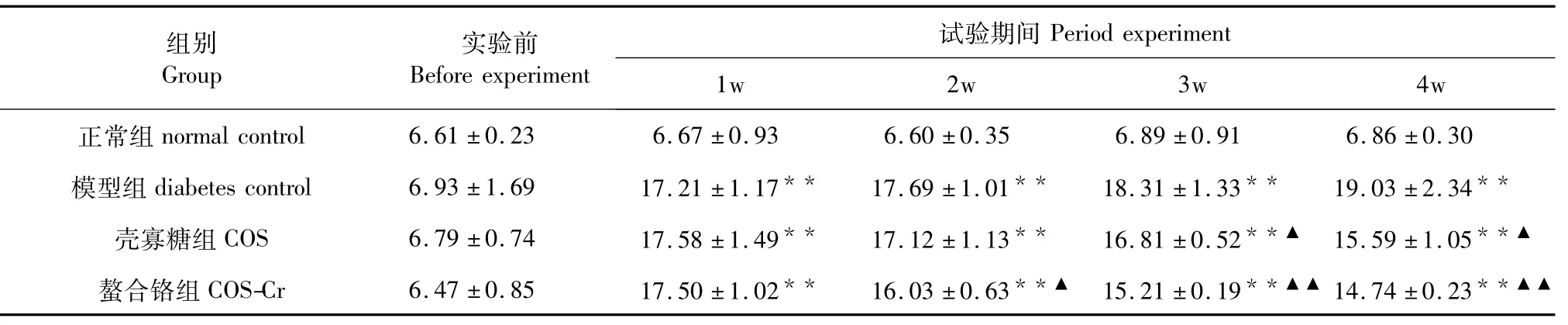
表4 壳寡糖螯合铬对糖尿病小鼠血糖的影响(mmol/L·d,±s)Table 4 Effect of chitooligosaccharide-chromium(Ⅲ)complex on the content of blood glucose of diabetic mice(mmol/L·d,±s)
组别Group实验前Before experiment试验期间Period experiment 1w 2w 3w 4w正常组normal control 6.61±0.23 6.67±0.93 6.60±0.35 6.89±0.91 6.86±0.30模型组diabetes control 6.93±1.69 17.21±1.17**17.69±1.01**18.31±1.33**19.03±2.34**壳寡糖组COS 6.79±0.74 17.58±1.49**17.12±1.13**16.81±0.52**▲15.59±1.05**▲螯合铬组COS-Cr 6.47±0.85 17.50±1.02**16.03±0.63**▲15.21±0.19**▲▲14.74±0.23**▲▲
2.4 壳寡糖螯合铬对糖尿病小鼠脾指数的影响
与正常对照组相比,壳寡糖组和螯合组的脾脏指数都下降了,说明脾脏明显萎缩,特异性免疫功能显著下降。与糖尿病组相比,壳寡糖组和螯合铬组的脾脏指数都上升了,而螯合铬组上升的更多,表明经饲喂壳寡糖和壳寡糖螯合铬的小鼠,脾指数明显提高。结果如表5所示。
表5 壳寡糖螯合铬对糖尿病小鼠脾指数的影响(±s)Table 5 Effect of chitooligosaccharide-chromium(Ⅲ)complex on spleen index of diabetic mice(±s)

表5 壳寡糖螯合铬对糖尿病小鼠脾指数的影响(±s)Table 5 Effect of chitooligosaccharide-chromium(Ⅲ)complex on spleen index of diabetic mice(±s)
组别Group脾脏质量(mg) Spleen weight(mg)脾指数(g/mg) Spleen index(g/mg)正常组normal control 141.28±10.57 4.01±0.23模型组diabetes control 76.60±7.65 2.66±0.17**壳寡糖组COS 120.70±12.77 3.53±0.45▲螯合铬组COS-Cr 129.80±12.30 3.99±0.20▲▲
2.5 壳寡糖螯合铬对糖尿病小鼠肝脏损伤的修复
取各组小鼠的肝脏进行观察,正常对照组小鼠肝脏(A),表面平整光滑,肝叶清晰,颜色正常,质地柔软。糖尿病组小鼠肝脏(B),叶片严重粘连,不清晰,肝脏萎缩,重量减轻,质地变硬。壳寡糖组小鼠肝脏(C)与糖尿病组小鼠相比肝小叶粘连情况好转,但是与壳寡糖螯合铬组(D)相比,粘连情况严重些。壳寡糖螯合铬组小鼠虽也有呈球状样变的趋势,但与糖尿病组相比,肝小叶粘连状况明显好转。结果如图1所示。

图1 壳寡糖螯合铬对糖尿病小鼠肝脏损伤的修复Fig.1 hepatic tissue after alloxan treatment and with the COS and Cos-Cr
2.6 组织病理学检查
正常组(A)肝细胞索排列整齐,细胞形态正常。模型组(B)中央静脉周围肝细胞皱缩变形,部分坏死,炎细胞侵润。壳寡糖组(C)和螯合铬组(D)也有一定的炎细胞侵润和肝细胞变形,与模型组(B)相比炎细胞侵润数量减少,肝细胞变形也减少。但螯合铬组(D)要比壳寡糖组(C)修复效果更佳。

图2 实验各组小鼠肝脏组织切片结果Fig.2 The tissue pathologic sections of any groups of mice liver(400×)
3 讨论
四氧嘧啶可以破坏胰岛β细胞从而使动物患糖尿病[20]。本实验中注射饲养嘧啶小鼠血糖值大于13.8 mmol/L,说明造模成功。肝脏是胰岛素作用的主要靶器官,胰岛素特异性受体大量存在于肝细胞膜上,糖尿病病理过程中由氧化应激产生的大量自由基损伤肝脏细胞膜,从而使肝细胞膜胰岛素受体减少,敏感性降低,对血糖利用率下降[21]。本实验发现四氧嘧啶也可造成小鼠肝脏损伤,推测是四氧嘧啶在体内产生大量自由基导致肝脏损伤。同时表明壳寡糖螯合铬能够有效的抑制四氧嘧啶引发小鼠肝脏自由基升高。壳寡糖降低血糖作用可能与其能作用于胰岛素受体,使胰岛素受体敏感性增强,从而控制血糖升高有关[22]。铬作为糖尿病耐量因子(GTF)的主要成分参与体内糖脂代谢,并可通过硫氢键使胰岛素结合到膜受体上,从而增加胰岛素效应,并影响胰岛素依赖系统,抑制胰岛素酶[23]。本实验表明壳寡糖螯合铬能够显著降低糖尿病小鼠的血糖值,推测可能是壳寡糖和氯化铬的协同作用增强了降糖效果,并能有效地改善糖尿病小鼠“三多一少”的症状,使体重增加,同时使增加脾指数,肝脏损伤明显减轻,具有广阔的应用前景。
1 Anderson RA.Chromium as an essential nutrient for humans.Regul Toxicol Pharmacol,1997,26:35-41.
2 Shindea UA,Sharma G,Xu YJ.Insulin sensitisingaction of chromium picolinate in various experimental models of diabetes mellitus.J Trace Elem Med Biol,2004,18:23-32.
3 Vladeva SV,Terzieva DD,Arabadji DT.Effect of chromium on the insulin resistance in patientswith type II diabetes mellitus.Folia Med(Plovdiv),2005,47(3/4):59-62.
4 Jovanovic L,Guitierrez M,Peteoson CM.Chromium supplementation for women with gestational diabetes mellitus.J Trace Elem Exp Med,1999,12(2):91-97.
5 Ravian A,Slezak L,Rubla A,et al.Clinical use of the traceelement chromium(Ⅲ)in the treatment of diabetes mellitus.J Trace Elem Exp Med,1995,8:183-190.
6 Liu AJ(刘安军),Wang XL(王秀丽),Chen Y(陈影),et al.Protective effects collagen Peptide-Chromium(Ⅲ)complex on alloxan-induced diabetes in mice.J Tianjin Univ Sci Technol(天津科技大学学报),2006,21(2):1-3.
7 Zhang RJ(张瑞敬),Hu BY(胡炳炎),He Q(何强),et al.The chromium on the content of serum minor element deficiencies with respect to diabetic relations.Studies Trace Elem Health(微量元素与健康研究),2002,19:26-28.
8 Yang ZR(杨祖荣).Ultrasound technology in natural substances from the application of effective ingredient.J Yunnan Coll Tradit Chin Med(云南中医学院学报),2003,9:29-31.
9 Wang ZM(王铮敏).Applications of ultrasonic extraction in effective constitution of plants.J Sanming Coll(三明高等专科学校学报),2002,12(19):45-51.
10 Dou JL(窦江丽),Tan CY(谭成玉).Effects of oligochitosan on the immunoregulation in mice.Chin J Mar Drugs(中国海洋药物杂志),2005,5:33-35.
11 Jeon YJ,Kim SK.Antitumor activity of chitosan oligosaccharides produced in an ultra filtration membrane reactor system.J Microbio Biotech,2002,12:503-507.
12 Ormrod DJ,Holmes CC,Miller TEet al.Dietary chitosan inhibits hypereholesterolaemia and atherogenesis in the apolipoprotein E-deficient mouse model ofatheroselerosis.Atherosclerosis,1998,138:329-334.
13 Shen J(申杰),Ye XY(叶希韵),Shen J(沈菊),et al.Studies on the effect of chito oligosaccharide on reducing cipid and protecting liver of chito oligosaccharide in hyperlipidemia mice.J Northwest Agric Forest Univ(西北农林科技大学学报),2007,35(9):35-38.
14 Jin LM(金黎明),Yang Y(杨艳),Liu WS(刘万顺),et al.Antioxidant and hepatoprotective activities of chitosan oligosaccharide.J Shenyang Pharm Univ(沈阳药科大学学报),2008,25:309-311.
15 Wang X(王鑫),Lin Q(林强),Tian PF(田平芳),et al. Symptom and mechanism of low molecular chitooligosaccharides inⅡ type diabetic rats.Food Sci(食品科学).2007,28:529-532.
16 Hu ZP(胡志鹏).Research advances in chitooligosaccharides.Chin J Biochem Pharm(中国生化药物杂志).2003,24:210-212.
17 Lee HW,Park YS,Choij W,et al.Antidiabetic effects of chitosan oligosaccharides in neonatal atreptozotocin-induced oninsulin-dependent diabetes mellitus in rata.Biol Pharm Bull,2003,26:1100-1114.
18 Liang SL.Chromium(Ⅲ)-chitosan complexes and production method there of.CN1379043.2004-02-10.
19 Liu B(刘冰),Qin ZK(秦贞奎),Lin XM(林祥梅),et al.Promotion effect of chitooligosaccharides and its derivatives on pancreatic islet cells proliferation and insulin secretion.J Clinic Rehabilit Tissue Eng Res(中国组织工程研究与临床康复),2009,13:513-516.
20 Xu SY(徐淑云),Bian RL(卞如濂),Chen X(陈修).Pharmacology the methodology(药理实验方法学).Beijing:People’s Medical Publishing House,1994.65-1286.
21 Aoki TT,Benbafka MM,Dkimura MC,et al.Long-term intermittent intravenous insulin therapy and type 1 diabetes mellitus.Lancet,1993,342:515-519.
22 Li BF(李八方),Chen GD(陈桂东),Mao WJ(毛文君),et al.The comparative studies on dietary fibres in diabetic rats.Acta Natr Sin(营养学报),1999,21:59-63.
23 Zhang YJ(张娅婕),Chen QL(陈秋丽),Gan ZW(甘振威),et al.Glucose-lowering effect of CrCl3on experimental diabetic mice.J Jilin Univ(吉林大学学报),2004,30:379-380.
Hypoglycemic Effects of Chitooligosaccharide-chromium(Ⅲ) Complex on Diabetic Mice
QU Wan-qiu,TANG Xiao-lin,WANG Xiu-wu*
College of Life Sciences,Liaoning Normal University,Dalian 116029,China
To study the effects of chitooligosaccharide-chromium(Ⅲ)complex(Cos-Cr)on diabetic mice.Selecting ten male mice as the normal control group.Thirty diabetes mice were randomly divided into 3 groups,diabetes control group (n=10),Cos group(n=10),Cos-Cr group(n=10).The mice were dissected after 4 weeks,determinations of serum glucose concentration.Cos-Cr can significantly decrease fasting blood glucose level,increase body weight as well as index spleen.Symptoms of hunger and thirsty were improved obviously in diabetic mice.Cos-Cr has protective effects on alloxan-induced hepatic injury in mice.Hepatocytes lesion was alleviated markedly.Cos-Cr can decrease blood glucose concentration and improve diabetic symptoms in mice.
chitooligosaccharide-chromium(Ⅲ);alloxan;diabetic;blood glucose;liver;spleen
R151.2
A
1001-6880(2012)05-0605-05
2011-10-12 接受日期:2011-12-23
*通讯作者 E-mail:quwanqiu@163.com
