改性多金属氧簇应用于环己醇选择性催化氧化制取环己酮
2012-09-14冯世宏闫绍峰刘自力
冯世宏,闫绍峰,刘自力
(1.辽宁工业大学 化学与环境工程学院,辽宁 锦州121004;2.广州大学 化学化工学院,广东 广州510006)
改性多金属氧簇应用于环己醇选择性催化氧化制取环己酮
冯世宏1,闫绍峰1,刘自力2
(1.辽宁工业大学 化学与环境工程学院,辽宁 锦州121004;2.广州大学 化学化工学院,广东 广州510006)
以柠檬酸为络合剂,采用溶胶-凝胶法制备了多金属氧簇K9[Sb1.0W9O33],再用十六烷基三甲基溴化铵(CTAB)对其改性,得到改性多金属氧簇(CTAB)9[Sb1.0W9O33];以过氧化氢氧化环己醇制取环己酮为探针反应,考察了制备催化剂的原料配比n(Sb)/n(W)以及n(H2O2)/n(Cyclohexanol)、n((CTAB)9[Sb1.0W9O33])/n(Cyclohexanol+H2O2)、反应温度、反应时间等反应条件对氧化反应的影响。结果表明,当n(Sb)/n(W)=0.11时制得的(CTAB)9[Sb1.0W9O33]催化剂活性最高;氧化反应的适宜条件为、n(H2O2)/n(Cyclohexanol)=1.5、n((CTAB)9[Sb1.0W9O33])/n(Cyclohexanol+H2O2)=0.0012、反应温度353K、反应时间2.0h;在此条件下,环己醇转化率为97.4%,环己酮选择性为99.7%。催化剂经XRD表征,揭示了(CTAB)9[Sb1.0W9O33]的微观结构和内在规律性,掺入少量CTAB,[Sb1.0W9O33]9-保持原来的基本结构,[Sb1.0W9O33]9-与CTAB+之间存在协同效应,有效提高了环己酮的选择性。
改性多金属氧簇;环己醇;环己酮;催化氧化
烃类选择氧化反应非常重要,广泛应用于精细化工、高分子工业等领域。同时,选择氧化反应也是杂多酸的重要催化应用领域之一,特别是醇类催化氧化制备羰基化合物,在化工领域具有很高的研究价值,产品的附加值能够得到有效提升,具有较大的社会和经济效益[1]。环己酮作为尼龙的中间体、溶剂和化工原料,应用范围日益广泛,其新合成工艺一直备受国内外学者的关注[2-4]。环己醇是目前制备环己酮的主要原料,传统的环己酮制备方法有催化脱氢法和化学氧化法。催化脱氢法是在催化剂作用下,将环己醇脱氢生成环己酮,常用的催化剂有Cu/Zn、Cu/Zn/MgO[5]、ZnO/CaCO3等锌系催化剂[6]。化学氧化法常用的氧化剂有铬酸盐[7]、三氧化铬-吡啶络合物[8]、过氧化氢等[9]。催化脱氢法对催化剂的活性、稳定性要求很高,筛选难度大。尽管以铬酸盐、三氧化铬-吡啶络合物为氧化剂的化学氧化法的收率较高,但含铬废弃物无害化处理难度很大,极大限制了该工艺的发展[10]。近年来,随着绿色化学的发展,以过氧化氢为氧化剂,开发高效催化剂选择性氧化环己醇制备环己酮逐渐成为该领域的研究热点。
在本研究中,以柠檬酸为络合剂,采用溶胶-凝胶法制备了多金属氧簇K9[Sb1.0W9O33],然后用十六烷基三甲基溴化铵(CTAB)对其改性,得到了改性多金属氧簇(CTAB)9[Sb1.0W9O33]。以过氧化氢氧化环己醇制取环己酮为探针反应,考察了催化剂制备过程中原料配比(n(Sb)/n(W))以及n(H2O2)/n(Cyclohexanol)、n((CTAB)9[Sb1.0W9O33])/n(Cyclohexanol+H2O2)、反应温度、反应时间等对氧化反应的影响,得到了最佳反应条件,发现了一条环境友好、应用性强的环己酮生产工艺。
1 实验部分
1.1 主要试剂及仪器
仲钨酸铵,分析纯,广东台山化工厂产品;酒石酸锑钾,分析纯,天津市博迪化工有限公司产品;环己醇,分析纯,天津市北方天医化学试剂厂产品;柠檬酸,分析纯,江苏宜兴化工厂产品;CTAB,分析纯,天津市大茂化学试剂厂产品;过氧化氢,分析纯,天津市甲泰化学试剂有限公司产品。
日本理学公司Rigaku D/Max-2500V型X射线衍射仪;Bruker公司Bruker Tensor 207型红外光谱仪;德国莱茵公司Nabertherm程序式智能焙烧炉;大连自控设备厂GCF型反应釜。
1.2 催化剂的制备
按照化学计量比1/9分别称取酒石酸锑钾和仲钨酸铵。将酒石酸锑钾溶解于适量水中,备用。将仲钨酸铵加入70℃热水中,添加少量柠檬酸,待仲钨酸铵完全溶解后,在70℃恒温水浴中搅拌该溶液1h,然后滴加酒石酸锑钾溶液,液体颜色由无色变成淡黄色,最终变为棕褐色。滴加完毕后,继续恒温搅拌6h,得到一种湿凝胶。该湿凝胶在120℃下干燥10h,得到干凝胶,然后在680℃下恒温8h,柠檬酸完全分解,得到 K9[Sb1.0W9O33]。改变n(Sb)/n(W),重复上述实验,得到系列的锑钨杂多酸盐。将仲钨酸铵在500℃下焙烧8h,得到淡黄色WO3粉体,备用。
称取适量CTAB配成水溶液,在70℃、快速搅拌下,按照n(CTAB)/n(W)=1的配比加入K9[Sb1.0W9O33],恒温搅拌6h,发生离子交换反应,有白色沉淀生成。用大量去离子水反复洗涤沉淀,至KBr彻底清除(洗涤液用AgNO3溶液检测无沉淀生成),继续在120℃下干燥10h,得到(CTAB)9[Sb1.0W9O33]。取其他化学计量的锑钨杂多酸盐,重复上述实验,得到系列(CTAB)9[SbxW9O33]。
1.3 催化剂活性评价
在反应釜中依次加入1.0g(CTAB)9[Sb1.0W9O33]、10mL环己醇和质量分数30%的过氧化氢15mL。启动搅拌器,搅拌转速为1000r/min,将反应釜缓慢加热至353K,催化氧化反应2.0h,反应液自然冷却至室温。采用杭州世创科技有限公司GC9800型气相色谱仪分析反应液组成,FID检测器,聚乙二醇毛细管色谱柱(30m×0.25mm×0.25μm),气化室温度453K,柱温433K,检测器温度493K,进样量0.2μL。用修正面积归一化法计算环己醇转化率和环己酮选择性。
2 结果与讨论
2.1 多金属氧簇催化剂的XRD表征结果
氧化物及多金属氧簇催化剂的XRD谱见图1。根据Sb2O3的JCPDS 50534和WO3的JCPDS 71-0131,结合Sb2O3和 WO3的 XRD 谱[11],可以发现Sb2O3的特征衍射峰位于2θ为14.6°、19.6°、33.4°、45.7°处,对应的晶面分别为(222)、(400)、(440)、(622),呈方锑矿相结构[12]。WO3有三斜、单斜、斜方、四方等晶型。由图1(2)可见,WO3的特征衍射峰出现在2θ 为 23.1°、23.6°、24.5°、26.7°、28.9°、33.4°、33.9°、34.2°、35.6°、41.8°、50.0°、55.9°处,对应晶面 分别为(001)、(020)、(200)、(120)、(111)、(021)、(201)、(220)、(121)、(222)、(114)、(402),表明 WO3呈三斜晶型结构[13]。

图1 氧化物及多金属氧簇催化剂的XRD谱Fig.1 XRD patterns of metal oxides and polyoxometalate catalysts
(CTAB)9[Sb0.5W9Ox]和(CTAB)9[Sb1.0W9Oy]的XRD谱显示,主体催化剂是WO3结构,个别特征衍射峰的强度有些变化。随Sb3+掺入量的增加,主催化剂的结构和性质有一些变化,催化剂的颜色由淡黄色逐渐变为棕褐色,外观由粉体变为棒状,催化剂的晶型由单纯的三斜晶型转变为三斜、四方晶型混合型[14],少量Sb3+进入了 WO3的晶体内部,改变了部分 WO3的结构,这些细微变化与催化剂的高活性有一定关联。
(CTAB)9[Sb1.5W9Oy]的 XRD谱显示,尽管主体仍为 WO3结构[15-17],但出现了Sb2O3的(222)晶面,即有少部分Sb2O3生成,在2θ为28.4°、37.1°处产生了新的衍射峰,Sb原子含量偏高,直接影响了(CTAB)9[Sb1.5W9Oy]的结构和催化性能。因此,Sb3+的掺入量存在最佳值。
2.2 CTAB9[Sb1.0W9O33]的FT-IR分析
图2 为 CTAB、(CTAB)9[Sb1.0W9O33]、K9[Sb1.0W9O33]的FT-IR谱。CTAB的特征吸收峰位于2852、2921、3016cm-1;K9[Sb1.0W9O33]的特征吸收峰位于794cm-1,从图2可见,(CTAB)9[Sb1.0W9O33]的 FT-IR谱中明显存在CTAB和K9[Sb1.0W9O33]的特征吸收峰,由于 CTAB掺入量偏少,其特征吸收峰部分变弱,对[Sb1.0W9O33]9-的基本结构没有造成影响,[Sb1.0W9O33]9-的吸收峰明显变弱。

图2 CTAB、(CTAB)9[Sb1.0W9O33]、K9[Sb1.0W9O33]样品的FT-IR谱Fig.2 FTIR spectra of CTAB,(CTAB)9[Sb1.0W9O33]and K9[Sb1.0W9O33]samples
2.3 制备多金属氧簇催化剂原料配比对其催化环己醇选择性氧化反应的影响
在其他条件不变的前提下,改变原料配比n(W)/n(Sb),制得系列多金属氧簇催化剂,考察其在环己醇选择性氧化反应中的催化性能,结果示于图3。由图3可见,随n(Sb)/n(W)的增加,环己醇转化率增加,环己酮选择性先增加后减小,当n(Sb)/n(W)=0.11时,环己酮选择性达到最大值。活性评价结果表明,(CTAB)9[Sb1.0W9O33]催化剂的活性相对于WO3的活性增加了约1.6倍[7]。下面实验均采用(CTAB)9[Sb1.0W9O33]催化剂。
表面活性剂CTAB含有杂原子N,具有较强的配位能力和适度的碱性,可以有选择地和部分催化剂表面的L或B强酸性中心发生共价键或离子键作用,由于取代基位置和性质不同,空间位阻和电子效应不同,进而屏蔽部分强酸性中心,实现对氧化程度的控制,使反应过程中生成的环己酮及时离开催化剂表面[18],抑制羧酸、二氧化碳等副产物的生成,提高环己酮的选择性,因此CTAB+与[Sb1.0W9O33]9-之间存在协同效应。同时,(CTAB)9[Sb1.0W9O33]在水相和有机相中都具有较好的溶解性能,增加了反应物接触的几率,特别是表面活性剂部分,同时具有亲水和亲油基团,肩负着反应催化剂和深度氧化抑制剂双重作用,因此,选择性催化氧化的效果得到明显改善。
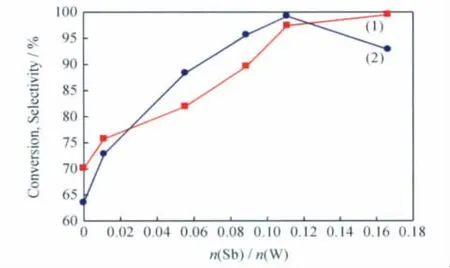
图3 制备多金属簇催化剂的n(Sb)/n(W)对其催化环己醇选择性氧化反应的影响Fig.3 Effects of n(Sb)/n(W)in catalyst preparation on cyclohexanol oxidation
2.4 反应条件对环己醇选择性氧化反应的影响
2.4.1 H2O2用量的影响
n(H2O2)/n(Cyclohexanol)对环己醇选择性氧化反应的影响见图4。由图4可知,当n(H2O2)/n(Cyclohexanol)<1.5时,随 H2O2用量的增加,环己醇转化率显著增大,同时环己酮选择性略有增加;当 n(H2O2)/n(Cyclohexanol)>1.5 时,随H2O2用量的增加,环己醇转化率和环己酮选择性都趋于稳定,且保持在一个较高的水平。综合考虑,选择n(H2O2)/n(Cyclohexanol)=1.5较适宜。
2.4.2 催化剂(CTAB)9[Sb1.0W9O33]用量的影响
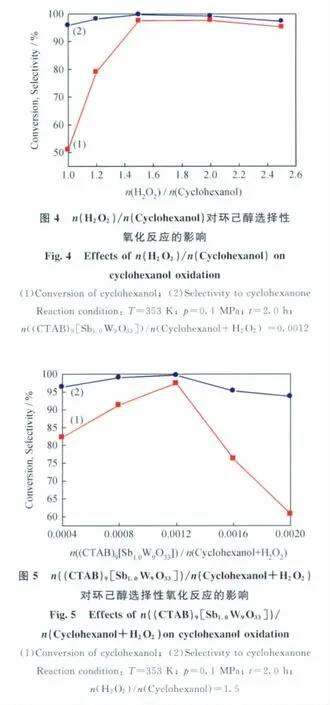
n((CTAB)9[Sb1.0W9O33])/n(Cyclohexanol+H2O2)对环己醇选择性氧化反应的影响示于图5。由图5可见,当 n((CTAB)9[Sb1.0W9O33])/n(Cyclohexanol+H2O2)<0.0012时,环己醇转化率和环己酮选择性都随(CTAB)9[Sb1.0W9O33]的增加而增加;当n((CTAB)9[Sb1.0W9O33])/n(Cyclohexanol+H2O2)=0.0012时,二者均达到最大值,分别为97.4%和99.7%;当n((CTAB)9[Sb1.0W9O33])/n(Cyclohexanol+H2O2)>0.0012时,环己醇转化率随(CTAB)9[Sb1.0W9O33]的增加显著降低,而环己酮选择性略有降低。过量的(CTAB)9[Sb1.0W9O33]容易加速 H2O2的分解,使氧化剂H2O2用量不足,导致环己醇转化率降低;催化剂量太多,活性中心增加,导致环己酮的深度氧化,副反应加剧,导致环己酮的收率降低。因此,选择n((CTAB)9[Sb1.0W9O33])/n(Cyclohexanol+H2O2)=0.0012较适宜。
2.4.3 反应温度的影响
反应温度对环己醇选择性氧化反应的影响示于图6。由图6可见,随反应温度的升高,环己醇转化率和环己酮选择性均呈现先增大后减小的趋势;当反应温度为353K时,二者均达到最大值。反应温度过高时,H2O2快速分解,直接降低了反应速率,同时反应温度升高,副反应加剧。因此,选择反应温度为353K较适宜。

图6 反应温度(T)对环己醇选择性氧化反应的影响Fig.6 Effects of reaction temperature(T)on cyclohexanol oxidation
2.4.4 反应时间的影响
反应时间对环己醇选择性氧化反应的影响示于图7。由图7可见,在反应初期,随反应时间的延长,环己醇转化率增大;当反应时间为2.0h,环己醇转化率达到最大值;反应2.0h后,环己醇转化率变化甚微。反应初期,随反应时间的延长,环己酮选择性增大;当反应时间为2.0h时,环己酮选择性达到最大值;之后继续延长反应时间,环己酮选择性略微降低,这是由少量环己酮深度氧化所致。因此,选择反应时间为2.0h较适宜。
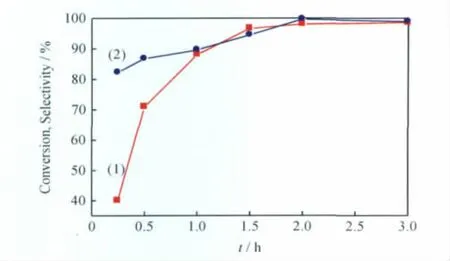
图7 反应时间(t)对环己醇选择性氧化反应的影响Fig.7 Effects of reaction time(t)on cyclohexanol oxidation
3 结 论
(1)采用溶胶-凝胶法制备了多金属氧簇K9[Sb1.0W9O33],用CTAB 对其改性,得到了改性多金属氧簇(CTAB)9[SbxW9O33],其中n(Sb)/n(W)=0.11的(CTAB)9[Sb1.0W9O33]催化剂活性最高。
(2)以(CTAB)9[Sb1.0W9O33]为催化剂,催化氧化环己醇制备环己酮的适宜反应条件为n(H2O2)/n(Cyclohexanol)=1.5、n((CTAB)9[Sb1.0W9O33])/n(Cyclohexanol+H2O2)=0.0012、T=353K、t=2.0h。在此条件下,环己醇转化率为97.4%,环己酮选择性为99.7%。
(3)通过 XRD、FTIR检测,揭示了(CTAB)9[Sb1.0W9O33]的微观结构和内在规律性。掺入少量CTAB,[Sb1.0W9O33]9-保持了原来的基本结构,[Sb1.0W9O33]9-与(CTAB)+之间存在协同效应,有效提高了环己酮的选择性。
[1]何建辉.催化氧化法合成环己酮技术研究进展[J].合成纤维工业,2007,30(6):43-46.(HE Jianhui.Research progress in cyclohexanone synthesis by catalytic oxidation[J].China Synthetic Fiber Industry,2007,30(6):43-46.)
[2]KALARAJ N K,DESHPANDE S S,INGLE R H.Immobilized molybdovanadophosphoric acids on SBA-15 for selective oxidation of alkenes[J].Studies in Surface Science and Catalysis,2005,156(1):769-778.
[3]詹瑛瑛,蔡国辉,肖益鸿.CexZr(1-x)O2固溶体储氧性能与结构的关系[J].光谱学与光谱分析,2007,27(14):657-659.(ZHAN Yingying, CAI Guohui, XIAO Yihong.The relationship between structure and oxygen storage capacity of CexZr(1-x)O2solid solution [J].Spectroscopy and Spectral Analysis,2007,27(14):657-659.)
[4]沈江,杜俊明,黄静静.Ag/ZrO2催化剂上的1,2-丙二醇选择性气相氧化反应[J].化学学报,2004,62(19):1956-1959.(SHEN Jiang, DU Junming,HUANG Jingjing.Gas-phase selective oxidation of 1,2-propylene glycol over Ag/ZrO2catalyst[J].Acta Chimica Sinica,2007,65(5):403-408)
[5]KISHIMOTO N,NAKAMURA I,NAGAMURA Y.A structural analysis of W-Sb mixed oxide catalyst:US,6458737B1[P].2002-06-14.
[6]秦玉楠.新型(不预硫化)Mo-Co/TiO2加氢转化催化剂的反应机理制备和性能评价[J].中国钼业,1998,22(1):25-26.(QIN Yunan.Reactive mechanism,preparation and property appraisal of the new-type Mo-Co/TiO2hydro-conversion catalyst(non-presulfurizing process)[J].China Molybdenum Industry,1998,22(1):25-26.)
[7]INGLE R H,RAJ N K K, MANIKANDAN P.[SbW9O33]-Based polyoxometalate combined with a phase transfer catalyst:A highly effective catalyst system for selective oxidation of alcohols with H2O2,and spectroscopic investigation[J].Journal of Molecular Catalysis A:Chemical,2007,262(1-2):52-58.
[8]HAO Suzhen,LIU Sidong,WANG Xiaohong.Study of the interaction of Na9[SbW9O33]·19.5H2O with bovine serum albumin:spectroscopic and voltammetric methods[J].Journal of Luminescence,2009,129(11):1320-1325.
[9]ZHANG Lancui,XUE Han,ZHU Zaiming.New estertin derivatives based on trivacant keggin-type[β-SbW9O33]9-cluster [J]. Inorganic Chemistry Communications,2010,13(5):609-612.
[10]谭钦文,尹光志,李斗.环己酮生产废水处理工程技术改造[J].水处理技术,2008,34(6):82-86.(TAN Qinwen,YIN Guangzhi,LI Dou.Modification of treatment of engineering technology for cyclohexanone processing wastewater [J].Technology of Water Treatment,2008,34(6):82-86.)
[11]秦川校.有机化合物的波谱解析[M].上海:华东科技大学出版社,2007:36-75.
[12]YU Jinpeng, HU Xiaohong,ZHAN Hui.Sb2O3-modified Li1.1CoO2phase as cathode material for lithium ion battery[J].Journal of Power Sources,2008,189(1):697-701.
[13]XIA Xin,JIN Ronghua, HE Yonggen.Surface properties and catalytic behaviors of WO3/SiO2in selective oxidation of cyclopentene to glutaraldehyde[J].Applications of Surface Science,2000,165(4):255-259.
[14]LIN Chengfang, WU Chunghsin.Degradation of 4-chlorophenol in TiO2,WO3,SnO2,TiO2/WO3and TiO2/SnO2systems[J].Journal of Hazardous Materials,2008,154(1-3):1033-1039.
[15]LIU Huijuan,HUANG Shengjun,ZHANG Ling.The preparation of Active WO3catalysts for metathesis between ethene and 2-butene under moist atmosphere[J].Catalysis Communications,2009,10(5):544-548.
[16]ASIM N,RADIMAN S,BINYARMO MA.Synthesis of WO3in nanoscale with the usage of sucrose ester microemulsion and CTAB micelle solution[J].Materials Letters,2007,61(13):2652-2657.
[17]杨丹红,赵文军,高 林.Al2O3固载Schiff碱锰配合物催化氧化环己烷反应[J].石油化工,2008,37(6):657-659.(YANG Danhong,ZHAO Wenjun,GAO Lin.Catalytic oxidation of cyclohexane with aluminasupported Schiff base manganese complexes [J].Petrochemical Technology,2008,37(6):657-659.)
[18]王峰.多相催化选择氧化甲苯合成芳香醛类化合物的研究[D].大连:中国科学院大连化学物理研究所,2005.
Selective Catalytic Oxidation of Cyclohexanol to Cyclohexanone Over Modified Polyoxomeatalate Catalysts
FENG Shihong1,YAN Shaofeng1,LIU Zili2
(1.College of Chemistry & Environmental Engineering,Liaoning University of Technology,Jinzhou121004,China;2.College of Chemistry &Chemical Engineering,Guangzhou University,Guangzhou510006,China)
K9[Sb1.0W9O33]was prepared by sol-gel method with citric acid as complexing agent,which was modified with cetyltrimethylammonium bromide(CTAB)to obtain(CTAB)9[Sb1.0W9O33].Catalytic oxidation cyclohexanol to cyclohexanone by H2O2over(CTAB)9[Sb1.0W9O33]was used as aprobe reaction to investigate the effects of atomic ratio n(Sb)/n(W)in preparation of catalyst,the reaction conditions of n(H2O2)/n(Cyclohexanol),n((CTAB)9[Sb1.0W9O33])/n(Cyclohexanol+H2O2),reaction temperature(T),reaction time(t).The results showed that the optimum conditions were n(Sb)/n(W)=0.11,n(H2O2)/n(Cyclohexanol)=1.5,n((CTAB)9[Sb1.0W9O33])/n(Cyclohexanol+H2O2)=0.0012,T= 353K,t=2.0h,under which the conversion of cyclohexanol reached 97.4%,selectivity to cyclohexanone reached 99.7%.(CTAB)9[Sb1.0W9O33]was detected by means of XRD,and its micro-structure and essence disciplinarian of were disclosed.[Sb1.0W9O33]9-still maintained its original structure,possessing a cooperative effect with CTAB+during the oxidation of cyclohexanol,resulting in the selectivity to cyclohexanone enhanced effectively.
modified polyoxometalates;cyclohexanol;cyclohexanone;catalytic oxidation
O657.3
A
10.3969/j.issn.1001-8719.2012.03.021
1001-8719(2012)03-0481-06
2011-10-10
国家自然科学基金项目(21076047)资助
冯世宏,女,教授,从事工业催化方面的研究;E-mail:shihong.feng@163.com
