枯草芽孢杆菌工程菌株产普鲁兰酶发酵条件的优化
2012-09-12刘逸寒薄嘉鑫王亚品张志萌王建玲路福平
刘逸寒,薄嘉鑫,王亚品,张志萌,王建玲,路福平
(工业发酵微生物教育部重点实验室,工业酶国家工程实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津300457)
枯草芽孢杆菌工程菌株产普鲁兰酶发酵条件的优化
刘逸寒,薄嘉鑫,王亚品,张志萌,王建玲,路福平*
(工业发酵微生物教育部重点实验室,工业酶国家工程实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津300457)
利用基因工程手段获得的产长野芽孢杆菌普鲁兰酶的枯草芽孢杆菌基因工程菌株WB600/pWB-pulB,通过单因素筛选及正交试验进行发酵培养基优化,得到产酶最佳配方为玉米淀粉3.0%,酵母膏2.0%,CaCl20.03%,Na2HPO41.0%。同时对重组菌株摇瓶条件下液体发酵的主要影响因素初始pH、接种量、装液量、转速、温度等进行探讨,确定了产酶最佳培养条件为,以3%接种量接种于优化后培养基,初始pH7.0,装液量30 mL/250 mL,37℃,200 r/min摇床培养36 h。在此优化条件下,普鲁兰酶活力达到20.16 U/mL,是之前研究结果(10.94 U/mL)的1.84倍。
枯草芽孢杆菌工程菌株;长野芽孢杆菌;普鲁兰酶;发酵条件优化;酶活力
Abstract:The single factor comparative experiments and orthogonal experiments were adopted to optimize the liquid fermentation medium and conditions in shaking flasks of Bacillus subtilis WB600/pWB-pulB for producing the pullulanase.The composition of the best medium was corn starch 3.0%,yeast extract 2.0%,CaCl20.03%,Na2HPO41.0%.In addition,the optimal fermentation conditions in shaking flasks were the combination of the inoculums size 3%,initial pH 7.0,medium volume 30 mL/250 mL,temperature 37℃,and shaking at 200 r/min for 36 h.Under these conditions,the activity of recombinant pullulanase reached 20.16 U/mL,which was 1.84 times of before result(10.94 U/mL).
Key words:engineeredBacillussubtilis;Bacillusnaganoensis;pullulanase;fermentationconditionsoptimization;enzyme activity
淀粉质原料是迄今食品工业中应用最为广泛的原料,为直链淀粉和支链淀粉构成的混合物,其中含有75%~85%的支链淀粉,其不能被分解可影响到淀粉的利用率。普鲁兰酶(Pullulanase,EC 3.2.1.41)是一种能够专一性切开支链淀粉分支点中α-1,6糖苷键,从而切下整个侧枝,形成直链淀粉的脱支酶[1-2]。由于其能将最小单位的支链分解,最大限度的利用淀粉原料,可大幅提高淀粉的利用率和生产效率,因此在以淀粉为原料的深加工工业中有着重要的用途及良好的市场前景[3]。单独使用普鲁兰酶可将支链淀粉全部转变成高纯度直链淀粉;同时,其可与α-淀粉酶、β-淀粉酶共同作用淀粉,制得超高麦芽糖浆;在糖化阶段其与糖化酶协同作用,能有效地提高淀粉的水解速率,提高葡萄糖的产量和纯度[4]。
现今,普鲁兰酶的工业化生产菌株极少,仅有丹麦NOVO公司的B.acidopullulyticus和美国Genencor公司的B.deramificans等少数几个菌株工业化生产的报道。国内食品工业上所用的普鲁兰酶全部依赖于国外进口,价格昂贵,造成生产成本较高。另外,目前国内外大多数普鲁兰酶的研究主要集中在产普鲁兰酶野生菌株的选育[5-6]、性能鉴定[7]、诱变改造[8]及发酵工艺优化[9-11]等手段提高普鲁兰酶的活力,但效果均不太理想。针对此种情况,本实验室利用基因工程手段,构建获得一株可表达长野芽孢杆菌ATCC53909普鲁兰酶(最适作用温度范围40℃~60℃,最适作用pH范围4.5~5.0)枯草芽孢杆菌工程菌株WB600/pWB-pulB,其活力达到10.94 U/mL,是原始出发菌株(2.7 U/mL)的4倍左右,实现了普鲁兰酶的高效表达。
本实验基于前期研究,对工程菌株WB600/pWB-pulB发酵培养基成分和发酵条件进行优化,以提高其生产普鲁兰酶的能力,为淀粉深加工行业提供具有耐酸及耐热性能的普鲁兰酶奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 菌种
产长野芽孢杆菌普鲁兰酶枯草芽孢杆菌工程菌株WB600/pWB-pulB,由本实验室构建并保藏。
1.1.2 仪器与设备
ZHWY-2102控温摇床:上海志诚设备厂;TU-1810型紫外分光光度计:北京普析通用仪器有限责任公司;高速冷冻离心机GL20A:日本日立有限公司;SHA-B水浴恒温振荡器:江苏国华仪器厂;HYG-FJ生物反应摇瓶柜:上海新蕊自动化设备有限公司。
1.1.3 培养基
斜面培养基/%:胰蛋白胨1,酵母浸出粉0.5,NaCl1,琼脂粉2,卡那霉素0.003,pH自然。
种子培养基/%:胰蛋白胨1,酵母浸出粉0.5,NaCl1,卡那霉素0.003,pH自然。
初始发酵培养基/%:胰蛋白胨1,酵母浸出粉0.5,NaCl 1,pH 自然。
1.2 方法
1.2.1 发酵培养基的优化
分别对碳源、氮源、金属离子、磷酸盐的种类及浓度进行单因素试验,然后由单因素试验拟定A碳源、B氮源、C金属离子、D磷酸盐4个因素各取3个水平,以L(934)型正交试验表进行试验,以普鲁兰酶活力为指标,确定重组菌的培养基最佳配比。
1.2.2 发酵条件的优化
在优化得到的培养基基础上对培养基初始pH、接种量、装液量、转速及发酵温度等条件进行优化,以期得到最高活力的普鲁兰酶。
1.2.3 酶活的测定
酶活单位定义:在40℃,pH 6.0的条件下,每分钟分解普鲁兰糖产生1 μmol葡萄糖所需的酶量,即为1 U。测定方法采用DNS显色法[12]。
2 结果与分析
2.1 工程菌株发酵培养基的优化
2.1.1 碳源对产酶的影响
分别选取7种碳源进行单因素碳源对产酶影响的试验,结果如图1所示。

玉米淀粉是产酶的最佳碳源,普鲁兰酶活力达到最高,为7.72 U/mL。当玉米淀粉浓度为3.0%时,普鲁兰酶活力达到最高,为9.18 U/mL。
2.1.2 氮源对产酶的影响
分别选取7种氮源进行单因素氮源对产酶影响的试验,结果如图2所示。

酵母膏是产酶的最佳氮源,普鲁兰酶活力达到最高,为9.84 U/mL。当酵母膏浓度为2.0%时,普鲁兰酶活力达到最高,为10.98 U/mL。
2.1.3 不同金属离子对产酶的影响
选择6种金属离子,比较不同金属离子对菌体产酶的影响。结果表明,Zn2+、Fe2+对菌体产酶表现出抑制作用,K+、Na+对产酶没有明显促进或抑制,Ca2+、Mg2+促进产酶,其中Ca2+较Mg2+作用更为显著。近一步研究不同浓度Ca2+对产酶的影响,结果如图3所示。

由图3可知,当添加0.04%Ca2+时,普鲁兰酶活力达到最高,为12.73 U/mL。因此,选择0.04%为Ca2+最适浓度。
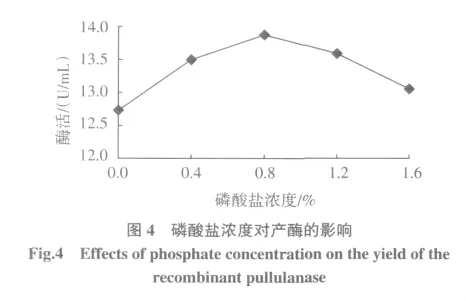
2.1.4 磷酸盐浓度对产酶的影响
结果如图4所示,当磷酸盐浓度为0.8%时,普鲁兰酶活力达到最高,为13.87 U/mL。
2.1.5 正交试验
在单因素试验基础上,以玉米粉、蛋白胨、CaCl2、磷酸盐为因素,每个因素取3个水平,进行L9(34)正交试验设计,具体因素水平见表1,结果及极差分析见表2。
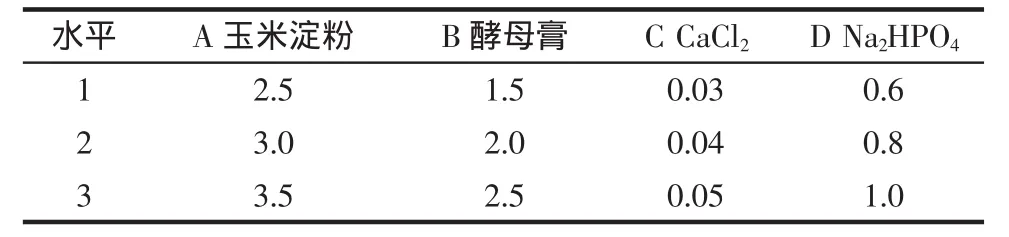
表1 培养基配方正交试验因素水平表Table 1 Factors and levels array of orthogonal experiment of medium components %
由表2可知,极差分析结果表明4个因素的影响程度依次为:酵母膏>玉米淀粉>Na2HPO4>CaCl2。在玉米淀粉、酵母膏、CaCl2和Na2HPO44种培养基组分的不同配比中,产普鲁兰酶活力最佳组合为:玉米淀粉3.0%,酵母膏2.0%,CaCl20.03%,Na2HPO41.0%。对正交试验中所得最佳组合进行验证,普鲁兰酶活力达到14.72 U/mL,大于正交试验中出现的所有结果,验证了结果的正确性,说明所选培养基配比为最优组合。

表2 培养基配方正交试验结果及其极差分析Table 2 Results and variance analysis of orthogonal experiment of medium components
2.2 工程菌株发酵条件的优化
2.2.1 培养基初始pH对产酶的影响
培养基初始pH对产酶的影响见图5。
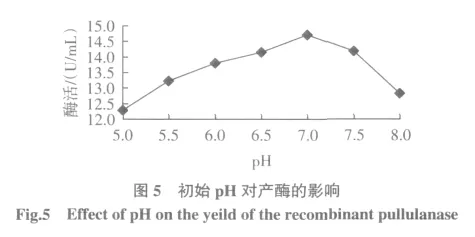
结果如图5所示,初始pH为7(即培养基自然pH)时酶活力达到最高,为14.72 U/mL。初始pH过高或过低,酶活力均会下降。
2.2.2 接种量对产酶的影响
接种量对产酶的影响见图6。

结果如图6所示,当以3%的接种量进行发酵培养时,普鲁兰酶活力最高17.02 U/mL。因此,确定最佳接种量为3%。
2.2.3 装液量对产酶的影响
装液量对产酶的影响见图7。

结果如图7所示,装液量30 mL时,普鲁兰酶活力达到最高,为19.05 U/mL。因此,确定30 mL/250 mL为最适装液量。
2.2.4 摇床转速对产酶的影响
摇床转速对产酶的影响见图8。

结果如图8所示,当转速为200 r/min时,普鲁兰酶活力达到最高,为20.16 U/mL。因此,确定200 r/min为最适摇床转速。
2.2.5 温度对产酶的影响
温度对产酶的影响见图9。

结果如图9所示,当温度37℃时,菌体的生长最旺盛,普鲁兰酶活力达到最高,为20.16 U/mL。因此,确定37℃为最适发酵温度。
3 结论
目前,国内还未见长野芽孢杆菌普鲁兰酶基因在枯草芽孢杆菌中异源表达的报道。本实验室利用枯草芽孢杆菌高拷贝表达载体pWB980及6个蛋白酶缺陷的枯草芽孢杆菌宿主菌株WB600,构建工程菌株WB600/pWB-pulB,实现了长野芽孢杆菌ATCC53909普鲁兰酶基因在枯草芽孢杆菌中的高效表达。本实验在此基础上,对工程菌株WB600/pWB-pulB发酵培养基成分和发酵条件进行优化。分别研究了碳源、氮源、金属离子以及磷酸盐对普鲁兰酶活力的影响,通过正交试验进一步分析,确定最适发酵培养基为:玉米淀粉3.0%,酵母膏2.0%,CaCl20.03%,Na2HPO41.0%。同时,确定了摇瓶最佳发酵工艺:将重组菌的单菌落接种于种子培养基(50 mL/250 mL三角瓶)中,于37℃,200 r/min条件下培养16 h后,以3%接种量接种于优化后培养基(30mL/250mL三角瓶)中,初始pH7.0,37℃,200 r/min培养36 h后,普鲁兰酶活力达到20.16 U/mL,是之前研究结果(10.94 U/mL)的1.84倍。
[1]张树政.酶制剂工业[M].北京:科学出版社,1998:77-83
[2]Ling H S,Ling T C,Mohamad R,et al.Characterization of pullulanase type II from Bacillus cereus H1.5[J].American journal of biochemistry and biotechnology,2009,5(4):170-179
[3]乔宇,丁宏标,王海燕,等.普鲁兰酶的研究进展[J].生物技术进展,2011,1(3):189-194
[4]周念波,孙杰,王晶,等.普鲁兰酶在食品工业中的应用[J].食品工程,2008(2):18-20
[5]Bertoldo C,Armbrecht M,Becker F,et al.Cloning,sequencing,and characterization of a heat-and alkali-stable type I pullulanase from Anaerobranca gottschalkii[J].Applied and environment microbiology,2004,70(6):3407-3416
[6]王淑军,吕明生,李华钟,等.深海古菌Thermococcus siculi HJ21高温普鲁兰酶基因的克隆及表达[J].食品科学,2010,33(19):309-312
[7]NairSU,SinghalRS,KamatMY.Inductionofpullulanaseproduction in Bacillus cereus FDTA-13[J].Bioresource technology,2007,98(1):856-859
[8]郭宏文,邹东恢,杜国军,等.普鲁兰酶产生菌的诱变育种[J].食品研究与开发,2010,31(2):167-169
[9]朱梦,孙海彦,彭明.普鲁兰酶产生菌的筛选鉴定与发酵条件的研究[J].食品研究与开发,2011,32(7):136-140
[10]巩培,戚薇,杜连祥,等.产气气杆菌产普鲁兰酶发酵培养基的优化[J].天津科技大学学报,2009,24(3):1-12,42
[11]Vester-Christensen M B,Hachem M A,Naested H,et al.Secretory expression of functional barley limit dextrinase by Pichia pastoris using high cell-density fermentation[J].Protein expression and purification,2010,69(1):112-119
[12]Miller GL.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical chemistry,1959,31(3):426-428
Optimization of Fermentation Conditions for the Pullulanase Production by Engineered Bacillus subtilis
LIU Yi-han,BO Jia-xin,WANG Ya-pin,ZHANG Zhi-meng,WANG Jian-ling,LU Fu-ping*
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,National Engineering Laboratory for Industrial Enzymes,Tianjin Key Laboratory of Industrial Microbiology,The College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China)
2012-06-10
“十二五”农村领域国家科技计划(2011AA100905-4);国家自然科学基金(31101219)
刘逸寒(1982—),男(汉),讲师,博士,研究方向:应用微生物与酶工程。
*通信作者:路福平,男,教授,研究方向:应用微生物与酶工程。
