高效液相色谱法测定甲鱼油中EPA、DHA的含量
2012-09-12赖春华李军生廖永聪廖诚珍谢志扬陈铁英
赖春华,李军生,廖永聪,廖诚珍,谢志扬,陈铁英
(1.广西工学院生物与化学工程系,广西柳州545006;2.贵港市水产技术推广站,广西贵港537100;3.柳州市产品质量监督检验所,广西柳州545006)
高效液相色谱法测定甲鱼油中EPA、DHA的含量
赖春华1,3,李军生1,*,廖永聪2,廖诚珍2,谢志扬2,陈铁英3
(1.广西工学院生物与化学工程系,广西柳州545006;2.贵港市水产技术推广站,广西贵港537100;3.柳州市产品质量监督检验所,广西柳州545006)
建立分离检测广西黄沙鳖甲鱼油中的EPA和DHA的高效液相色谱法。试验采用岛津VP-ODS色谱柱(250 mm×4.6 mm,5 μm),流动相为甲醇和水(体积比 70∶30),紫外检测波长为 254 nm ,流速为 0.7 mL/min,柱温为30℃。甲鱼油经0.5 mol/L KOH-乙醇溶液进行皂化,三乙胺-溴苯乙酮酯化后直接上机分析。结果表明:EPA、DHA在0.025 mg/mL~0.15 mg/mL范围内线性关系良好,R2EPA为0.9991、R2DHA为0.9995;该法用于甲鱼油的检测,回收率EPA为96.00%~98.67%,DHA为92.00%~98.00%,该法简便、快速、重现性好。
黄沙鳖;DHA和EPA;高效液相色谱;甲鱼油
Abstract:A high performance liquid chromatographic(HPLC)method was established for the determination of EPA and DHA in Chinese yellow sand soft-shelled turtle oil.The analysis was performed on shimADZU-PACK VP-ODS column (250 mm × 4.6 mm,5 μm)at the detection wave length of 254 nm.The mobile phase was consisted of methanol-water(volume ratio was 70∶30)as a flow rate of 0.7 mL/min at column temperature 30 ℃.The tutrle oil saponificatied by 0.5 mol/L KOH-ethanol solution and esterified by Triethylamine-αbromoacetophenone after analysis.The results showed that the calibration curve was linear in the concentration range of 0.025 mg/mL-0.15 mg/mL (R2EPA=0.9991,R2DHA=0.9995).The recoveries ranged from 96.00%to 98.67%for EPA and 92.00%-98.00%for DHA.The method was fast,simple and accurate.
Key words:Chinese yellow sand soft-shelled turtle;EPA and DHA;high performance liquid chromatography(HPLC);turtle oil
甲鱼,别名鳖、水鱼、团鱼和王八等,属爬行纲[1],龟鳖目,鳖科,鳖属,甲鱼是我国传统的上等中草药材,具有极高的药用价值,是滋阴补肾的佳品,有滋阴壮阳,软坚散结、化淤和延年益寿的功能。甲鱼全身是宝[2],其肉、甲、血、头、胆、卵、脂肪均可入药。甲鱼油来源于甲鱼的脂肪油,它富含ω-3多不饱和脂肪酸,主要包括[3]α-亚麻酸(α-linolenic acid,ALA)、二十碳五烯酸(Eicosapentaenoic acid,EPA)和二十二碳六烯酸(Docosahexaenoic acid,DHA)。具有多种生物学活性,是维系人类进化和健康长寿的重要物质[4]。具有保护视力、增智、健脑、抗癌[5]、降低胆固醇的作用和免疫功能[6]等生理功能。甲鱼油脂在体内分布较集中,易取得,脂肪含量高,完全可以单独加工成各种保健食品及保健药品[7],以提高人们的生活水平及健康水平,且对甲鱼原有的利用不受任何影响,可谓一举两得,所以甲鱼脂肪开发利用前景广阔。多年来人们研究鱼油的EPA、DHA较多[8-12],在甲鱼油方面的研究很少,金妙仁等[13]研究了甲鱼油的制备及其理化性质,本文对广西盛产的黄沙鳖甲鱼油中的EPA、DHA含量进行了测定,为深度开发和利用黄沙鳖甲鱼油的特殊营养价值提供参考。
1 材料与方法
1.1 材料
黄沙鳖:广西贵港水产技术推广站提供。
1.2 试剂与仪器
1.2.1 试剂
DHA和EPA(纯度大于99%):Sigma公司;甲醇(色谱纯):天津四友公司;水为双蒸水;溴苯乙酮(分析纯):国药集团化学试剂有限公司;其它均为国产分析纯。
1.2.2 仪器
LC-10ATvp高效液相色谱仪(SPD-10Avp紫外检测器、LCsolution色谱工作站):日本岛津;SZ-93自动双重纯水蒸馏器:上海亚荣生化仪器厂。
1.3 方法
1.3.1 色谱条件
色谱柱:岛津 VP-ODS(250 mm×4.6 mm,5 μm);流动相为甲醇—水(体积比70:30);紫外检测波长:254nm;进样量:10 μL;流速:0.7 mL/min;柱温:30 ℃。
1.3.2 标准品的制备
分别准确吸取1 mg/mL的EPA和DHA标准溶液0.5 mL,用高纯氮气吹至近干,加入1滴酚酞指示剂,用0.1 mol/L KOH-乙醇溶液中和至终点,并再次用氮气吹干,此样品待酯化。
1.3.3 样品处理
取一定量的脂肪块,按照GB/T 14772-2008《食品中粗脂肪的测定方法》提取粗脂肪。准确称取0.0550 g甲鱼油样品,加入0.5 mol/L KOH—乙醇溶液4 mL,充氮气后在60℃水浴中加热30 min,冷却后加入l滴酚酞指示剂,用盐酸一乙醇溶液中和至终点,离心分离定容10 mL,取上清液0.5 mL,用氮气吹干,此样品待酯化。
1.3.4 酯化
标准品和甲鱼油样品经上述处理后,加10 mg/mL三乙胺的丙酮溶液0.2 mL及10 mg/mL ω-溴苯乙酮的丙酮溶液0.4 mL,充入氮气,60℃水浴加热15 min,冷却后定容,为待测酯化物。
2 结果与分析
2.1 空白试验
由于实验是应用衍生法测定,在酯化后未经萃取就直接进样,因此得考虑准备过程中所加试剂是否影响待测物质的检出。在不加标准品和样品的情况下,对酯化后的溶剂进行空白实验,判断干扰成分。所得的色谱图如图1。

2.2 流动相的选择
实验的流动相为甲醇和水,通过调节不同比例流动相来选择最佳分离条件。通过甲醇和水的比例为:85∶15;80∶20;75∶20;70∶30;65∶35,结果发现,当 V甲醇∶V水=70∶30,流速为 0.7 mL/min 时,EPA 和 DHA 分离完好,色谱峰尖锐。结果表明,如图2、图3。

2.3 线性范围的考察及检出限
分别精密吸取 EPA:0.025、0.05、0.075、0.100、0.125、0.15 mg/mL 和 DHA 0.025、0.050、0.075、0.100、0.125、0.150 mg/mL不同浓度的标准混合液进样,按上述条件测定峰面积,以标准品浓度为横坐标X、峰面积为纵坐标Y进行线性回归,得标准曲线。结果为:工作曲线Y=1.4×107X+2.6×105,R2EPA=0.9991;Y=6.9×106X+1.1×105,R2DHA=0.9995;表明在 0.025 mg/mL~0.15 mg/mL 浓度范围内,EPA和DHA线性关系良好。将标准溶液逐级稀释进样,测其峰高响应值及基线噪音强度,以3倍信噪比计算,EPA检出限为0.0015 g/L、DHA检出限为0.0027 g/L。
2.4 精密度实验
分别精密吸取一定浓度的EPA、DHA标准溶液10 μL,按1.3.1色谱条件,重复测定6次,测得峰面积并计算相对标准偏差,结果EPA和DHA的RSD分别为0.46%,0.67%。
2.5 重复性实验
精密吸取同一批甲鱼油样品6份,按1.3.3和1.3.4方法处理,同上述色谱条件,测定峰面积并计算相对标准偏差,结果EPA和DHA的RSD分别为0.36%、0.53%。
2.6 回收率的测定
取不同含量的甲鱼油样品4份,加入相同量的EPA和DHA,做加标回收。再取同一甲鱼油样品加入不同量的EPA和DHA,做加标回收,结果见表1、表2。
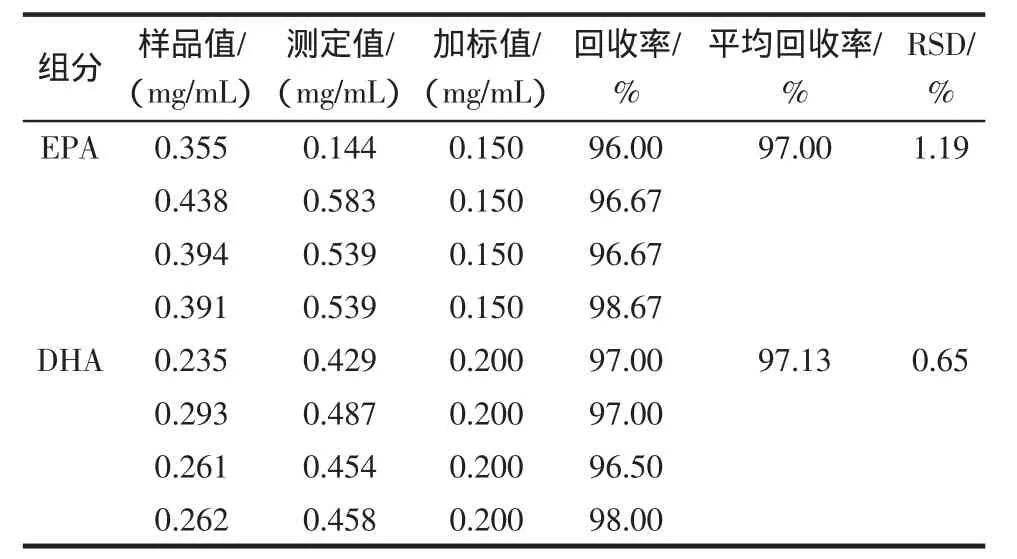
表1 不同样品相同加标量的回收率Table 1 Spiked recoveries of different sample with the same adder
2.7 样品的测定
用本法对黄沙鳖脂肪提取的甲鱼油,按样品处理的方法和色谱条件测定甲鱼油中EPA、DHA的含量,结果EPA、DHA含量分别为6.3%和5.6%。
3 结论
从本次实验数据结果来看,2种不同的加标方法:EPA回收率为96.00%~98.67%和96%~98%,DHA为97.00%~98.00%和92%~97%;EPA相对标准偏差为1.19和2.08,DHA为0.65和2.97。误差和回收率显示本方法可行,有效,简便、快速、重现性好。测得黄沙鳖脂肪块中含有约12%的EPA和DHA。
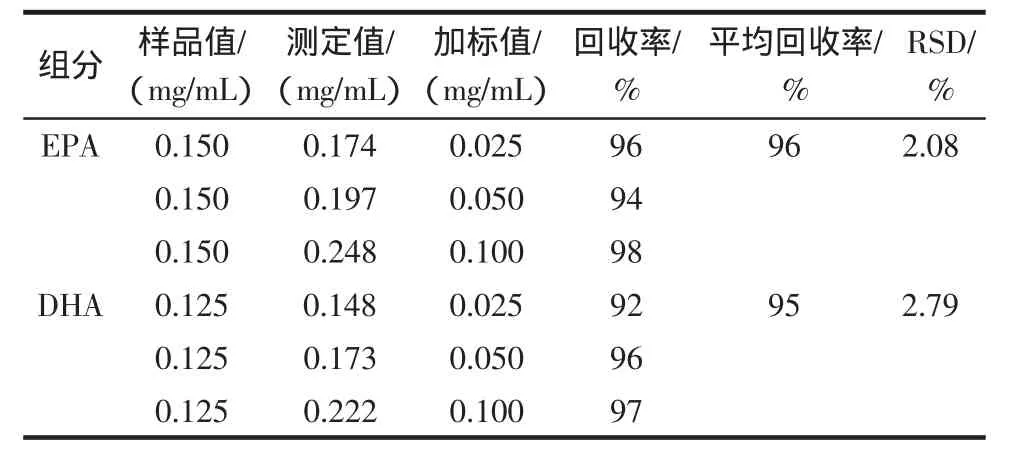
表2 同一样品不同加标量的回收率Table 2 Spiked recoveries of different adder with the same sample
[1]孙晓倩.专家解读龟鳖的奥秘(一)——龟鳖基础文化篇[J].北京水产,2008(3):12-16
[2]国家药典委员会.中华人民共和国药典:一部[M].北京:化学工业出版社,2005:266-266
[3]王仲礼.超级营养素EPA和DHA的研究与开发[J].四川食品工业科技,1995,18(13):54-58
[4]张克坚.二十碳五烯酸的药理作用及作用机制的研究进展[J].中国药理学通报,1996,6(18):146-146
[5]曾名勇.EPA和DHA的生理作用[J].渔业机械仪器,1999,35(8):102-l06
[6]Jones P,Papamandjaris A,Cellular Metabolism.Present knowledge in mutrition[J].8thedition.Vo1.Chapter 10.Washington,DC:Intemational life sciences institute,2003
[7]白晶.鳖油的提取与分析及其生物学活性研究[D].中国人民解放军军医进修学院,2007:12-13
[8]彭宏伟,张博,杨小川,等.HPLC法测定魟鱼鱼油中二十碳五烯酸、二十二碳六烯酸的含量[J].中国药房,2010,21(13):1228-1230
[9]庄俊钰,冯志强,谢忠阳.气相色谱内标法测定深海鱼油中的EPA和DHA[J].现代食品科技,2009,25(11):1363-1365
[10]邹耀洪.2-氨基-2-甲基丙醇衍生气相色谱/质谱分析深海鱼油脂肪酸[J].分析化学,2009,32(1):71-75
[11]周远扬,雷百战,潘艺.鱼油EPA与DHA提取方法研究进展[J].广东农业科学,2009(12):153-155
[12]刘沙,邓放明.淡水水产品EPA与DHA含量及富集方法研究进展[J].粮食与油脂,2009(6):4-6
[13]金妙仁,王水英.鳖油的制备及其理化性质的研究[J].氨基酸和生物资源,2003,25(1):40-41
High Performance Liquid Chromatographic Determination of DHA and EPA in Turtle Oil
LAI Chun-hua1,3,LI Jun-sheng1,*,LIAO Yong-cong2,LIAO Cheng-zhen2,XIE Zhi-yang2,CHEN Tie-ying3
(1.Department of Biological and Chemical Engineering,Guangxi University of Technology,Liuzhou 545006,Guangxi,China;2.The Fishery Technology Spread Station of Guigang,Guigang 537100,Guangxi,China;3.Liu Product Quality Supersion Testing Institute,Liuzhou 545006,Guangxi,China)
2011-11-18
广西贵港科学研究与技术开发计划项目(贵科软0906013)作者简介:赖春华(1985—),男(汉),硕士研究生,研究方向:食品生物化学。
*通信作者
