荔枝果肉多酚的提取与分离
2012-09-12冯卫华于立梅秦艳李冰霞白卫东
冯卫华,于立梅,秦艳,李冰霞,白卫东
(仲恺农业工程学院轻工食品学院,广东广州510225)
荔枝果肉多酚的提取与分离
冯卫华,于立梅,秦艳,李冰霞,白卫东
(仲恺农业工程学院轻工食品学院,广东广州510225)
以荔枝果肉为试验材料,以多酚含量为评定参数,提取分离其中的多酚物质。以乙醇溶液为提取溶剂,通过单因素试验和正交试验,考察了浓度、提取时间、料液比、提取温度、浸提次数等影响提取率的几个重要因素,得出影响果肉中多酚提取的因素由大到小依次为,提取时间>料液比>乙醇浓度>提取温度,最佳工艺条件为,乙醇浓度70%,料液比1∶11,浸提时间6 h,浸提温度40℃,浸提2次,而且荔枝果肉多酚主要以多酚的多聚体为主,其次是低聚体和单体。
荔枝;多酚;提取;优化;分离
Abstract:The optimum extraction conditions of phenolics from Litchi pulp were attained at a solvent-to-solid ratio of 11∶1 by agitated maceration with 70%ethanol at room temperature in the dark for 6 h from freezen sample.The residue was extracted repeatedly.The combined extracts were defatted by hexane,and then extracted by diethyl ether-ethyl acetate(1/1)to obtained Litchi phenolic extracts.And Litchi pulp polyphenols were mainly water-soluble polyphenol content,secondly oligomer and monomers content.
Key words:litchi;phenolic compounds;extraction;optimization;separation
荔枝(Litchi Chinensis Sonn.)营养价值高,风味独特,被誉为“岭南佳果”[1-2]。并且,荔枝中还含有荔枝多酚等多种活性成分,对降血压、降血脂、抗肿瘤、防止动脉粥样硬化、增强免疫力均有一定功效[3-7]。
荔枝采后极易褐变腐烂,荔枝深加工生产迫在眉睫。由于,新鲜荔枝酿酒提高了荔枝的商品价值,是荔枝产业持续发展的重要方向[8]。然而荔枝酒产品在装瓶后或货架期时存在氧化褐变、风味劣变等问题,这不仅影响了产品的外观和风味,而且荔枝酒的营养成分也随之发生变化,经济价值下降。
据报道,荔枝与荔枝壳褐变其主要原因是多酚物质氧化褐变的结果[9-10]。荔枝多酚在荔枝果皮叶、果肉、果核种皮中都有分布,荔枝叶及果皮多酚提取已有系统研究[11-12],如何有效提取荔枝果肉中的多酚,进一步研究荔枝果肉多酚的特性及其在荔枝酒加工中的变化,为控制荔枝酒加工过程中褐变,进一步改进荔枝酒加工工艺,防止营养物质损失提供理论参考。
由于提取条件决定了提取物质的提取质量和提取率,因而提取工艺很重要[13-14]。传统的溶剂提取法因成本低、对活性物质选择性强、易控制等优点在工业中普遍流行[13,15]。本研究选用溶剂提取法提取荔枝果肉中的多酚,以总酚含量作为评价指标,优化荔枝果肉多酚的提取条件。
为了有效分离荔枝多酚,对经优化浸提的荔枝果肉提取液选用正己烷、乙酸乙酯∶无水乙醚(1∶1)分步萃取分离。
1 材料与方法
1.1 材料
1.1.1 原料预处理
荔枝:广州市从化顺昌源绿色食品有限公司。
新鲜的荔枝用不锈钢刀迅速去除果皮、果核,将果肉装入塑料袋中,立即冷冻(-18℃),保存备用。
1.1.2 试验试剂
没食子酸、福林试剂:Sigma Chemical Co.,St.Louis,MO;其它试剂均为分析纯。
1.1.3 试验设备
W-754紫外可见分光光度计:北京瑞利分析有限公司;R205旋转蒸发仪:无锡市星海王生化设备有限公司。
1.2 总酚(TPC)的测定
总酚(TPC)的测定采用福林-肖卡法[16]。
1.2.1 标准曲线绘制
准确称取0.5 g没食子酸溶于蒸馏水中,然后定容至100 mL,再取此原液0.5 mL稀释至50 mL,即为标准溶液。准确量取 0.05、0.1、0.15、0.25、0.5 mL 于 10 mL容量瓶中,各加3 mL蒸馏水,摇匀,再加0.25 mL福林试剂,充分混匀。1 min后,加入20%Na2CO3溶液0.75 mL混匀,用蒸馏水定容。混合液于75℃恒温下水浴10 min后,立即冰浴,于760 nm波长下1 cm比色杯比色,由测得的吸光度绘制标准曲线。空白用蒸馏水代替没食子酸标准溶液。
1.2.2 测定
取0.25 mL适当浓度的样品液(用提取溶剂稀释)于10 mL容量瓶中,空白用提取溶剂代替样品,其余操作同上。根据测得的吸光度从标准曲线计算得荔枝多酚的含量。荔枝总酚的含量表示为每克新鲜样品中含有的总酚量(以没食子酸计,μg GAE/g FW)。
1.3 单因素试验
1.3.1 浸提溶剂浓度的确定
用冷冻荔枝果肉为材料,选用浓度分别为60%、70%、80%、90%、100%的乙醇溶液作为浸提溶剂,料液比为1∶7,在60℃水浴锅避光浸提6 h,过滤得到滤液,立即测定其总酚含量。
1.3.2 料液比的确定
用冷冻荔枝果肉为材料,采用80%的乙醇溶液作为提取溶剂,料液比为 1∶5、1∶7、1∶9、1∶11、1∶13,在 60 ℃水浴锅避光浸提6 h,过滤得到滤液,立即测定其总酚含量。
1.3.3 浸提时间的确定
用冷冻荔枝果肉为材料,采用80%乙醇溶液作为浸提溶剂,料液比为1∶9,在60℃水浴锅避光浸提2、4、6、8、10 h,过滤得到滤液,立即测定其总酚含量。
1.3.4 浸提温度的确定
用冷冻荔枝果肉为材料,采用80%的乙醇溶液作为提取溶剂,料液比为 1∶9,在 25、40、50、60、70 ℃水浴锅分别避光浸提6 h,过滤得到滤液,立即测定其总酚含量。
1.3.5 浸提条件优化
在上面单因素试验的基础上,以乙醇为浸提剂,考察乙醇浓度、料液比、提取时间、提取温度四因素对荔枝果肉多酚提取效果的影响,拟定四因素三水平,采用L9(34)表进行正交试验,分析荔枝果肉多酚在不同浸提条件下的提取率,确定最佳提取条件。
1.3.6 浸提级数的确定
以冷冻荔枝果肉为材料,采用优化的浸提条件连续重复提取3次,立即测定每次浸提液中的总酚含量。
1.3.7 荔枝多酚的分离
将荔枝果肉(5.0 g左右)用优化的浸提条件连续重复提取2次,过滤,合并两次浸提液。将浸提液旋转蒸发除去乙醇(40℃)至体积约为50 mL左右,将浓缩液经等体积正己烷萃取去脂8次,再用等体积乙酸乙酯∶无水乙醚(1∶1)萃取荔枝多酚6次,将合并的乙酸乙酯/无水乙醚相旋转蒸发(30℃)至干燥。将合并的水相放在干燥箱中40℃~50℃干燥,将正己烷相、乙酸乙酯/无水乙醚相、水相等干燥物分别定容,测定其多酚的含量。
1.3.8 数据统计与分析
每个提取试验均重复3次,每个测定均重复3次。结果表示为平均值±标准偏差。应用SPSS 11.5软件(SPSS Inc,Chicago,IL,USA)对所有数据进行方差分析,利用邓肯式多重比较对差异显著性进行分析,p<0.05表示显著,p<0.01表示极显著。
2 结果与分析
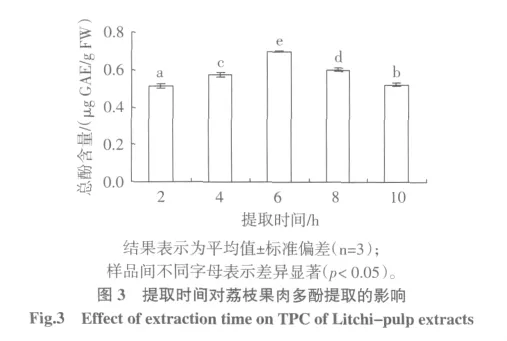
2.1 乙醇浓度对荔枝果肉多酚提取的影响
图1为乙醇浓度分别为60%、70%、80%、90%、100%时,荔枝果肉提取液中总酚含量的变化。结果表明,采用80%乙醇浓度浸提,提取液中总酚含量最高,多酚含量显著高于其他浸提液提取的总酚含量(p<0.05)。因此初步确定乙醇浓度为80%比较合适。
2.2 料液比对荔枝果肉多酚提取的影响
图 2 为料液比分别为 1∶5、1∶7、1∶9、1∶11、1∶13 时,荔枝果肉提取液中总酚含量的变化。结果分析表明,料液比对荔枝果肉提取液中总酚含量的影响显著(p<0.05)。采用1∶13浸提,提取液中总酚含量最高,并且随着料液比的增大,荔枝果肉多酚浸提量显著增加p<0.05)。根据Rubilar等[17]的研究,浓度梯度是提取的动力,因而提高料液比对提取有正面影响。然而,提高料液比虽然有利于总酚的提取,但当料液比达到某一极限时,再提高料液比收效不大(后一级料液比较前一级料液比增加的提取率分别为46.9%、36.7%、28.0%、18.1%)。由结果分析并考虑到浓缩时间,可将料液比确定为 1∶9。
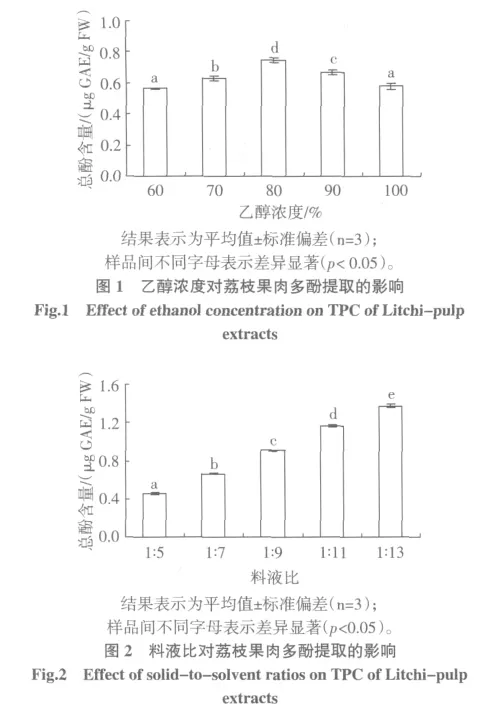
2.3 提取时间对荔枝果肉多酚提取的影响
图 3 为浸提时间分别为 2、4、6、8、10 h 时,荔枝果肉提取液中总酚含量的变化。
结果分析表明,浸提时间对荔枝果肉提取液中总酚含量的影响显著(p<0.05)。采用6 h浸提,提取液中总酚含量最高。显然,多酚的充分提取需要足够的浸提时间,但是由于提取过程中多酚长时间处于高温下,造成部分氧化,因而延长提取时间提取率反而下降[18],因此,浸提时间不能太长。因此初步确定浸提时间6 h。
2.4 提取温度对荔枝果肉多酚提取的影响
图 4为提取温度分别为 25、40、50、60、70℃时,荔枝果肉提取液中总酚含量的变化。结果表明,采用40℃浸提,提取液中总酚含量最高,其总酚含量显著高于提取温度分别为 25、50、60、70℃的总酚含量(p<0.05)。显然,适宜的温度有利于多酚的提取。综合考虑,本试验选择温度为40℃。

2.5 各因素综合变化对荔枝果肉多酚提取的影响
以上结果均为单因素变化对荔枝果肉多酚提取的影响。为了全面考察乙醇浓度、料液比、浸提时间、浸提温度4个因素对荔枝果肉多酚提取效果的影响,设计了四因素三水平正交试验。因素水平的选择是由单因素结果并综合考虑时间效应而定。因素水平见表1,正交表及正交结果见表2,根据表2正交试验结果,得表3方差分析结果。
通过表2正交试验分析结果表明,影响荔枝果肉多酚类物质浸提量的因素主次顺序为:B>C>A>D,即浸提时间对荔枝果肉提取液中总酚含量的影响最大,其次为料液比,乙醇浓度又次之,浸提温度影响最小。荔枝果肉多酚的最佳提取条件为A1B2C3D1,即:70%乙醇按1∶11的料液比在温度40℃下浸提6 h,荔枝果肉多酚浸提效果最好。表3方差分析结果表明,浸提时间对荔枝果肉多酚提取的影响达到极显著水平(p<0.01);乙醇浓度和料液比二因素对荔枝果肉多酚提取的影响达到显著水平(p<0.05)。又通过对每个因素的三水平进行多重比较,结果如下:A因素(乙醇浓度)3个水平最优是A1;B因素(提取时间)3个水平最优是B2;C因素(料液比)3个水平最优是C3,D因素(料液比)3个水平最优是D1。即通过方差分析结果确定最佳组合依旧为A1B2C3D1。
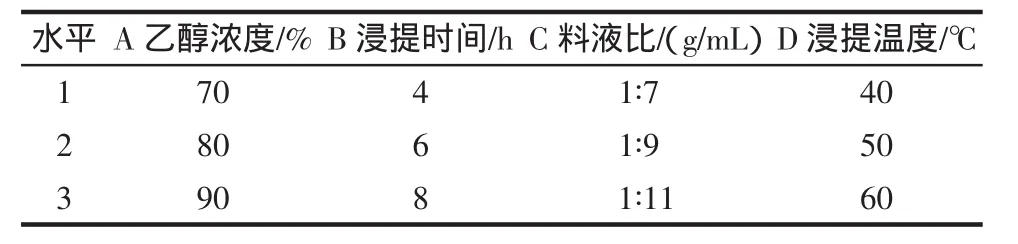
表1 荔枝果肉多酚浸提条件的因素水平表Table 1 Factors and levels for the optimization of phenolics extraction conditions from Litchi-pulp

表2 荔枝果肉浸提L9(34)正交试验方案及测定结果Table 2 Results of phenolics extraction from Litchi-pulp by L9(34)orthogonal design
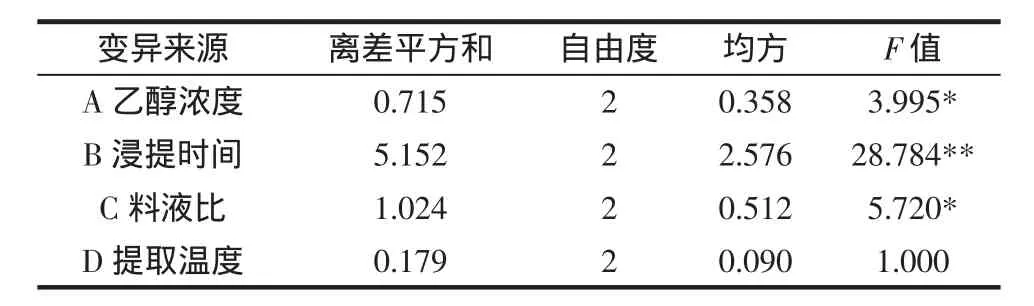
表3 荔枝果肉浸提L9(34)正交试验方差分析表Table 3 Variance analysis of phenolics extraction results from Litchi-pulp by L9(34)orthogonal experiment
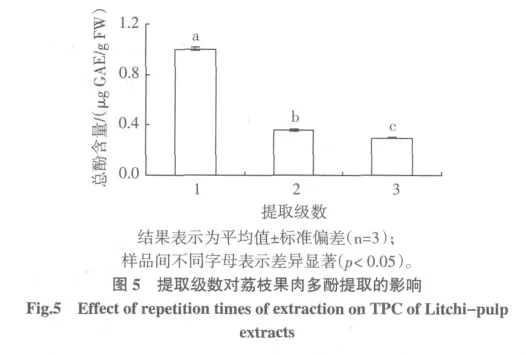
2.6 浸提级数对荔枝果肉多酚提取的影响
荔枝果肉用优化的浸提条件连续重复提取3次,测定每次浸提液的总酚含量,见图5。结果分析表明,提取级数对荔枝果肉提取液中总酚含量的影响显著(P<0.05)。然而,第一、二、三次浸提总酚的量占总的总酚浸提量[(1.655±0.009)μg GAE/g FW]的比例分别为60.54%、21.67%、17.79%,第一、二次浸提的总酚量占总浸提量的83.21%。考虑到提取的成本和后续操作的繁琐与得率的关系,因此,本研究确定浸提次数为2次。
2.7 荔枝多酚的分离
采用优化提取条件浸提的荔枝多酚浸提液用正己烷、乙酸乙酯/无水乙醚(1:1)分步萃取,得到荔枝多酚浸提液的正己烷相、乙酸乙酯/无水乙醚相和水相,分别测定此三相中总酚的含量(图6)。结果分析表明,三相中多酚含量差异显著(p<0.05),其中,水相的总酚含量最高,乙酸乙脂/无水乙醚相的总酚含量次之,正己烷相最小,根据Calliste等[19]的研究,水相中含有的酚类物质多为多酚的多聚体,而正己烷相及乙酸乙酯/无水乙醚相则为多酚的低聚体和单体。因此,荔枝果肉多酚主要以多酚的多聚体为主,其次是低聚体和单体。

3 结论
本研究选用溶剂提取法提取荔枝果肉中的多酚,以总酚含量作为评价指标,优化了荔枝果肉多酚的提取条件。影响荔枝果肉多酚提取的主要因素是浸提时间,其次为料液比,乙醇浓度又次之,浸提温度影响最小,荔枝果肉多酚浸提的最佳工艺条件即为:采用70%乙醇,按1∶11的料液比在温度40℃下浸提6 h,在此条件下浸提2次。荔枝果肉多酚主要以多酚的多聚体为主,其次是低聚体和单体。
本研究为进一步研究了荔枝多酚的成分与组成、荔枝多酚的生物活性,进一步研究荔枝果肉多酚的特性及其在荔枝酒加工中的变化,为控制荔枝酒加工过程中褐变,进一步改进荔枝酒加工工艺,防止营养物质损失提供理论性指导。
[1]温靖,肖更生,陈卫东,等.荔枝的成分及加工利用研究[J].广东农业科学,2008(7):105-107
[2]岳强,曾新安,于淑娟,等.新鲜荔枝汁营养成分分析[J].食品工业科技,2006(4):173-174
[3]唐小俊,池建伟,张名位,等.荔枝多糖的提取条件及含量的测定[J].华南师范大学学报:自然科学版,2005(2):27-31
[4]胡位荣,张昭其,季作梁,等.荔枝冷害过程中果皮色泽、花色素苷和类黄酮含量的变化[J].园艺学报,2004,31(6):723-726
[5]董周永,池建伟,杨公明,等.荔枝的保健作用及开发利用前景[J].食品研究与开发,2005,26(5):148-151
[6]吴华慧,李雪华,邱莉.荔枝、龙眼果肉及荔枝、龙眼多糖清除活性氧自由基的研究[J].食品科学,2004,25(3):166-169
[7]张永明,袁红,田菊霞,等.荔枝核皂甙提取物对小鼠糖异生作用和血脂代谢的影响[J].杭州师范学院学报,2005,4(6):435-436
[8]曾宪远,曾新安,彭超英,等.几种添加剂对荔枝酒风味的影响[J].酿酒科技,2006(11):27-29
[9]Jiang Y M,Duan X W,Joyce D,et al.Advances in understanding of enzymatic browning in harvested litchi fruit[J].Food chemistry,2004,88:443-446
[10]Zhang Z Q,Pang X Q,Ji Z L,et al.Role of anthocyanin degradation in litchi pericarp browning[J].Food chemistry,2001,75:217-221
[11]吴国宏,熊何健.荔枝叶中多酚类物质的提取制备[J].食品科学,2007,28(6):131-135
[12]熊何健,郑建华,吴国宏,等.荔枝多酚的分离制备及清除DPPH活性[J].食品科学,2006,27(7):86-88
[13]Hinneburg I,Neubert R H H.Influence of extraction parameters on the phytochemical characteristics of extracts from buckwheat(Fagopyrum esculentum)Herb[J].J Agric Food Chem,2005,53:3-7
[14]Kapasakalidis P G,Rastall R A,Gordon M H.Extraction of polyphenols from processed black currant (Ribes nigrum L.)Residues[J].J Agric Food Chem,2006,54:4016-4021
[15]韩丙军,彭黎旭.植物多酚提取技术及其开发应用现状[J].华南热带农业大学学报,2005,11(1):21-26
[16]Singleton V L,Rossi J A.Colorimetry of total phenolics with phosphomolybdic phosphotungstic acid reagents[J].Am J Enol Vitic,1965,16(3):144-158
[17]Rubilar M,Pinelo M,Ihl M,et al.Murta leaves(Ugni molinae Turcz)as a source of antioxidant polyphenols[J].J Agric Food Chem,2006,54:59-64
[18]莫燕霞,胡宝祥,莫卫民.不同提取方法测定新鲜茶叶中茶多酚含量的比较研究[J].浙江工业大学学报,2008,36(2):158-161
[19]Calliste C A,Trouillas P,Allais D P,et al.Castanea sativa Mill.Leaves as new sources of natural antioxidant:an electronic spin resonance study[J].J Agric Food Chem,2005,53(2):282-288
The Optimum Extraction of Phenolic Compounds in Litchi Pulp
FENG Wei-hua,YU Li-mei,QIN Yan,LI Bing-xia,BAI Wei-dong
(College of Light Industry and Food,Zhongkai University of Agriculture and Engineering,Guangzhou 510225,Guangdong,China)
2011-11-24
国家科技部星火计划项目(2007EA781003);广东省科技计划项目(2007B023001002);广州市科技计划项目(2007ZE0091);广州市科技计划项目(2009C6-I051);仲恺农业工程学院博士启动基金项目(G2360280)
冯卫华(1968—),女(汉),副教授,博士,研究方向:果蔬贮藏与加工、生物活性成分提取纯化及功能分析。
