紫外分光光度法测定柑橘皮中的总黄酮
2012-09-12徐旭耀萧许凤梅丹丹余炳生
徐旭耀,萧许凤,梅丹丹,余炳生
(湛江师范学院化学科学与技术学院,广东高校新材料工程技术开发中心,广东湛江524048)
紫外分光光度法测定柑橘皮中的总黄酮
徐旭耀,萧许凤,梅丹丹,余炳生*
(湛江师范学院化学科学与技术学院,广东高校新材料工程技术开发中心,广东湛江524048)
以芦丁为对照品,271 nm为检测波长,采用紫外分光光度法测定柑橘皮中总黄酮的含量。芦丁对照品在6.2 μg/mL~56 μg/mL 范围内线性关系良好(r=0.9993)。利用均匀设计法,以功率、时间、乙醇浓度、料液比等为考察因素,研究并比较超声波和微波提取柑橘皮中总黄酮的条件,发现在所用的实验条件下微波法的总提取率高于超声波法。微波法的较优提取条件为:功率60%,时间7 min,乙醇浓度50%,料液比1∶45(g/mL)。因此,试验选用微波法作为柑橘皮中总黄酮的提取方法。方法的平均加标回收率为99.5%,并用于柑橘皮中总黄酮的测定,取得了较满意的结果。
超声波;微波;柑橘皮;总黄酮;紫外分光光度法;均匀设计法
Abstract:Total flavonoid in citrus peels was determined by UV spectrophotometry at 271 nm using rutin as the standard compound.The calibration curve was linear in the range of 6.2 μg/mL-56 μg/mL for rutin(r=0.9993).The extraction conditions of total flavonoid from citrus peels were compared by ultrasonic and microwaveassistance with the uniform design method,with respects of power,extracting time,ethanol concentration,ratio of solid to liquid as the investigated factors,and it was found that the microwave extraction rate was higher than ultrasound-assisted extraction rate in the tested experimental conditions.The chosen extraction condition of microwave method was as follows:microwave power 60%,extracting time 7 minutes,50%ethanol,and ratio of solid to liquid 1∶45(g/mL).Therefore,microwave method was selected as the extraction method of total flavonoid measurement by UV spectrometry in citrus peels.The average recovery of the methods was 99.5%,and the method was satisfactorily used in determination of total flavonoids in citrus peels.
Key words:ultrasound;microwave;citrus peels;total flavonoids;UV spectrophotometry;the uniform design method
柑橘为芸香科柑橘属,原产于我国,全世界有80多个国家栽培柑橘,其产量居水果之首。柑橘皮中含有丰富的黄酮类物质成分,它们具有抗氧化、抗癌、防止心血管疾病、消炎、抗过敏、镇痛、抗菌和抗病毒等作用[1-5]。因此,测定其中黄酮的含量具有重要的现实意义。
黄酮类化合物常见的测定方法有HPLC法[6-7],分光光度法[8],比色法[9]和近红外反射光谱法[10]等。对总黄酮含量的测定,多采用NaNO2-Al(NO3)3-NaOH体系分光光度法,在510 nm下测定其吸光度,但操作比较烦琐,用时较长,体系相对复杂[11]。苏东林[12]等认为,以氯化铝显色法(275 nm)结果比较准确,并经过HPLC法检验,而直接测定法(270 nm)结果次之,硝酸铝显色法(345 nm)结果相对稍差。
黄酮的提取是测定的关键因素之一,也是黄酮生产的主要环节。因此,研究黄酮的提取具有多方面的重要性。黄酮提取的影响因素很多,为了提高黄酮的生产工艺,增效减能,必须要对各影响因素进行优化。本文利用均匀设计法,通过对超声波法和微波法提取柑橘皮中总黄酮的条件进行比较研究,并以芦丁为对照品,271 nm为检测波长,用紫外分光光度法测定了柑橘皮中的总黄酮。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器
UV-2550型紫外分光光度计:日本岛津公司;SB-3200型超声波清洗器(超声功率180W):宁波新芝生物科技有限公司;AE240型双量程分析天平:梅特勒-托利多仪器上海有限公司;LWMC-201型微波化学反应器(功率650 W):南京旋光科技有限公司;JYL-350型料理机:九阳股份有限公司;HG202-2A型电热恒温烘箱:南京实验仪器厂。
1.1.2 试剂
芦丁对照品(含量≥98%):天津一方科技有限公司;无水乙醇(分析纯):广州化学试剂厂。
1.2 方法
1.2.1 对照品溶液制备
准确称取干燥恒重的芦丁对照品31.20mg,用50%乙醇溶解并定容于100 mL容量瓶中,得312 μg/mL对照品溶液,冷藏保存备用。
1.2.2 样品溶液制备
将市售的新鲜柑橘,去肉留皮,将皮剪成小块薄片于60℃干燥至恒重,用料理机粉碎成粉末,置于干燥器中备用。称取一定质量的柑橘皮粉末,加入一定浓度的乙醇溶液,分别进行微波处理或超声波处理,以相应浓度的乙醇溶液为参比测定吸光度,必要时将样品溶液稀释。
2 结果与讨论
2.1 标准曲线的绘制
将不同浓度的对照品溶液,在波长271 nm处,以50%乙醇为参比,测定吸光度值A。以浓度C(μg/mL)为横坐标,吸光度值A为纵坐标,得到线性回归方程:A=0.02461C+0.04612(r=0.9993)。芦丁对照品浓度在6.2 μg/mL~56 μg/mL范围内与吸光度值呈良好的线性关系。
2.2 测定波长的选择
黄酮类化合物在200 nm~400 nm区域内存在2个主要吸收峰:峰带Ⅰ220 nm~280 nm和峰带Ⅱ300 nm~400 nm[13]。将对照品和样品溶液分别进行紫外扫描,发现对照品溶液在260 nm和360 nm附近有最大吸收,样品溶液在280 nm和320 nm附近有特征峰,见图1。
由于提取溶液与对照品溶液的吸收光谱有一定差异,为兼顾对照品和样品溶液的吸收特征,选择271 nm为测定波长。

2.3 提取条件的选择
利用均匀设计法,选择提取温度、时间、乙醇浓度、料液比为超声波提取的考察因素;选择提取功率、时间、乙醇浓度、料液比为微波提取的考察因素;因素水平表分别见表1、表3。以新奇士橙皮为试样,超声波和微波试验方案和结果分别见表2、表4。

表1 超声波提取因素水平表Table 1 Factors and levels of ultrasound extraction
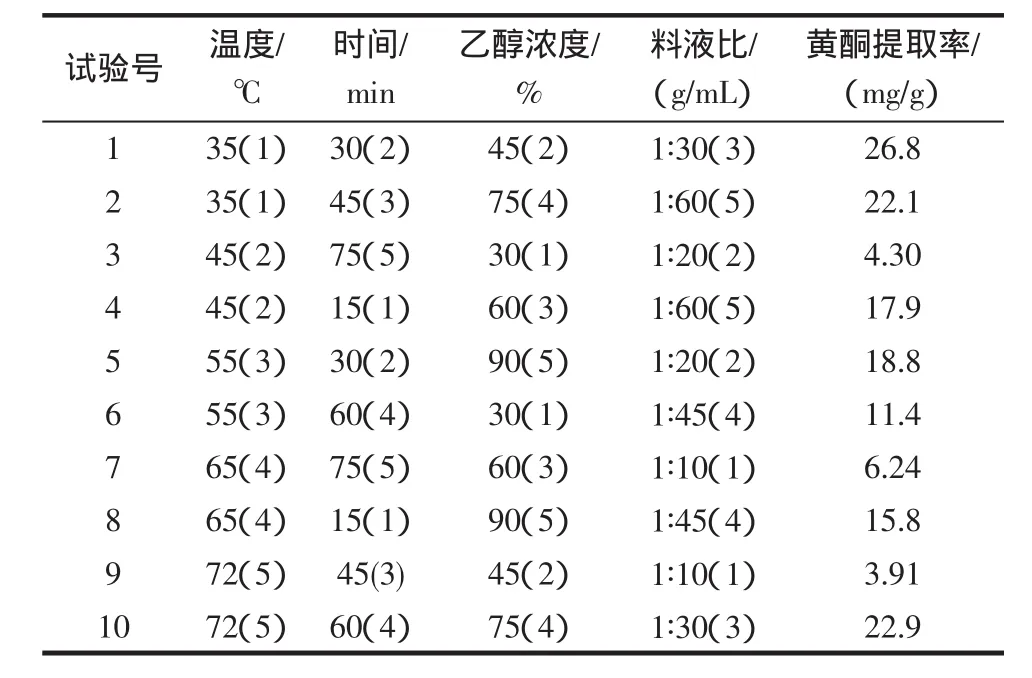
表2 超声波提取U10(108)拟水平均匀设计方案与结果Table 2 Ultrasonic extraction results of drafting level uniform desigh method
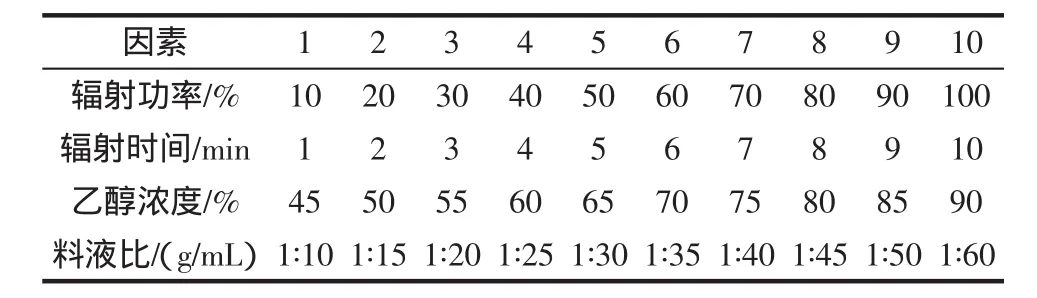
表3 微波提取因素水平表Table 3 Factors and levels of microwave extraction
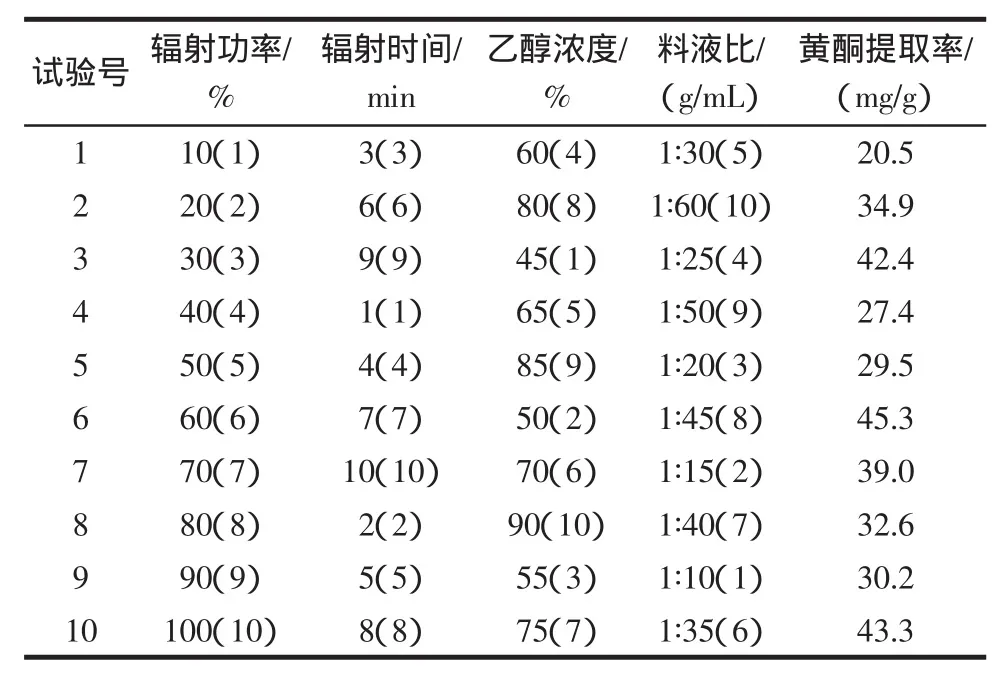
表4 微波提取U10(108)均匀设计方案与结果Table 4 Microwave extraction results of uniform design method
超声提取是超声波对液体中固体物质作用时,产生空化效应,造成生物细胞壁及整个生物体的破裂,加速溶剂进入细胞。同时,超声波的振动作用强化了胞内物质的释放、扩散和溶解,使化学成分快速进入溶剂中,从而达到提取的目的[14]。微波提取是透过对微波透明的溶剂,到达植物物料的内部,使细胞内温度突然升高,连续的高温使其内部压力超过细胞壁膨胀的能力,致细胞破裂,细胞内的物质自由流出传递至周围的溶剂中被溶解[15]。
从试验结果来看,微波提取耗时更短,且提取率更高,总体效果优于超声波。因此,本试验采用微波法作为总黄酮的提取方法,选择微波提取的较优工艺条件为:辐射功率60%,辐射时间7 min,乙醇浓度50%,料液比 1∶45 g/mL。
2.4 精密度试验
准确移取一定体积的微波样品溶液于10 mL具塞比色管中,加相应浓度的乙醇溶液定容至刻度,摇匀,在波长271 nm处,以相应浓度的乙醇溶液作参比,测定其含量,重复6次,结果见表5。

表5 微波提取的精密度试验结果Table 5 The precision experiment results of microwave extraction
由表5可知,微波的RSD为0.51%,表明仪器稳定性较好。
2.5 重复性实验
精确称取一定质量的新奇士橙皮粉末若干份,按所选择的微波提取方案进行操作,得到样品溶液上机测定其含量,结果见表6。
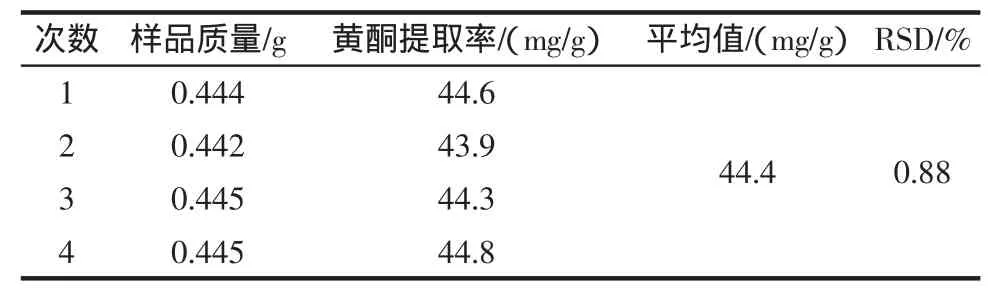
表6 微波提取的重复性实验结果Table 6 The repetition experiment results of microwave extraction
由表6可知,微波法的重复性较好。
2.6 加标回收试验
精确称取一定质量的芦丁对照品,加入到柑橘皮样品中,并按所选择的微波提取方案进行操作,得到样品溶液上机测定其含量,结果见表7。

表7 微波提取加标回收实验结果Table 7 The recovery experiment results of microwave extraction
由表7可知,微波法的平均加标回收率为99.5%(RSD=2.2%,n=4)。
2.7 稳定性试验
分别取同一份微波样品溶液,置于室温下,间隔一定时间进行测定。在 0、0.5、3.5、6.0、30.5 h样品溶液的吸光度分别为 0.551、0.550、0.546、0.546、0.541。结果表明,微波提取的样品溶液在30 h内基本稳定,RSD为0.82%。
2.8 柑橘皮样品中总黄酮含量的测定
选取市售的5种不同品种柑橘,按所选择的微波提取方案测定其总黄酮含量,结果见表8。

表8 不同柑橘皮样品中总黄酮含量结果Table 8 The total flavonoids content in different citrus peels(n=4)
3 结论
利用均匀设计法,对超声波和微波提取柑橘皮中总黄酮的条件进行研究并比较,微波法的总体提取率高于超声波法。微波提取柑橘皮中总黄酮的较优条件是:辐射功率60%,辐射时间7 min,乙醇浓度50%,料液比1∶45(g/mL);结合紫外分光光度法测定了柑橘皮中总黄酮的含量。样品制备比较简单,操作方便,快捷,弥补了氯化铝显色法的不足,结果较为满意。本文研究的提取条件也为柑橘皮中总黄酮的开发和评价提供实验数据和参考。
[1]Wilmsen P K,Spada D S,Salvador M.Antioxidant activity of the flavonoid hesperidin in chemical and biological systems[J].Agric Food Chem,2005,53(12):4757-4761
[2]Danila Di Majo,Marco Giammanco,Maurizio La Guardia,et al.Flavanones in Citrus fruit:Structure-antioxidant activity relationships[J].Food research international,2005,38(10):1161-1166
[3]Qingguo Tian,Edward G Miller,G K Jayaprakasha,et al.An improved HPLC method for the analysis of citrus limonoids in culture media[J].Journal of Chromatography B,2007,846(1/2):385-390
[4]Feras Imad Kanaze,Chrysi Gabrieli,Eugene Kokkalou,et al.Simultaneous reversed-phase high-performance liquid chromatographic method for the determination of diosmin,hesperidin and naringin in different citrus fruit juices and pharmaceutical formulations[J].Journal of pharmaceutical and biomedical analysis,2003,33(2):243-249
[5]裴凌鹏,惠伯棣,金宗濂,等.黄酮类化合物的生理活性及其制备技术研究进展[J].食品科学,2004,25(2):203-207
[6]董文庚,邓晓丽,苗凤智,等.HPLC法测定银杏叶中黄酮的含量[J].理化检验-化学分册,2005,41(8):563-565
[7]Feras Imad Kanaze,Eugene Kokkalou,Manolis Georgarakis,et al.A validated solid-phase extraction HPLC method for the simultaneous determination of the citrus flavanone aglycones hesperetin and naringenin in urine[J].Journal of pharmaceutical and biomedical analysis,2004,36(1):175-181
[8]毕和平,韩长日,王芳,等.分光光度法测定破布叶中总黄酮[J].广东化工,2006,33(3):43-45
[9]苏东林,单杨,李高阳.比色法测定柑桔皮中总黄酮含量的研究[J].中国酿造,2008,27(3):69-74
[10]胡钢亮,吕秀阳,吴建国,等.近红外漫反射光谱法直接测定银杏叶提取物粉末中总黄酮的含量[J].药物分析杂志,2004,24(1):18-20
[11]吕凛,陶宁萍.紫外分光光度法检测桔皮中总黄酮含量的方法研究[J].现代食品科技,2009,25(2):217-220
[12]苏东林,单杨,李高阳.紫外分光光度法测定柑桔皮中总黄酮的含量[J].食品研究与开发,2007,28(8):124-128
[13]姚新生.天然药物化学[M].北京:人民卫生出版社,2001:191-196
[14]郭孝武,冯岳松.超声提取分离[M].北京:化学工业出版社,2008:31-35
[15]周晶,冯淑华.中药提取分离新技术[M].北京:科学出版社,2010:106-108
UV Spectrophotometric Measurement of Total Flavonoids in Citrus Peels
XU Xu-yao,XIAO Xu-feng,MEI Dan-dan,YU Bing-sheng*
(Chemistry Science and Technology School,Zhanjiang Normal University,Development Center for New Materials Engineering&Technology in Universities of Guangdong,Zhanjiang 524048,Guangdong,China)
2011-12-23
徐旭耀(1982—),男(汉),实验师,硕士,主要从事色谱和光谱分析研究。
*通信作者
