药用植物内生真菌研究进展
2012-09-12严菊芬王素萍齐宁波杨树林
严菊芬,王素萍,齐宁波,陈 君,毛 俊,杨树林
南京理工大学生物工程研究所,南京 210094
我国幅员辽阔,气候多样,中草药植物种类繁多,拥有世界上最丰富的药用植物物种资源,目前有记载的药用植物11 146种[1]。但由于中医药产业的迅速发展导致药用植物的过度利用,有相当一部分珍稀药用植物资源濒临灭绝。
“内共生理论”认为内生真菌可产生与其宿主相同或相似的代谢物质[2],因此从一些药用植物中分离某些内生菌,利用内生真菌发酵生产具有抗菌、抗肿瘤、抗病毒的天然活性物质来代替药用植物,这样不但很好地保护了中草药植物资源,而且也为新药物的开发利用提供了新的途径,具有极大的应用价值和开发潜力。本文就药用植物内生真菌宿主植物的选择,内生真菌分离及其次级代谢产物的制备、分离纯化和活性研究进行综述,以期为药用植物内生真菌研究者提供方法和思路。
1 内生真菌宿主植物的选择
世界上药用植物种类很多,选取何种植物材料来分离内生真菌并进行相应的研究是一个非常重要的问题。有的内生真菌不但可以自身合成药物活性成分,还具有促进宿主植物合成活性成分的能力。例如,Wang et al.[3-5]从中国红豆杉(Taxus chinensis)中分离到的一株内生真菌,可使红豆杉悬浮培养细胞的紫杉醇产量提高两倍,这对于天然药物的研究具有特别的意义。Strobel et al.[6]在选择植物进行内生菌分离及发现其天然产物中提出了以下几个基本原则:
1.1 选择特殊环境中的植物,尤其是那些具有独特生物特征及生存方式的植物。通常认为处于特殊环境中的植物可能是产新活性化合物的内生菌的来源。
红树林是生长于热带和亚热带陆海交界带上的稀有木本植物,是由陆地向海洋过渡的特殊生态系统,因而其内生真菌的次级代谢产物也成为天然产物研究的一个热点。如近十多年来先后从红树林内生真菌Halascus kanaloanus中分离得到了helascolides A和B、赭曲霉素、Meomangicol A ~C、Pilifonnie acid、异香豆素Avicennin A和B及其类似物、三羟基麦角甾醇、鞘胺醇苷等化合物[7-8]。
1.2 选择民间传统药用植物。对这些植物的了解一般通过与当地居民交流或是文献的记载。在对这些植物研究过程中,发现植物的治疗作用与其内生菌有关。如用于治疗割伤、伤疤和感染的蛇草Kennedia nigrscans,研究发现其治疗作用不是植物本身,而是其内生菌链霉菌Streptomyces NRRL 30562产生的广谱的新肽类抗生素munumbicins[9]。
1.3 选择地域性的植物,它们具有特殊的存活方式。如冈瓦纳大陆的植物比其它地方的植物寄存着更多具有产天然活性物的内生真菌。
1.4 选择生长于具有生物多样性地区的植物。通常此地区的植物内生真菌也具有较高的生物多样性,如目前研究比较多的雨林植物[8,10]。
2 内生真菌分离鉴定
2.1 表面消毒
内生真菌是生物活性次级代谢物的重要来源[11-13],所以药用植物内生真菌分离是一个关键而重要的步骤。分离所用的方法应能筛选出植物体内尽可能多的内生真菌,同时能排除表面附生的真菌。
最常用的分离方法是植物组织表面消毒法。在此过程中最重要的是消毒剂的选择,理论上,消毒试剂应该杀死植物表面所有微生物而不影响宿主植物内生真菌。但一般很难做到,因为在表面消毒的同时消毒剂可能渗入植物组织而影响内生真菌的分离。组织块表面消毒通常包括以下步骤[14]:(1)用自来水彻底洗掉根组织上黏附的泥土颗粒、微生物或其他可溶性杂物;(2)预处理掉植物表面水不溶性物质(如叶子表面上的蜡),为后面消毒提供条件;(3)表面消毒除去植物组织表面微生物;(4)无菌条件下用无菌水冲洗多次;(5)无菌检查,确保植物组织表面完全无菌,这是分离内生真菌的关键。
常用的消毒试剂有NaClO、乙醇和H2O2,从环保和健康角度讲,HgCl2、甲醛、丙烯氧化物、AgNO3等在内生真菌分离中较少使用。在实际分离过程中,一般将多种消毒剂联合使用提高表面消毒的效力。如将表面活性剂(如Tween-80或曲通X-100)和消毒剂结合使用,消毒后将组织在无菌水或70%~95%的乙醇中浸泡1 min以除去残留的消毒剂。常用的消毒剂和使用条件列在表1中。
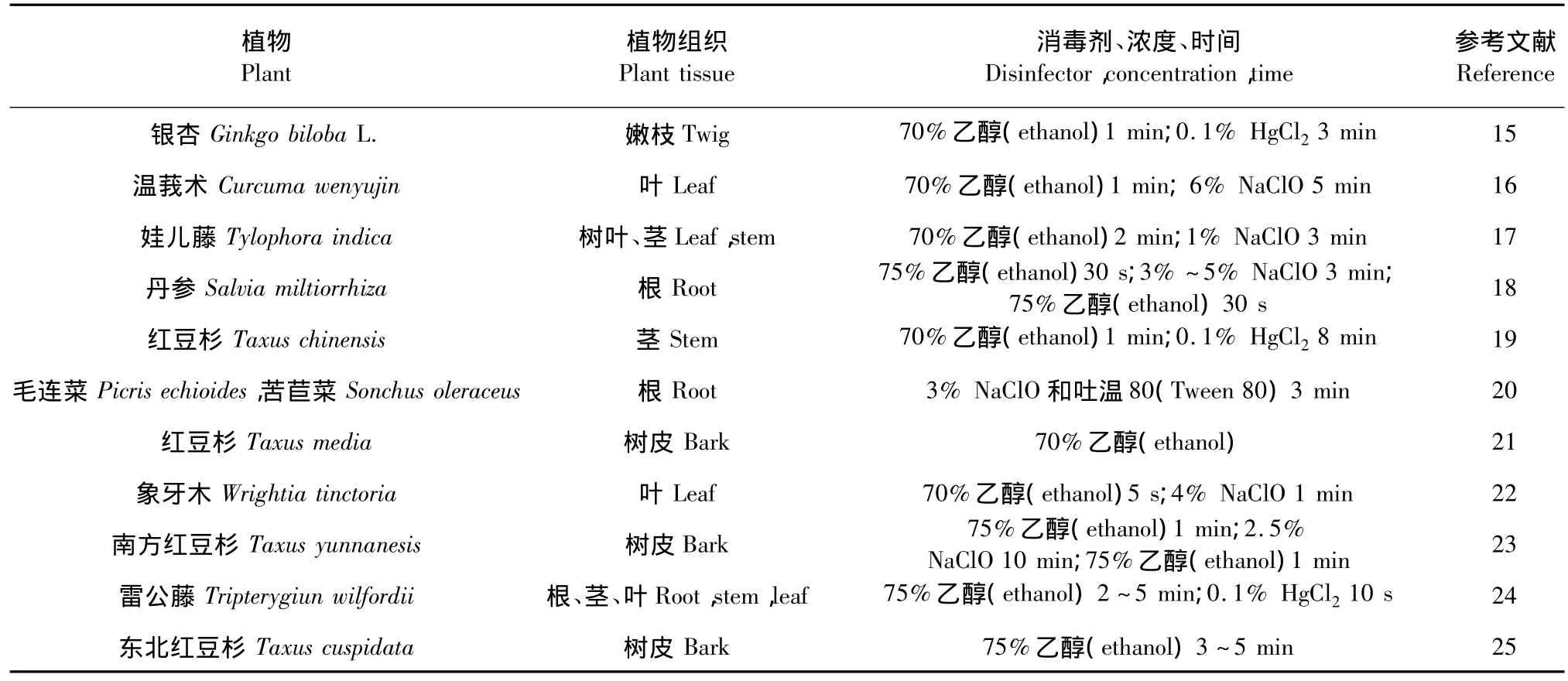
表1 表面消毒试剂和方案Table 1 The reagents and programs of surface disinfection
除组织表面消毒法分离内生真菌外,还有真空或压力提取法。Cohen[26]利用大型真空过滤器从植物叶组织中分离内生真菌;Hallmann et al.[27]使用Scholander压力泵分离内生真菌。这些方法排除了消毒剂的影响,但需要特殊的设备,操作不方便,应用不广泛。
为了保证分离的真菌是内生的,必须要对植物组织表面消毒效果进行检查。检查方法有(1)组织印迹法:将消过毒的植物组织表面印迹于培养基上[28];(2)漂洗液检验法:将最后冲洗材料的液体涂布于培养基上[29];(3)组织浸渍法:将消过毒的植物组织浸渍在液体培养基中[30]。如果培养基上没有微生物生长,说明表面消毒彻底。
2.2 分离培养基
内生真菌分离用的培养基有马丁培养基、马铃薯葡萄糖培养基(PDA)、察氏琼脂培养基、麦芽汁培养基、牛肉浸汁(血)琼脂、曲汁培养基、Pfeffer液体培养基、Sabouraud琼脂培养基、玉米粉琼脂和燕麦粉琼脂等[31]。分离药用植物材料样品多用察氏琼脂或PDA培养基等[32]。为了分离宿主植物特定的内生真菌,有时需用营养贫乏的培养基如合成低营养培养基(SNA)和康乃馨叶片培养基(CLA)[33];为了提高分离的真菌种类多样性,往往对同一组织在多种不同培养基上进行培养。同时,在真菌分离培养过程中,通常在培养基中添加选择性生长抑制剂(如两性霉素B)和抗生素(如氨苄青霉素)用来延缓和抑制某些菌的生长[34]。
2.3 内生真菌的鉴定
内生真菌的鉴定通常根据群体和个体形态特点进行归类与鉴定,肉眼观察菌落大小、颜色、表面特征、质地和生长速度等,光学显微镜或电子扫描电镜(SEM)观察个体形态的菌丝、子实体、孢子和产孢结构等特征,然后根据真菌鉴定手册[35,36]进行归类。对于那些在纯培养中既不能生长也不能形成孢子的真菌,就要采用其他方法进行鉴定,如rDNA序列测定。
3 发酵
药用植物内生真菌产生活性物一般通过微生物发酵法。在此过程中,生物活性物质的产生和产量在不同的发酵培养基以及不同的发酵方式下会存在很大的差异,因此选择合适的培养基种类和发酵方式显得非常重要。
发酵方式根据培养基状态可分为固态发酵和液态发酵;根据发酵位置可分为表面发酵和深层发酵;根据所用菌种数量可分为单一纯种发酵和混合发酵;根据发酵是间歇的还是连续的分为分批发酵和连续发酵。在发酵过程中,各种发酵方式往往是组合进行的,选择什么样的组合方式取决于菌种的特性、原料特点、产物特色、设备状态、技术可行性、成本核算等方面的因素[37]。郭志勇[38]通过实验室静置发酵技术,从红树林内生真菌 Paecilomyces sp.(tree l-7)的次级代谢产物中分离得到十六个化合物,两个新化合物,paecilin A,B;林挺[39]从内生真
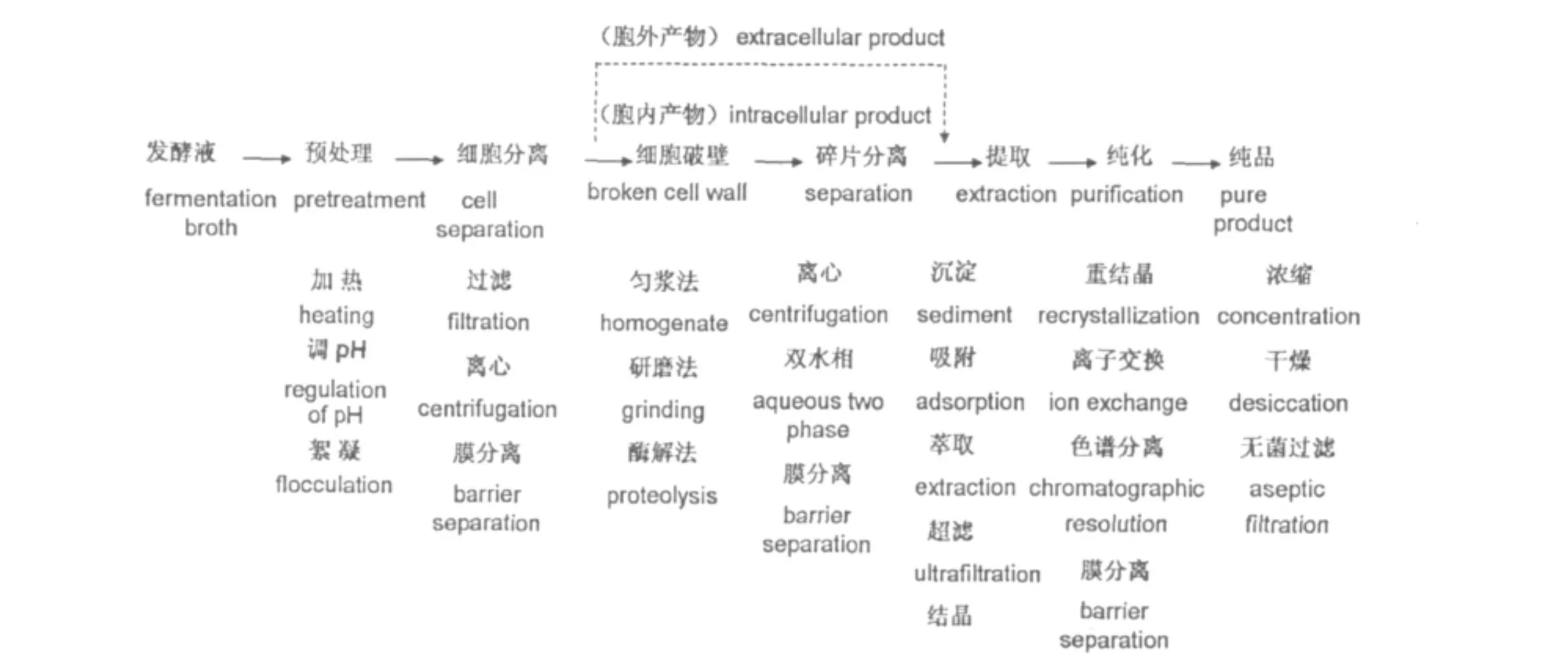
图1 微生物代谢物分离的一般工艺过程[41]Fig.1 The general separation process of microbial metabolites
菌Phomopsis sp.XZ26的液体发酵和固体发酵产物中分离并鉴定了14个化合物;李春远等[40]将混合发酵技术应用于南海红树林内生真菌E33和K38代谢产物的培养,从该提取物中分离到5个化合物,其中,3个化合物在以往分离的海洋真菌中鲜见报道。
4 产物分离纯化
研究药用植物内生真菌的主要目的是从其代谢产物中分离得到单一组分。但其发酵液成分较为复杂,需选用适当的方法将其中所含各种成分逐一分开,这也是进行理化性质、结构表征及其生物功能和活性等后续研究的基础和关键。内生真菌发酵液的一般分离过程如图1所示。
在研究药用植物内生真菌活性代谢产物结构之前必须进行纯度测定。纯度测定时,首先观察其是否形态完整、色泽均一、气味一致等,再用常用的纯度测定方法:(1)TLC:TLC是一种微量、快速的层析方法,单一化合物在TLC中表现为单一斑点。但用TLC做纯度检测时,不仅需要3种不同极性展开系统展开,还要选择三种分子间作用力不同的溶剂系统,分别展开来确定组分是否为单一斑点;(2)熔点:任何纯净的固体有机物均有一恒定的熔点,且熔点距一般不超过l℃,所以通过测定化合物熔点,根据其熔点范围可以判断未知固态有机物纯度;(3)HPLC:化合物在HPLC中表现为单一峰,一般判断其为纯品;(4)MS:特点是只给出化合物的准分子离子峰,通过正负离子的相互作用来确定分子量。如果样品不纯,就会检出多对准分子离子峰,不但确定了纯度,还能明确混杂物的分子量;(5)NMR:从氢谱中如果发现有很多积分不到一的小峰,就有可能是样品中的杂质。利用门控去偶的技术通过对碳谱的定量也能实现纯度鉴定。
5 生物活性研究
根据实验目的研究内生真菌代谢产物活性,在研究中至少需要特别注意两个方面[42]:一是尽可能对发现的活性或没有发现活性的信息进行较全面的评价,做出准确判断,避免因低水平重复造成不必要的浪费;二是要进行样品的适当积累,实现样品生物活性的长期利用,从多个生物学和药理学内容进行生物活性筛选,发现其可能存在的生物活性,实现资源的充分利用。
6 药用植物内生真菌研究存在的问题与展望
我国药用植物种类丰富,但受植物资源生长周期长、产量低等限制,很难满足人类的需要。药用植物内生真菌次生代谢产物的多样性以及其抗菌、抗肿瘤等活性的发现,为解决部分药物供不应求的现状提供了新的途径。药用植物内生真菌的研究虽然取得一定的成绩,但还存在一些问题:
(1)在内生真菌分离过程中,即使用不同的营养培养基来培养植物组织,也不能保证所有生活在植物组织内的真菌全被分离出来;(2)药用植物内生真菌通过发酵生产活性天然产物的产量较低、分离纯化难度较大,目前大多还停留在实验室的摇瓶阶段,没有实现大规模工业化生产;(3)从药用植物中筛选出的内生真菌都是野生型菌株,性状不太稳定,因此需要对其进行全面研究或遗传改造。本实验室以从药用植物温莪术根部筛选出的活性内生真菌EZG0807为出发菌株,利用超导磁体模拟空间微重力、高磁场环境对其进行诱变,以期得到遗传性状稳定的高产突变菌株[43]。(4)大多数药用植物特别是一些珍贵的药用植物尚未开展内生真菌方面的研究,这方面的工作需要加强;(5)内生真菌与宿主植物共生关系的具体机制还不清楚,需深入研究。
1 Dong JZ(董静洲),et al.Research on the resources of Chinese medicinal plants.J Med Res(医学研究杂志),2006,35:67-69.
2 Li WK(黎万奎),Hu ZB(胡之璧).Endophytes and natural medicines.Chin J Nat Med(中国天然药物),2005,3:193-199.
3 Wu J,Lin L.Enhancement of taxol production and release in Taxus chinensis cell cultures by ultrasound,methyl jasmonate and in situ solvent extraction.Appl Microbiol Biotechnol,2003,62:151-155.
4 Wang C,et al.Enhanced taxol production and release in Taxus chinensis cell suspension cultures with selected organic solvents and sucrose feeding.Biotechnol Progr,2001,17:89-94.
5 Wang C,et al.Enhancement of Taxol production and excretion in Taxus chinensis cell culture by fungal elicitation and medium renewal.Appl Microbiol Biotechnol,2001,55:404-410.
6 Strobel G,Daisy B.Bioprospecting for Microbial Endophytes and Their Natural Products.Microbiol Mol Biol Rev,2003,67:491-502.
7 Strobel GA.Rainforest endophytes and bioactive products.Crit Rev Biotechnol,2002,22:315-333.
8 Strobel GA.Microbial gifts from rain forests.Can J Plant Pathol,2002,24:14-20.
9 Castillo UF,et al.Munumbicins,wide-spectrum antibiotics produced by Streptomyces NRRL 30562,endophyticon Kennedia nigriscans.Microbiology,2002,148:2675-2685.
10 Strobel G,et al.Novel Natural Products From Rainforest Endophytes.(In):Zhang LX,Demain AL.Natural Products Drug Discovery and Therapeutic Medicine.New Jersey,Totowa:Humana Press,2005.329-351.
11 Schulz B,et al.Endophytic fungi:a source of novel biologically active secondary metabolites.Mycol Res,2002,106:996-1004.
12 Strobel GA.Endophytes as sources of bioactive products.Microbes Infect,2003,5:535-544.
13 Schulz B,Boyle C.The endophytic continuum.Mycol Res,2005,109:661-687.
14 Schulz B,et al.Microbial Root Endophytes.Soil biology.Germany:Springer-Verlag Berlin Heidelberg,2006.300.
15 Qiu M,et al.Isolation and identification of two flavonoid-producing endophytic fungi from Ginkgo biloba L.Ann Microbiol,2010,60:143-150.
16 Wang YH,et al.Bioactive metabolites from Chaetomium globosum L18,an endophytic fungus in the medicinal plant Curcuma wenyujin.Phytomedicine,2012,19:364-368.
17 Kumar S,et al.Isolation,characterization,and bioactivity of endophytic fungi of Tylophora indica.World J Microbiol Biotechnol,2011,27:571-577.
18 Ming QL,et al.Tanshinone IIA and tanshinone I production by Trichoderma atroviride D16,an endophytic fungus in Salvia miltiorrhiza.Phytomedicine,2012,19:330-333.
19 Liu K,et al.Isolation and characterization of endophytic taxol-producing fungi from Taxus chinensis.J Ind Microbiol Biotechnol,2009,36:1171-1177.
20 Silvani VA,et al.A simple method to obtain endophytic microorganisms from field-collected roots.Soil Biol Biochem,2008,40:1259-1263.
21 Zhang P,et al.An Endophytic Taxol-Producing Fungus from Taxus media,Cladosporium cladosporioides MD2.Curr Microbiol,2009,599:227-232.
22 Kumaran RS,et al.Isolation and Identification of an Anticancer Drug,Taxol from Phyllosticta tabernaemontanae,a Leaf Spot Fungus of an Angiosperm,Wrightia tinctoria.J Microbiol,2009,47:40-49.
23 Yuan Y(袁遥),et al.Study on metabolites from an endophyte of Taxus yunnnesis.Journal of Central South University of Forestry and Technology(中南林业科技大学学报),2010,30:101-105.
24 Song P(宋萍),et al.Antibacterial and antifungal activity of endophytic fungi from Tripterygiun Wilfordii.Chinese Agricultural Science Bulletin(中国农学通报),2010,26:262-266.
25 Zhao K(赵凯),et al.Isolation of a taxol-producing endophytic fungus and inhibiting effect of the fungus metabolites on HeLa cell.Mycosystema(菌物学报),2008,27:735-744.
26 Cohen SD.Technique for large scale isolation of Discula umbrinella and other foliar endophytic fungi from Quercus species.Mycologia,1999,91:917-922.
27 Hallmann J,et al.Application of the Scholander pressure bomb to studies on endophytic bacteria of plants.Can J Microbiol,1997,43:411-416.
28 Bao F(包飞),et al.The isolation and screening of Ginkgolide B-producing endophytic fungi.Acta Agriculture Borealioccidentalis Sinica(西北农业学报),2008,17:328-331.
29 McInroy JA,Kloepper JW.Studies on indigenous endophytic bacteria of sweet corn and cotton.Germany:VCH,Weinheim,1994.19-28.
30 Gagné S,et al.Xylem-residing bacteria in alfalfa roots.Can J Microbiol,1987,33:996-1000.
31 Zhang JZ(张纪忠).Microbial taxonomy(微生物分类学).Shanghai:Fudan University Press,1990.341-365.
32 Ma YM(马养民),Xu XN(徐小娜),Zhang HC(张弘驰).Isolation and identification of endophytic fungi from Ficus carica and their antimicrobial activity.China Journal of Experimental Traditional Medical Formulae(中国实验方剂学杂志),2010,16:86-89.
33 Arnold AE,Herre EA.Canopy cover and leaf age affect colonisation by tropical fungal endophytes:ecological pattern and process in Theobroma cacao(Malvaceae).Mycologia,2003,95:388-398.
34 Stone JK,et al.Endophytic Fungi.New York:Elsevier Academic Press,2004.241-270.
35 Wei JC(魏景超).The Manual of Fungal Identification(真菌鉴定手册).Shanghai:Shanghai Science and Technology Press,1979.
36 Dai FL(戴芳澜).The Morphology and Classification of Fungi(真菌的形态和分类).Beijing:Science Press,1987.
37 Wei GH(韦革宏),Yang X(杨祥).Fermentation Engineering(发酵工程).Beijing:Science Press,2008.25.
38 Guo ZY(郭志勇).Studying on the Secondary Metabolites of Seven Mangrove Endophytic Fungi from South China Sea.Guangdong:Sun Yat-sen University(中山大学),PhD.2007.
39 Lin T(林挺).Studying on the Secondary Metabolites of Four Endophytic Fungi.Xiamen:Xiamen University(厦门大学),PhD.2009.
40 Li CY(李春远),et al.Isolation and identification of the metabolites from the mixed fermentation broth of two mangrove endophytic fungi.Journal of South China Agricultural University(华南农业大学学报),2011,32:117-123.
41 Yan XK(严希康).Biochemical Separation Technology(生化分离技术).Shanghai:East China University of Science and Technology Press,1996.42 Zeper ABLZ(再帕尔·阿不力孜).The Research Methods and Techniques of Natural Products(天然产物研究方法和技术).Beijing:Chemical Industry Press,2009.326.
43 Yan JF,et al.Effect of Simulated Space Gravity Environment on Gibberella moniliformis EZG0807.Curr Microbiol,2012,64:469-476.
