浅谈药品标准执行中存在的问题及建议
2012-09-12朱洪
朱 洪
江苏省无锡市药品检验所,无锡 214021
药品标准是国家对药品的质量规格及检验方法所作的技术规定,是药品生产、流通、使用、检验及监督管理部门共同遵循的法定技术依据,其具有很强的科学性和权威性。《药品注册管理办法》[1]第一百三十六条规定:国家药品标准,是指国家食品药品监督管理局颁布的《中华人民共和国药典》、药品注册标准和其他药品标准,其内容包括质量指标、检验方法以及生产工艺等技术要求。《中华人民共和国药品管理法》[2]第三十二条明确规定:药品必须符合国家药品标准。
药品标准是各级药检所开展监督检验的依据。药品标准执行准确与否直接影响检验结果的判断。笔者结合本所日常工作实践,对药品标准执行中存在的问题浅谈一些体会,供同仁探讨。
1 执行药品标准的现状
1.1 现行药品标准的分类
药典标准:《中国药典》;局颁成册标准:国家食品药品监督管理局颁布的 《新药转正标准》、《国家药品标准》(化学药品地方标准上升国家标准)、《国家中成药标准汇编》(中成药地方标准上升国家标准);部颁成册标准:卫生部颁布的《化学药品及制剂》、《抗生素药品》、《生化药品》、《蒙药分册》、《藏药分册》、《维吾尔药分册》、《中药材》、《新药转正标准》、《中药成方制剂》;其他成册标准:各省颁布的《中药炮制规范》、国家食品药品监督管理局颁布的《药品检验补充检验方法和检验项目批准件汇编》(2003~2008 年)、《中国医院制剂规范》等;非成册的各类散页标准:包括国家药品标准颁布件、修订件、补充批件,国家食品药品监督管理局颁布的试行标准及转正标准、原国家药品监督管理局颁布的试行标准、药典委员会颁布的卫典业发及药典业发文件所附的标准等。
1.2 药品标准的执行情况
1.2.1 药典品种标准的执行情况 《中国药典》2010年版已由卫生部2010年第5号公告颁布,自2010年10月1日起执行。国家局(2010)第43号“关于实施《中国药典》2010年版有关事宜的公告”[3]中规定:“凡中国药典收载的品种,自执行之日起,原收载于历版药典、卫生部颁布药品标准、国家食品药品监督管理局颁布新药转正标准和地方标准上升国家标准的同品种药品标准同时废止。对于药品注册标准中收载的检验项目多于中国药典规定的或质量指标高于中国药典要求的,在执行中国药典的基础上,应同时执行原标准的相应项目和指标。中国药典品种项下未收载的制剂规格,其质量标准按中国药典同品种相关要求执行,规格项按原批准证明文件执行。”但在执行国家局(2010)第43号公告的过程中,对与药典中品名相同、规格不同或者品名规格均相同而注册标准高于药典的品种,药检所缺乏了解相关产品的信息,无法直接确认标准的执行情况,须向企业质量部门进一步了解该品种的实际质量要求,由企业提供相关品种标准引用的证实材料,以保证检验机构正确、有效地执行“药典与注册标准”双标准的相关指标项目。如陕西某药厂生产的调经促孕丸,其名称、规格均与药典一致,原本认为按《中国药典》2010年版相关品种执行即可,但是本所在核实说明书信息时发现,并不仅仅执行药典标准,该说明书执行标准项显示为执行《中国药典》2010年版一部(全检)及国家食品药品监督管理局标准(试行)YBZ15742005(鉴别茯苓、桑寄生),即与药厂联系,了解到该品种注册标准(本所无此标准)的鉴别项较药典标准增加了茯苓、桑寄生的薄层色谱鉴别,即注册标准的鉴别指标项目多于药典,故本所依据国家局(2010)第43号公告的指导原则确认结果为执行 《中国药典》2010年版一部的全部项目和注册标准YBZ15742005中的茯苓、桑寄生鉴别项。
1.2.2 非药典品种标准的执行情况 同一品种,由于生产工艺差别,就有不同标准。在统一工艺基础上,才能有统一标准,这往往要花很长时间,这一状况,中药尤甚。另外,时代在前进,技术在进步,政策也在改变。因此,药检所无法直接辨别和确认各品种标准执行的适用性,只能借助相应品种说明书注明的性状、规格、执行标准项等内容,查询与之信息符合的执行标准。若引用不清楚或无标准(多为散页标准),则需与当地药检机构或生产企业联系沟通,索要现行有效的注册批件及标准,类似情况在监督抽验中经常发生,而联系渠道的不畅直接影响检验周期、监督执法的工作效力。
2 执行药品标准中存在的问题
2.1 缺乏权威、统一的标准信息查询管理系统
目前,国家尚未建立有效、快捷、权威的标准信息查询的共享平台,各药检机构只能自建内部网络使用的标准检索库,鉴于标准获取的渠道和时间各有差异,收集的标准信息也不统一,给药品检验的标准适用带来一定的困难。
2.2 同一品种多个标准
药品标准中,同一个品种多个执行标准的状况存在已久,亟待规范和统一。现以本所标准库中两个品种为例,将其多个质量标准进行比较,见表1、表2。
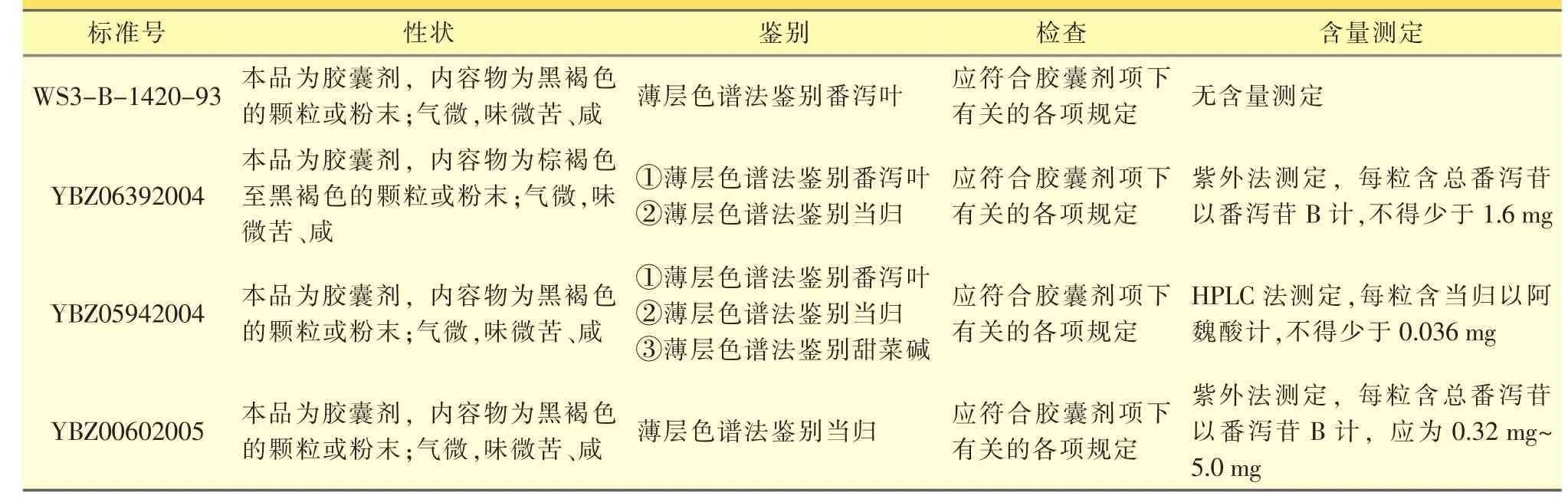
表1 通便灵胶囊多个标准的比较

表2 感冒软胶囊多个标准的比较
由表1可见,通便灵胶囊的处方为番泻叶1200 g,当归150 g,肉苁蓉 150 g,上述四个标准中,除检查项一致,性状、鉴别、含量测定等质控指标的设置各有不同,其中标准WS3-B-1420-93中无含量测定指标,难以保证质量的有效控制。
由表2可见,感冒软胶囊的处方包括羌活、麻黄、桂枝、荆芥穗、防风、白芷、川芎、石菖蒲、葛根、薄荷、苦杏仁、当归、黄芩、桔梗等14味中药,性状、检查项内容一致,标准YBZ09392004、YBZ03972008的鉴别指标较标准WS3-B-1256-92增加了白芷、黄芩苷的薄层鉴别,含量测定涉及的活性成分质控指标均不相同,其中标准起点较低的WS3-B-1256-92中未设置有效成分的含量测定。
2.3 说明书中标注的执行标准不完整
由于同一品种多个标准,药检所在查询标准的过程中常以药品说明书中注明的执行标准作参考,但不同厂家说明书的执行标准书写格式各不相同,缺乏规范和统一,有的执行标准对版本、册数和标准编号均有标注,有的说明书执行标准只写了标准编号或只写了版本,甚至个别说明书标注过于模糊,无法核实标准的执行情况,如某药厂生产的感冒清胶囊说明书中执行标准项仅标注为“国家药品监督管理局国家药品标准”。
2.4 标准收集不全,索取标准困难
在地市级药检所中,药品标准除成册标准是以统一征订的形式获取外,散页标准的收集渠道不通畅,如药典委员会网站公布、《中国药品标准》杂志上刊登、主管部门转发标准等,更多是与生产厂家联系索要标准。2011年本所在进行监督抽样中索取散页标准280份,但其收集、核实标准的信息渠道并不畅通,多以说明书上的登记电话开始联系,且登记的电话多为销售部门,经过反复转接才能找到企业的质管部门,在提供标准的过程中,企业多为传真批件及标准,但有时传真件模糊,尤其是关键数据不清,又只能电话询问,个别企业因多家药检所联系标准提供事宜则表现出不耐烦的情绪,而作为检验部门对此标准确认方式也觉得缺乏严肃性,但也无奈,且有些企业不配合致使“索标”周期长达半个多月甚至更长,难以保证监督检验的及时性。
2.5 试行标准转正不及时
试行标准未按期转正的问题较为普遍,许多已超过法定转正年限的试行标准仍在使用,有的试行标准试行期已超过8年以上,如本所2011年监督抽验的一品种“谷胺酰胺颗粒”的执行标准为国家药品监督管理局试行标准WS-903(X-722)-2001(本标准自2002年2月20日起试行2年),一直未转正,该厂此品种于2010年8月经当地省局再注册后其试行标准继续使用。究其原因:一方面企业考虑自身利益不愿主动及时转正,以免公示的正式标准被他厂运用生产;另一方面生产厂家解释为转正申请已受理或正处审批之中,以致企业注册的现行标准中具有相当比例未按期转正的试行标准。
3 建议与讨论
3.1 建立科学的标准管理机制
国家应尽快完善药品标准的管理体系,建立科学的标准管理机制,规范药品标准的制定、修订、发布和执行工作。建议设立专门的药品标准查询机构和药品标准网络查询系统,充分发挥互联网的资源共享作用,为药品检验使用者提供现行有效的药品标准及最新的修订信息,确保药品检验的可靠性与权威性。进一步强化药品标准管理的问责制,充分保持信息渠道的上下畅通,方便药品检验部门准确、快捷地开展检验工作,及时为执法监督提供有效的技术支撑。
3.2 统一相同品种的药品标准
建议国家相关部门尽快梳理药品标准中存在已久的同品种不同质量标准的状况,规范统一各品种药品标准,真正做到对不同厂家相同品种内在质量进行公正有效的评价,以确保临床用药的安全和有效。
3.3 依法行政,按期办理试行标准的转正审批
由于目前国家未对试行标准的转正期限具有强制性的管理要求,导致试行标准继续使用的状况存在较多。建议国家药品标准审批部门应依法行政,按期办理试行标准的转正审批。采取强制的试行标准转正管理办法,全面整顿历史遗留的大量未按期转正的试行标准,尽快统一标准的适用性。对于试行标准的药品应严格按照规定的试行期限进行转正,不符合转正条件的应停止原试行标准的执行。确保检验部门正确使用现行有效的法定标准。
[1]药品注册管理办法 [S].国家食品药品监督管理局令第28 号,2007.
[2]药品管理法[S].中华人民共和国主席令第45号,2001.
[3]关于实施《中国药典》2010年版有关事宜的公告[Z].国家食品药品监督管理局公告第43号,2010.