耐力训练对大鼠FTO基因表达影响及与摄食量关系研究The Relationship between FTO Gene Expression and Food Intake by Endurance Training in Rats
2012-09-12马国栋刘艳环王秋灵
马国栋,铁 钰,刘艳环,王秋灵,赵 宁
MA Guo-dong1,TIE Yu2,LIU Yan-huan1,WANG Qiu-ling1,ZHAO Ning1
耐力训练对大鼠FTO基因表达影响及与摄食量关系研究
The Relationship between FTO Gene Expression and Food Intake by Endurance Training in Rats
马国栋1,铁 钰2,刘艳环1,王秋灵1,赵 宁1
MA Guo-dong1,TIE Yu2,LIU Yan-huan1,WANG Qiu-ling1,ZHAO Ning1
目的:研究耐力训练对大鼠FTO基因表达的影响以及与摄食量的关系。方法:以SD大鼠为研究对象,将大鼠分为对照组(C组)和运动训练组(E组),以12周无负重游泳为运动手段,测定肝脏、骨骼肌、脂肪组织和下丘脑组织中FTO基因mRNA表达、大鼠体重、肾周与附睾周围脂肪重量及脂肪重量与体重百分比、大鼠每天摄食量。结果:FTO基因mRAN在骨骼肌、脂肪组织和下丘脑中表达均显著高于肝脏组织,下丘脑显著高于骨骼肌和脂肪组织,脂肪组织与骨骼肌未见显著性差异,耐力训练对肝脏、骨骼肌和脂肪组织中FTO基因mRNA表达未见显著性影响,而脑组织表达显著升高;大鼠体重在不同的对应时间点,运动训练组与对照组未见显著性差异;大鼠摄食量在不同对应时间点,运动训练组显著高于对照组;肾周及附睾周围脂肪组织重量及脂肪重与体重百分比运动训练组显著低于对照组。结论:耐力训练可以提高下丘脑中FTO基因表达,从而刺激大鼠提高摄食量,而运动能量的消耗抵消了因摄食增加引起的体重增加。
耐力训练;脂肪质量与肥胖相关基因;大鼠;摄食量
随着人们生活水平的提高和生活习惯的改变,肥胖的发病率显著升高,肥胖已经成为世界性的公共卫生问题。据估计,到2030年,大约有58%的成年人出现超重或肥胖[1]。肥胖不仅是引起许多疾病如心脏病、糖尿病、癌症等等的重要因素,而且还会引起一系列的社会问题,因此,研究肥胖的发生机制不仅是一个科学问题而且是一个很重要的社会问题和经济问题。肥胖不仅与环境、饮食习惯、生活习惯有关,而且与遗传关系密切。最近研究发现,脂肪质量与肥胖相关基因(fat mass and obesity-associated protein(FTO))与肥胖关系密切[2]。FTO基因是非-血红素加双氧酶超家族的成员[3]。小鼠缺少FTO基因会增加出生后的致死率,生长延迟,脂肪组织质量和体积减小,能量消耗增加,阻止高脂饮食引起的肥胖[4],这说明,FTO基因表达减少或功能丧失会抑制肥胖。FTO在体内广泛表达,包括大脑、肌肉、肝脏、脂肪组织等,其中,大脑的下丘脑表达最高[5],但FTO基因在不同组织中表达意义尚不完全清楚,一些研究认为,FTO基因在下丘脑、肝脏和骨骼肌中表达与摄食量、食欲和能量消耗有关[6,7],在脂肪组织中表达则与脂肪形成有关[4]。另有研究表明,FTO敲除鼠出现明显的、快速的生长抑制,说明FTO基因还与生长发育有一定的关系[8]。目前,关于FTO与肥胖的关系方面的研究主要集中在FTO基因变异与肥胖的关系。也有一些研究运动对不同FTO基因型体重的影响,但结果并不一致。Kilpelainen T O等人[9]通过meta综合分析发现,运动可以降低因FTO变异引起肥胖风险,从而说明运动对FTO基因产生积极的影响。但目前关于运动对不同组织中FTO基因表达及与摄食量关系如何,尚鲜有报道。本研究拟选择FTO基因表达意义较为清楚的骨骼肌、下丘脑、肝脏和脂肪组织作为研究材料在这一方面进行探讨。
1 材料与方法
1.1 实验设计
雄性6周龄SD大鼠24只,购自北京大学医科部实验动物中心。每天光照均为12h,自由饮水。实验动物随机分为2组:1)对照组(C,n=12,体重184±4.22g);2)12周游泳运动组(E,n=12,体重186±4.37g)。饲喂普通正常大鼠饲料。每一组在实验结束,禁食12h麻醉处死,取肝脏、肌肉、下丘脑和肾周及附睾周围脂肪组织,立即放于液氮中,然后在-20℃冰箱保存,以备测定FTO基因mRNA表达。
1.2 耐力训练模型
游泳运动方案:采用无负重游泳训练,水温(29℃±2℃),以直径50cm,水深65cm大塑料桶为游泳场所,每次放入4只大鼠,为保证训练质量,避免大鼠偷懒行为,在训练的过程中,对偷懒大鼠用毛刷进行刺激,保证训练的强度和运动量。第1周每天运动0.5h,第2周增至1h,从第3周开始增至1.5h,每周5次,共训练12周。
1.3 大鼠摄食量及体重的测量
每周在周1、周3和周5测量一天的进食量,取3天的平均值,作为1周每天的摄食量;每周在周日测量大鼠体重1次。
1.4 大鼠脂肪量的测定
麻醉处死大鼠后,取大鼠肾周及附睾周的脂肪垫,用电子秤秤量脂肪的重量。
1.5 肝脏、下丘脑、骨骼肌和脂肪组织mRNA表达测定
以上述的肝脏、下丘脑、骨骼肌和脂肪组织,用Trizol Reagent试剂盒(Mrcgene产品)与逆转录试剂盒(Ferment产品)参照说明书进行逆转录反应,以备用于FTO基因mRNA的扩增。采用PE-9600(PE-Cetus Co,USA)PCR扩增仪扩增mRNA表达,自行设计引物:
FTO:上游:5’-CACTTGGCTTCCTTACCTGACCCCC-3’
下游:5’-GGTATGCTGCCGGCCTCTCGG-3’
β-actin:上游5’-TGGTGGGTATGGGTCAGAAGGAC-TC-3’
下游5’-CATGGCTGGGGTGTTGAAGGTCTCA-3’
反应参数:96℃预变性5min,然后进行如下5个循环,95℃30s,45℃45s72℃45s,然后进行25个循环,变性温度与延伸温度不变,终末延伸72℃7min。
1.6 统计学分析
利用SPSS统计软件(SPSS11.5for Windows)处理,计算均值和标准差±SD)。两组中,基因表达及脂肪含量采用独立样本t检验,不同时间体重和食物摄入量采用单因素方差分析,显著性定为P<0.05。
2 结果
2.1 大鼠体重变化
训练与未训练大鼠体重各对应时间点间进行比较未见显著性改变(图1)。
2.2 大鼠摄食量的变化
运动训练组与未训练组组内比较:随年龄的延长大鼠摄食量逐渐增加,并且增加量明显;运动训练组与未训练组大鼠组间比较:在每一个对应时间点,运动训练组大鼠摄食量显著高于未训练组大鼠(图2)。
2.3 大鼠脂肪量的变化
运动组大鼠肾周及附睾周脂肪含量与脂肪占体重的百分比均显著低于对照组(表1)。
2.4 大鼠肝脏、肌肉、脂肪和下丘脑FTOmRNA表达变化
不同组织间比较:无论是对照组还是运动组,大鼠骨骼肌、脂肪组织和下丘脑FTO基因mRNA表达显著高于肝脏组织,下丘脑显著高于骨骼肌和脂肪组织,骨骼肌与脂肪组织间未见显著性差异;运动组与对照组比较:下丘脑FTO基因mRNA表达运动组显著高于对照组,而其他组织未见显著性改变(图3)。
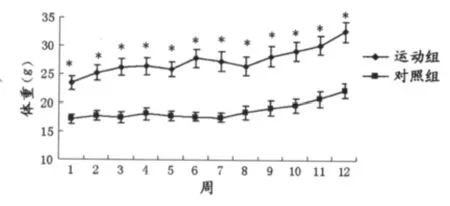
图2 对照组与训练组大鼠每天平均摄食量变化示意图Figure 2. The Change of Average Food Intake per Day in Control and Trained Group Rats±SD)

表1 对照组与训练组大鼠脂肪重量变化一览表Table 1 The Change of Fat Weight in Control and Trained Group Rats(X±SD)

图3 对照组和训练组大鼠FTO基因在不同组织中的表达示意图Figure 3. The FTO Gene Expression in Different Tissues in Control and Trained Group Rats
3 讨论
从能量平衡的角度,体重的增加与能量摄入增加有关,如果能量摄入大于能量的消耗则体重增加,相反则体重降低,因此,是否体重增加其关键在于能量摄入平衡的改变。本研究发现,大鼠经过12周后,运动组与对照组大鼠在相同对应时间点上体重并没有显著性差异,说明这两种方式的能量摄入与消耗平衡是一致的。这似乎与常识相矛盾,一般认为,长时间运动会降低体重,但这需要有一个前提条件,即保证能量摄入小于运动消耗。本研究发现,运动组大鼠的摄食量显著高于对照组,尽管运动消耗了更多的能量,但由于摄食量的增加,抵消了运动消耗的能量,其结果是体重未出现显著性差异。这一结果也提示我们,在运动减肥或控制体重的过程中,一定要坚持运动与控制饮食相结合的原则,否则难以达到理想的效果。有趣的是,本研究尽管发现大鼠体重在两组中无显著性差异,但其肾周及附睾周脂肪重量及与体重比值运动组显著低于对照组,这说明运动尽管未改变体重的变化,但改变了身体的成分,使运动组的去脂体重增加。
适量运动增加摄食量已经成为不争的事实,但其机理尚不完全清楚。FTO基因的发现可能为此提供了新的理论根据。FTO基因是2007年发现的一个与肥胖关系密切的基因。FTO基因位于16号染色体上,在人体内存在不同的等位基因。FTO基因的变异与肥胖关系密切,其中,rs 9939609位点上的等位基因SNP变异与肥胖更为密切,携带肥胖风险变异的AA纯合子个体患肥胖的风险会显著增加,而即使是杂合子即AT,其肥胖的风险也相对较高。许多研究均证实[10],rs9939609位点等位基因的改变与BMI、体重及皮下脂肪等密切相关,在不同的种族中,包括欧洲人、亚洲人等均存在这一关系。FTO在体内广泛表达,包括大脑、骨骼肌、肝脏、脂肪、心肌、肺、肾脏、脾脏等器官与组织,其中,下丘脑表达最高[5]。本研究也在不同组织中发现,FTO基因表达的组织差异性,肝脏最低,骨骼肌和脂肪组织次之,下丘脑表达最高,而下丘脑是调节能量代谢平衡的主要神经中枢,控制着食欲与摄食量,说明FTO基因在下丘脑中表达与能量代谢及摄食量等关系更为密切。许多研究主要集中在FTO基因rs9939609位点SNP基因变异与BMI、体重、摄食量、能量代谢关系等方面[11-13],而直接研究FTO基因表达与肥胖的关系的报道较少。Fischer等[14]2009年首次在Nature上证实FTO基因表达与能量平衡与肥胖的关系,笔者分析了对照组与FTO基因敲除组小鼠的身体成分,FTO基因敲除鼠脂肪质量在雄性和雌性中分别降低了60%和23%。尽管去脂体重也受到了影响,但其影响程度比脂肪要低,去脂体重在雄性和雌性小鼠中分别降低26%和19%。在15个月龄小鼠性腺周围的白色脂肪组织几乎完全消失(此处的白色脂肪组织随年龄增加而增加)。在FTO基因敲除鼠中,脂肪细胞体积明显减小。当饲喂高脂膳食时,FTO基因敲除鼠体重增长显著低于对照组,表明FTO基因表达降低能够抵御肥胖的形成。Fischer等[14]的研究结果表明,FTO基因敲除能够阻止肥胖形成,这预示着FTO基因的变异可能调控其基因的表达,从而使某些等位基因类型的人更易肥胖,而另一些人不容易肥胖。Gerken等[5]研究发现,下丘脑中FTO减少60%的小鼠明显具有拒绝进食的特点,说明FTO对食欲的控制具有十分重要的作用。通过转染或siRNA技术影响FTO基因在下丘脑表达会影响到食物的摄入量,降低FTO表达会增加食物摄入,反之,则减少食物摄入[17]。Church等[6]从FTO基因过表达的角度,进一步证实FTO基因表达与肥胖的关系:FTO基因在下丘脑、骨骼肌、脂肪组织、肝脏等组织过量表达能够增加体重和脂肪重量,而且这种增加与FTO表达存在着量效关系,表达越高,体重及脂肪重量增加越明显。在雌性大鼠中不管饲喂高脂饲料还是正常饲料,体重均随FTO基因表达而增加,大鼠体重与脂肪重量的增加与能量摄入增加有关。另外,Caruso,V等[18]研究证实,雌性SD大鼠在交配前5周和怀孕期以及哺乳期饲喂高脂膳食,使大鼠肥胖,此大鼠所生幼仔在出生20天后断奶,在断奶时肥胖大鼠所生幼仔下丘脑和肝脏FTO基因mRNA表达显著高于对照组,并且其表达量与内脏和外周脂肪质量呈显著正相关。不仅在啮齿类动物中FTO基因表达与肥胖有关,而且在人类中,FTO基因在肥胖者的脂肪组织中其表达水平也显著高于体重正常个体[19]。正如Tews等[20]认为的那样,尽管FTO基因作用还存在着许多争论,但通过目前许多的研究结论可以看出,FTO控制体重的主要作用在于控制食物摄入和调控食欲。
FTO基因控制肥胖的调控机理尚不清楚。一些研究表明,FTO基因可以通过脂解作用调节身体脂肪质量[21],体外研究表明,FTO的去甲基化酶功能影响DNA/RNA,进而影响脂肪水解,这可能是FTO调节身体脂肪质量的潜在机制[5,22,23]。最近的研究进一步证实了这一点,FTO作为共转录激活因子增强了增强子上的CCAAT序列与结合蛋白的结合,而这一结合蛋白主要调节脂肪生成[24]。
FTO基因与肥胖及运动的关系密切,一些研究表明,长时间的运动可以降低携带FTO易肥胖的等位基因人类群体的BMI指数[25],而另外的一些研究得出与此不同的结果[26,27]。Kilpelainen T O等通过meta综合分析了45项成年人(n=218 166)的研究和9项儿童和青少年(n=19 268)的研究,所有的研究均涉及rs9939609基因位点变异,参加人群中有25%成年人和13%儿童和青少年未参与运动。在成年人中,rs9939609等为基因中含有A等位基因的人群其肥胖的趋势增加了1.23倍,而运动显著降低这种趋势,而且在含有A等位基因的运动人群比不运动人群更不容易肥胖[28]。这些研究仅仅从运动对FTO基因不同等位基因影响肥胖及摄食量的关系方面进行了探讨,均未涉及FTO基因表达与体重及摄食量的关系。运动对不同组织中FTO基因表达如何以及与体重与摄食关系如何尚未见报道。本研究发现,经过12周的游泳训练后,大鼠肝脏、骨骼肌和脂肪组织中FTO基因表达未见显著性差异,而下丘脑FTO基因mRNA表达运动组显著高于对照组。下丘脑是调控能量摄入与平衡的神经中枢,本研究也证明了这一点。运动组大鼠摄食量显著升高,并且,这种升高与下丘脑FTO基因表达存在着明显的一致性,说明运动导致大鼠摄食量增加与下丘脑中FTO基因表达增加有关,这也从另一个角度解释了运动增加食欲的原因。运动作为一种对机体影响广泛的干预方式,其作用应该也是广泛的,但本研究中发现,耐力训练并未改变骨骼肌、肝脏和脂肪组织FTO基因的表达,而仅仅影响下丘脑的表达,说明其表达调控具有组织特异性特点。遗憾的是,目前关于运动调控FTO表达的机制尚未见报道,推测可能与IGF-1有关,因为FTO基因敲除鼠血液中IGF-1水平显著低于对照鼠[8],其确切机理尚需进一步研究(我们在这方面的工作也已经开始)。
4 结论
耐力训练可以提高大脑中FTO基因表达,从而刺激大鼠提高摄食量,运动能量的消耗抵消了因摄食增加引起的体重增加。
[1]KELLY T,YANG W,CHEN C S,et al.Global burden of obesity in 2005and projections to 2030[J].Int J Obes(Lond),2008,32(9):1431-1437.
[2]DINA C,MEYRE D,GALLINA S,et al.Variation in FTO contributes to childhood obesity and severe adult obesity[J].Nat Genet,2007,39(6):724-726.
[3]BOISSEL S,REISH O,PROULX K,et al.Loss-of-function mutation in the dioxygenase-encoding FTO gene causes severe growth retardation and multiple malformations[J].Am J Hum Genet,2009,85(1):106-111.
[4]FISCHER J,KOCH L,EMMERLING C,et al.Inactivation of the Fto gene protects from obesity[J].Nature,2009,458(7240):894-898.
[5]GERKEN T,GIRARD C A,TUNG Y C,et al.The obesity-associated FTO gene encodes a 2-oxoglutarate-dependent nucleic acid demethylase[J].Sci,2007,318(5855):1469-1472.
[6]CHURCH C,MOIR L,MCMURRAY F,et al.Overexpression of Fto leads to increased food intake and results in obesity[J].Nat Genet,2010,42(12):1086-1092.
[7]TUNG Y C,AYUSO E,SHAN X,et al.Hypothalamic-specific manipulation of Fto,the ortholog of the human obesity gene FTO,affects food intake in rats[J].PLoS One,2010,5(1):e8771.
[8]GAO X,SHIN Y H,LI M,et al.The fat mass and obesity associated gene FTO functions in the brain to regulate postnatal growth in mice[J].PLoS One,2010,5(11):e14005.
[9]KILPELAINEN T O,QI L,BRAGE S,et al.Physical activity attenuates the influence of FTO variants on obesity risk:a metaanalysis of 218,166adults and 19,268children[J].PLoS Med,2011,8(11):e1001116.
[10]WOEHNING A,SCHULTZ J H,ROEDER E,et al.The A-allele of the common FTO gene variant rs9939609complicatesweight maintenance in severe obese patients[J].Int J Obes(Lond),2012,Feb 7.doi 10.1038/ifo[Epub abead of print].
[11]ZHOU D,LIU H,ZHOU M,et al.Common variant(rs9939609)in the FTO gene is associated with metabolic syndrome[J].Mol Biol Rep,2012,29(6):6555-6561.
[12]ZIMMERMANN E,SKOGSTRAND K,HOUGAARD D M,et al.Influences of the common FTO rs9939609variant on inflammatory markers throughout a broad range of body mass index[J].PLoS One,2011,6(1):e15958.
[13]EWENS K G,JONES M R,ANKENER W,et al.FTO and MC4Rgene variants are associated with obesity in polycystic ovary syndrome[J].PLoS One,2011,6(1):e16390.
[14]FISCHER J,KOCH L,EMMERLING C,et al.Inactivation of the Fto gene protects from obesity[J].Nature,2009,458(7240):894-898.
[15]FRAYLING T M,TIMPSON N J,WEEDON M N,et al.A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity[J].Sci,2007,316(5826):889-894.
[16]GUO Y,LIU H,YANG T L,et al.The fat mass and obesity associated gene,FTO,is also associated with osteoporosis phenotypes[J].PLoS One,2011,6(11):e27312.
[17]TUNG Y C,AYUSO E,SHAN X,et al.Hypothalamic-specific manipulation of Fto,the ortholog of the human obesity gene FTO,affects food intake in rats[J].PLoS One,2010,5(1):e8771.
[18]CARUSO V,CHEN H,MORRIS M J.Early hypothalamic FTO overexpression in response to maternal obesity--potential contribution to postweaning hyperphagia[J].PLoS One,2011,6(9):e25261.
[19]LAPPALAINEN T,KOLEHMAINEN M,SCHWAB U,et al.Gene expression of FTO in human subcutaneous adipose tissue,peripheral blood mononuclear cells and adipocyte cell line[J].J Nutrigenet Nutrigenomics,2010,3(1):37-45.
[20]TEWS D,FISCHER-POSOVSZKY P,WABITSCH M.FTOFriend or foe?[J].Horm Metab Res,2010,42(2):75-80.
[21]WAHLEN K,SJOLIN E,HOFFSTEDT J.The common rs9939609gene variant of the fat mass-and obesity-associated gene FTO is related to fat cell lipolysis[J].J Lipid Res,2008,49(3):607-611.
[22]JIA G,YANG C G,YANG S,et al.Oxidative demethylation of 3-methylthymine and 3-methyluracil in single-stranded DNA and RNA by mouse and human FTO[J].FEBS Lett,2008,582(23-24):3313-3319.
[23]HAN Z,NIU T,CHANG J,eta l.Crystal structure of the FTO protein reveals basis for its substrate specificity[J].Nature,2010,464(7292):1205-1209.
[24]WU Q,SAUNDERS R A,SZKUDLAREK-MIKHO M,et al.The obesity-associated Fto gene is a transcriptional coactivator[J].Biochem Biophys Res Commun,2010,401(3):390-395.
[25]VIMALESWARAN K S,LI S,ZHAO J H,et al.Physical activity attenuates the body mass index-increasing influence of genetic variation in the FTO gene[J].Am J Clin Nutr,2009,90(2):425-428.
[26]BERENTZEN T,KRING S I,HOLST C,et al.Lack of association of fatness-related FTO gene variants with energy expenditure or physical activity[J].J Clin Endocrinol Metab,2008,93(7):2904-2908.
[27]JONSSON A,RENSTROM F,LYSSENKO V,et al.Assessing the effect of interaction between an FTO variant(rs9939609)and physical activity on obesity in 15,925Swedish and 2,511 Finnish adults[J].Diabetologia,2009,52(7):1334-1338.
[28]KILPELAINEN T O,QI L,BRAGE S,et al.Physical activity attenuates the influence of FTO variants on obesity risk:a meta-analysis of 218,166adults and 19,268children[J].PLoS Med,2011,8(11):e1001116.
Objective:To investigate the relationship between FTO gene expression and intake food by endurance training in rats.Methods:The rats were randomly divided into control and endurance trained group.This paper analyzed the mRNA expression of FTO in liver and skeletal muscle,adipose tissue and hypothalamus,body weight,adipose tissue weight around kidney and epididymis,average food intake per day in rats after 12week unload swimming training.Results:The FTO gene mRNA expressions in skeletal muscle,adipose tissue and hypothalamus were higher than in liver,its expression in hypothalamus was higher than in skeletal muscle and adipose tissue,but its expression in skeletal muscle and adipose tissue was no significant different.Endurance training up-regulated FTO gene expression in hypothalamus,however,there was no change in skeletal muscle,liver and adipose tissue.The rat weight was no significant different in parallel time point,but food intake significantly increased in trained rats.Adipose tissue weight around kidney and epididymis decreased significantly in trained rats.Conclusion:Endurance training increased the FTO gene expression in hypothalamus which stimulated more food intake.However,the rat weight was no change for exercise expending more energy.
endurance training;fat mass and obesity-associated protein gene;rats;food intake
book=185,ebook=2
G804.7
A
2012-03-26;
2012-05-18
山东理工大学青年教师发展支持计划(110026)。
马国栋(1974-),男,山东临沂人,副教授,博士,主要研究方向为运动健康与促进,Tel(0533)2786023,E-mail:mgdtj@sina.com;铁钰(1978-),男,蒙古族,辽宁沈阳人,讲师,博士,主要研究方向为体育教育训练学,E-mail:xyhwty@163.com;刘艳环(1971-),女,吉林白城人,讲师,硕士,主要研究方向为运动与健康促进,Tel(0533)2786023,E-mail:mgdtj@126.com。
1.山东理工大学体育学院,山东淄博255049;2.辽宁
师范大学体育学院,辽宁大连116029
1.Shandong University of Technology,Zibo 255049,China;2.Liaoning Normal University,Dalian 116029,China.
