苹果园镰螯螨种群的时空动态分析
2012-09-11崔晓宁沈慧敏郑开福张新虎
崔晓宁, 沈慧敏, 郑开福, 张新虎
(甘肃农业大学草业学院,兰州 730070)
镰螯螨属(Tydeus)隶属于真螨目(Acariformes)、镰螯螨科(Tydeidae)[1-2]。镰螯螨是具有植食性和捕食性的特殊螨类类群,低温和光照能使其滞育,瘿螨、粉虱、菌类微生物均可以作为食料[3-4]。果园中常分布在树皮裂缝、芽腋以及被害虫为害的叶片内越冬,呈现聚集分布[3]。国内外对镰螯螨的研究较少,主要集中在分类特征和生物学方面[5-10],关于果园内种群发生规律和空间动态方面的报道还没有。该螨在甘肃省果园、林木和行道树上广泛分布,且具有一定的种群密度。为了明确镰螯螨种群在果园生态系统中的地位、作用及其与叶螨、芬兰真绥螨种群的相互关系,为制定果园有害生物综合治理方案、充分发挥生态系统的自然控制能力和捕食螨在叶螨种群数量控制中的作用提供依据,作者对苹果园镰螯螨种群的时空动态进行了调查和分析。
1 材料与方法
1.1 调查地点及方法
试验地设在甘肃省天水市麦积区马跑泉镇桥南附近的苹果园,该果园整体面积约13340m2。由于多年来苹果栽培的效益降低,果农们弃农经商,致果园荒废达5年之久,已经接近自然环境条件下的果园,不喷施任何农药和进行农事操作。但叶螨、镰螯螨、芬兰真绥螨及其他螨类种群较为丰富,芬兰真绥螨对叶螨的控制作用相当明显。因此从中选取树形、树势较好的长方形地块,面积约536m2,树龄10年,作为试验地点进行观察和采样调查。从2010年7月1日开始到10月16日结束,每15d调查1次,累计调查8次。按照平行线法固定长势一致的6株果树(即6次重复),每株树冠按照东、南、西、北、中5个方位及上、中、下3层调查,共15个部位。每个部位随机选取10个叶片,每株树共计150个叶片,带回实验室,观察记录每个叶片上活动螨的种类和数量。
1.2 数据分析
根据调查数据,以螨口密度(头/百叶)为纵坐标,调查日期为横坐标绘制趋势图,分析镰螯螨种群在苹果园的消长动态。空间格局分析:计算平均密度(m)、方差(S2)和平均拥挤度(m*)。采用Beall扩散系数(C)、Cassie指标(Ca)、Water负二项分布参数(K)、Lloyd聚集度指标(m*/m)等测定镰螯螨种群的空间分布型[11-13]。应用Iwao的回归模型(m*=a+βm)进一步分析空间格局[14];以C和m*/m 为指标,考察种群聚集度的时序变化。
2 结果与分析
2.1 镰螯螨的种群消长动态
图1、2可以看出:在苹果树冠不同方位和高度,镰螯螨种群数量均随时间的推移表现为先升高后降低的趋势。8月1日是镰螯螨种群发生高峰期,树冠东面和上层种群数量最大,分别达到1080.00头/百叶和868.00头/百叶,到9月1号调查时,树冠南面和下层已经下降到172.78头/百叶和160.33头/百叶。9月1日-10月1日,种群数量基本稳定在一定水平,10月16日种群数量降至最低,树冠西面、上层和下层每百叶有螨数分别为:3.33、16.00头和16.00头。8月1日调查时,种群数量在树冠东面高于南面、西面、北面和内膛,上层和中层高于下层,其原因与镰螯螨喜高温和长光照时间的生活习性有关,东面和上层树冠温度和光照较其他部位优越。其余各时间段之间比较,无论是不同方位之间还是不同高度之间种群数量变化差异不大。
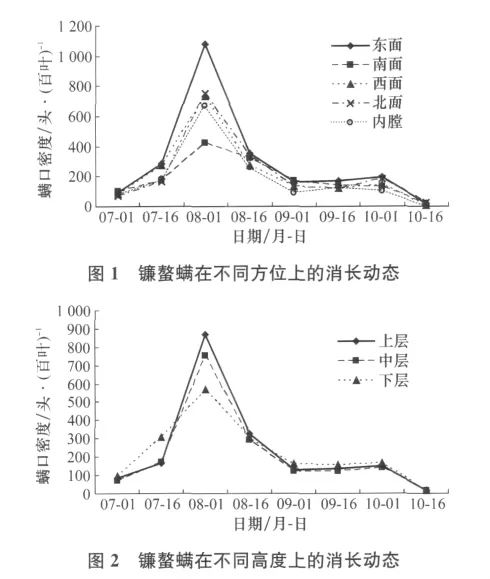
2.2 镰螯螨种群的分布格局
从表1和表2可以看出:7—10月镰螯螨种群在苹果树冠垂直方向上的空间分布测定指标分别为:I>0,Ca>0,m*/m>0,C>1,即镰螯螨种群在树冠垂直方向上为聚集分布。8月1日时,种群平均密度(m)、平均拥挤度(m*)、扩散系数(C)、丛生指数(I)均为最大,这个时期镰螯螨种群数量最多,是发生高峰期。此期生态系统内叶螨的数量随着捕食螨种群数量的快速上升而急剧下降,从9月1日到10月1日,叶片营养下降,叶片上腐生菌类和叶螨数量降低,捕食螨的捕食压力也向镰螯螨倾斜,镰螯螨种群数量有所降低,平均密度和平均拥挤度均减小,稳定在一定动态水平。到10月中旬,环境条件变化较大,温度降低,光照时间变短,种群所需食料缺乏,种群的平均密度和平均拥挤度均降到最低。
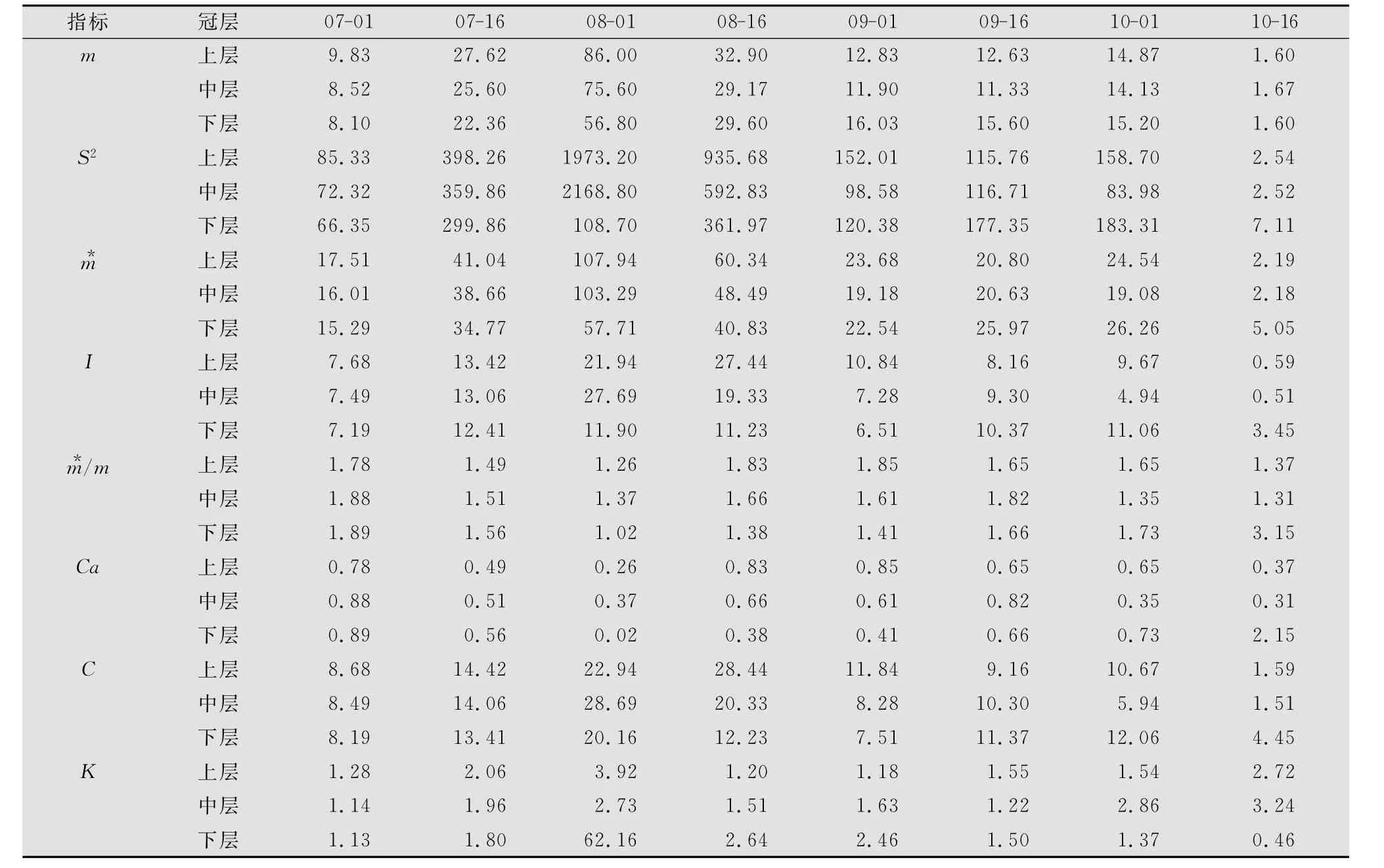
表1 镰螯螨在不同高度聚集度指标的时序变化
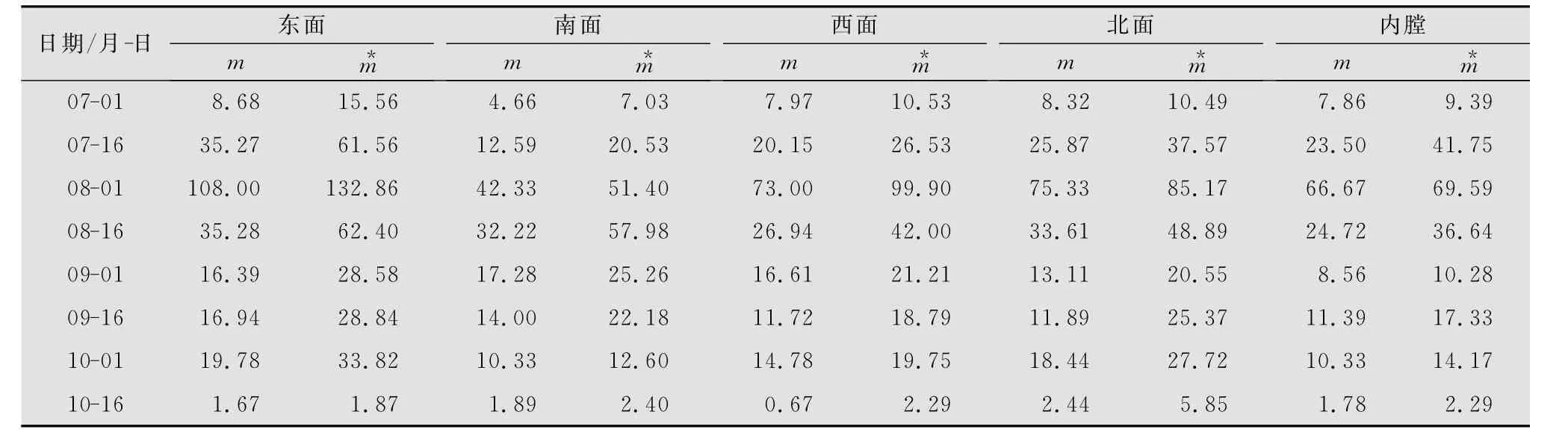
表2 镰螯螨在不同方位的平均密度(m)和平均拥挤度(m*)
图3可以看出镰螯螨种群在苹果树冠上的扩散趋势:7月1日到8月16日为种群扩散上升期,之后扩散系数逐渐降低。在8月1日到8月16日,种群食料充足,达到发生高峰期,上中下层扩散系数均达到最大,聚集度高。从9月1日到10月16日,随着叶片营养下降,供镰螯螨取食的猎物和微生物菌类缺乏,种群密度逐渐降低,聚集度较前段时间低。8月中上旬,长光照吸引镰螯螨种群在树冠中上层分布较下层多,扩散系数中上层高于下层。
2.3 Iwao的回归分析法
将表1和表2中的m和m*对应数值分别代入Iwao定义的回归模型:m*=a+βm,得出树冠不同高度和方位的回归方程。树冠上层:m*=6732.16+1231.47 m,R=0.9844**;树冠中层:m*=3.46413+1347.82 m,R=0.9952**;树冠下层:m*=9394.67+0.92723 m,R=0.9698**;树冠东面:m*=9378.78+1.20019 m,R=0.9845**;树冠南面:m*=1410.80+1390.33 m,R=0.9571**;树冠西面:m*=1792.83+1.36554 m,R=0.9973**;树冠北面:m*=7.19313+1.07960 m,R=0.9860**;树冠内膛:m*=4.85277+1.05046 m,R=0.9628**。
由以上方程可知:无论在树冠上层、中层和下层或者东面、南面、西面、北面和内膛由于a值均大于0,镰螯螨种群个体间相互吸引,分布的个体成分是个体群;除树冠下层β值小于1种群呈现均匀分布,其余部位β值均大于1,总体上镰螯螨种群在苹果树冠上呈现聚集分布。镰螯螨既是植食性又是捕食性的螨类,而且喜欢高温和长光照环境。当树冠下层叶螨数量或者叶片上可供取食的替代食料少,光照时间短的时候,镰螯螨会转移到猎物或者食料多的地方,因而使得下层镰螯螨种群数量少,呈均匀分布,造成这种现象的原因与环境条件的异质性和镰螯螨自身的习性有关。
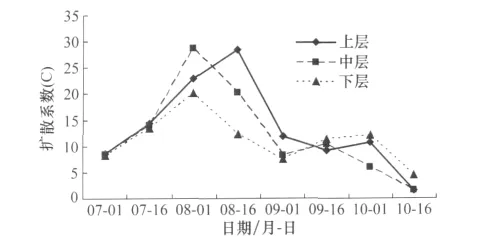
图3 镰螯螨在不同高度上的扩散动态
2.4 镰螯螨种群聚集度的时序动态
图4、5可以看出镰螯螨种群在树冠不同高度和不同方位上的聚集度时序变化:7月1日到8月1日,叶螨以及微生物菌类多,食物资源丰富,种群无需外延即可完成生长发育和繁殖,种群数量和平均密度大,聚集程度较低。在8月1日,种群达到发生高峰期,聚集程度最低。8月16日到10月1号,叶片营养下降较快,干枯凋落严重,生境发生改变,叶螨种间竞争加强,镰螯螨种群数量下降,但是聚集度变化差异不显著。到10月16日,叶片受到锈病和环境影响多数已经掉落,种群数量降到最低。树冠下层少数新生叶片上有螨类聚集,由于低温和短光照可以使镰螯螨滞育,西面和北面光照时间长,吸引镰螯螨聚集,因而这几个部位聚集程度略高。

图4 不同高度上镰螯螨聚集度(/m)时序动态
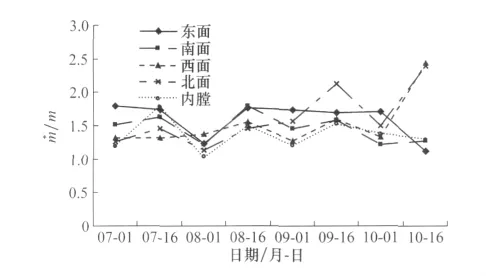
图5 不同方位上镰螯螨聚集度(/m)时序动态
2.5 叶螨、镰螯螨、芬兰真绥螨的种群消长动态关系
从图6可以看出:7月1日-8月1日,叶螨种群数量随捕食螨和镰螯螨数量的增加而逐渐降低,至8月1日,叶螨种群数量持续降低,芬兰真绥螨和镰螯螨种群数量均达到最大值,每百叶有螨分别为158.61头和913.33头,进入8月后,叶螨种群数量持续走低,再也不能满足芬兰真绥螨种群数量的维持,镰螯螨便成为芬兰真绥螨的主要捕食对象,充足的食料保证了芬兰真绥螨的生长繁殖。9月初,由于苹果叶片干枯和凋落,叶螨种群数量持续降低,镰螯螨数量仅能维持芬兰真绥螨种群的生长发育,芬兰真绥螨、镰螯螨和叶螨种群数量保持在一个较低的动态平衡状态。10月初开始,这几种螨大部分进入越冬期,到10月中旬种群数量降到最低,叶螨、镰螯螨和芬兰真绥螨每百叶有螨数分别为:1.39、20.28头和10.00头。可见,在苹果园生态系统中,芬兰真绥螨、叶螨、镰螯螨三者相互制约又相互依存。芬兰真绥螨对叶螨种群数量具有十分明显的控制作用,完全可以控制在经济允许水平之下;而其自身种群数量的维持又与叶螨和镰螯螨的种群数量有密切的关系:前期随芬兰真绥螨种群数量的上升,叶螨种群数量持续下降,甚至达到芬兰真绥螨种群数量不能维持稳定的水平;后期,在叶螨数量降至一定水平后,镰螯螨作为补充食物为芬兰真绥螨种群数量的维持和果园内3种叶螨种群数量的相对平衡发挥着十分重要的作用。
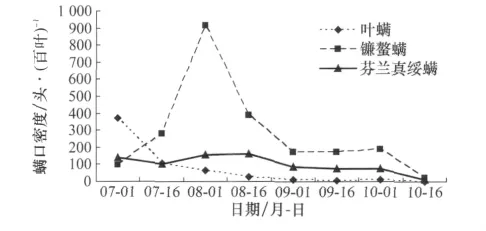
图6 3种螨类种群在苹果园的消长动态
3 问题与讨论
结合田间调查发现,天水地区不进行农事操作的苹果园中叶螨种类主要有苹果全爪螨、山楂叶螨、二斑叶螨、跗线螨、介壳虫、金纹细蛾、苏氏盲走螨、镰螯螨、芬兰真绥螨、捕食性蜘蛛等类群,叶片锈病发生严重。7-9月这段时期物种丰富,各螨类种群数量大,是生长发育和繁殖的最佳时期;9月后,由于土壤肥力降低,长期受害虫和病害危害等综合因素造成树冠生长力弱,叶片营养下降,叶片较管理良好的正常果园的会提早脱落。与农事管理好的正常果园相比较,这个时期各种昆虫和螨类种群数量低,镰螯螨种群在这段时期为了贮存越冬期所需的营养会暂时性地聚集在食料比较多的树冠部位和叶片上。
镰螯螨是具有植食性和捕食性的螨类,通过观察发现镰螯螨可以以叶片上的菌类和腐生生物为食料,实验室条件下用从试验地果园采回的苹果叶片饲养镰螯螨幼螨,其可以发育至成螨,说明镰螯螨具有植食性。在试验中发现天水地区果园中,在叶螨数量不足的条件下,镰螯螨可以代替叶螨成为芬兰真绥螨的主要猎物;结合室内捕食作用测定结果可知,芬兰真绥螨对镰螯螨有一定的捕食能力,25℃条件下,日最大捕食量为2.792头,可以维持芬兰真绥螨的正常发育和繁殖。苹果园镰螯螨种群的消长动态及时空分布与螨类自身的行为习性、物种选择生境的内禀特性、环境条件和益害螨种群间的相互作用有关。
芬兰真绥螨种群数量与镰螯螨种群数量变化总体上呈现正比例关系。本研究分析了7—10月份的镰螯螨时空动态,未能将出蛰期到7月份的种群数量变化和越冬场所进行调查分析,需要在以后研究中进一步完善。苹果园中镰螯螨种群数量大,镰螯螨形成种群的过程中主要食料是什么?叶螨是否有可能是镰螯螨的猎物?这些问题也需要进一步研究。
本文主要调查和分析了在未使用农药的苹果园中镰螯螨种群的时空动态及其与捕食螨、叶螨种群的相互关系:即在未使用农药的果园生态系统中,镰螯螨的多食性决定了其对保持芬兰真绥螨较高的种群数量,发挥着十分重要的作用;但在人工干扰作用较大、农药使用量较大的果园中,芬兰真绥螨的种群往往达不到依靠镰螯螨维持种群数量的程度,而镰螯螨由于本身的食性,在与叶螨的竞争中也不可能成为害螨的优势种群,在使用农药量较大的果园中镰螯螨与芬兰真绥螨、叶螨的关系究竟如何,尚需进一步研究。
[1] 王平宇,朱志民,夏斌,等.镰螯螨的分类形态特征[J].江西植保,1997,20(1):31-33.
[2] 匡海源.农螨学[M].北京:农业出版社,1986.
[3] 王平宇,朱志民,杨应桂,等.镰螯螨的生物学特征[J].江西植保,1998,21(1):33-34.
[4] 陈传盈.柑橘锈壁虱的天敌——镰螯螨初步研究[J].生物防治通报,1988,4(4):181-182.
[5] Hessein N A,Perring T M.Feeding habits of the Tydeidae with evidence of Homeopronematus anconai (Acari:Tydeidae)predation on Aculops lycopersici (Acari:Eriophyidae)[J].Internat Acarol,1986,12(4):215-221.
[6] Baker E W.A review of the genera of the family Tydeidae(Acarina)[M]∥Naegele J A.Advances in Acarology,I thac:Cornell Univ Press,1965,2:95-133.
[7] Andre H.A generic revision of the family Tydeidae(Acari:Actinedida)Ⅰ.Introduction,paradigms and general classification[J].Annales Socr Zool Belg,1979,108:189-208.
[8] Andre H.A generic revision of the family Tydeidae(Acari:Actinedida)Ⅳ.generic descriptions,keys and conclusions[J].Bull Ann Socr Belge Ent,1980,116:103-168.
[9] 范青海,李隆术.中国镰螯螨科一新属三新种(蜱螨亚纲:辐螨亚目)[J].福建农学院学报,1992,21(4):396-399.
[10]Soliman Z R,Zaher M A,EI-safi G S.An attempt for rearing Tydeus californicus (Banks)on sweet potato leaves in Egypt[J].Bulletin Socent,1974,58:217-219.
[11]徐汝梅.昆虫种群生态学[M].北京:北京师范大学出版社,1987:7-34.
[12]丁岩钦.昆虫种群数学生态学原理与应用[M].北京:科学出版社,1980:113-119.
[13]Cassie R M.Frequency distribution models in the ecology of plankton and other organisms[J].Animal Ecol,1962,31:65-92.
[14]张孝羲.昆虫生态及预报预测[M].北京:中国农业出版社,2001:58-59.
