贝类派琴虫和折光马尔太虫二重PCR方法的建立
2012-09-11谢丽基谢芝勋庞耀珊刘加波邓显文谢志勤
谢丽基,谢芝勋,庞耀珊,刘加波,邓显文,谢志勤
(广西兽医研究所,广西南宁 530001)
随着养殖规模的日益扩大及密度的持续增高,贝类的病害也频繁出现。目前,危害最严重的贝类原虫有派琴虫(Perkinsus sp)和折光马尔太虫(Marteilia refringens)。派琴虫能使贝壳不能闭合,套膜收缩,性腺发育抑制,生长缓慢,偶尔也会出现脓肿,死亡率可高达95%[1-4]。马尔太虫可引起贝类消瘦、消化道变色、停止生长并死亡[5-6]。另外,更为严重的是,人们食用了感染派琴虫的贝类还可能出现呕吐、腹泻等不适症状。
派琴虫和折光马尔太虫的传统检测方法有电镜观察、组织细胞学检查、原位杂交和雷氏液体巯基醋酸盐培养基(RFTM)等检测方法,这些方法费时费力,缺乏专一性,在实际工作中具有一定的局限性[7-10]。病原检测、筛选建立无特定病原体的健康群,仍然是目前预防与控制这些原虫病的最有效办法。PCR方法具有操作简便、敏感性高、特异性强、重复性好等优点,已成为动物病原检测的重要方法。至今仍未见有应用二重PCR技术对贝类单孢子虫和折光马尔太虫进行检测和诊断的报道。为了提高检测准确性和检测效率,缩短检测周期,本研究设计二对引物,建立了派琴虫和折光马尔太虫的二重PCR快速检测方法,现将结果报告如下。
1 材料与方法
1.1 主要仪器与试剂 PCR试剂盒及PMD18-T试剂盒购自大连宝生物公司; DNA片断回收试剂盒购自BioDev公司;海洋动物组织基因组DNA提取试剂盒购自天根公司;PCR仪为美国Perkin Elmer Cetus公司生产的PE9600仪。
1.2 菌株和DNA 嗜水气单胞菌和荧光假单胞菌均购自中国农业部动植物病原库;派琴虫、折光马尔太虫、副溶血弧菌、溶藻弧菌、河弧菌和拟态弧菌等由本室保存;单孢子虫的DNA由美国维吉尼亚海洋科学研究所的Nancy Stokes惠赠。
1.3 引物设计与合成 根据派琴虫和折光马尔太虫的基因保守序列,通过Blast验证,设计了2对特异性引物(表1)。
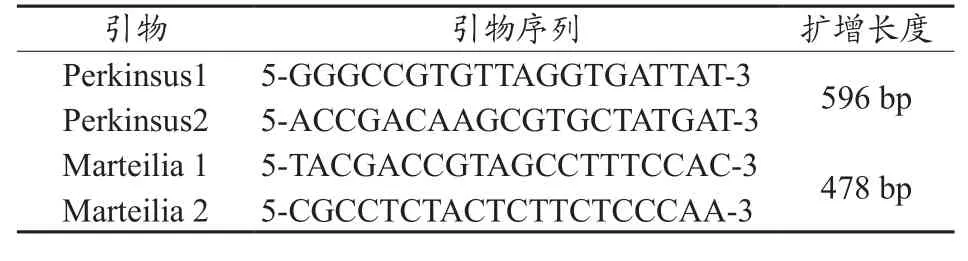
表1 试验所使用引物序列
1.4 核酸抽提 取待检贝类的鳃、心脏、消化腺组织等共约100 mg,匀浆后根据海洋动物组织基因组DNA提取试剂盒的说明提取DNA。参照Sambrook方法测定核酸的浓度和纯度[11],于-20 ℃保存备用。对照菌株DNA的抽提按同样方法进行。
1.5 PCR扩增介质及PCR各反应条件优化 在100 uL的反应体系中含:25mM MgCl25 uL,10×PCR buffer 10 uL,10mM dNTP 2 uL,Taq聚合酶5单位0.5 uL,适当浓度的上游引物和下游引物、模板各5 uL。以抽提的DNA为模板,对PCR各循环参数和各引物浓度等进行优化,以确定最佳的PCR模式。
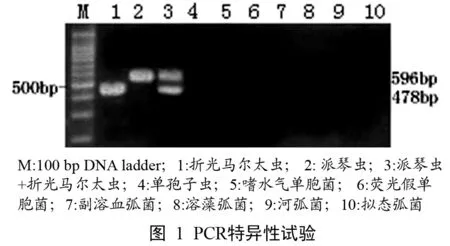
1.6 PCR特异性试验 将已提取的派琴虫、折光马尔太虫、单孢子虫、嗜水气单胞菌、荧光假单胞菌、副溶血弧菌、溶藻弧菌、河弧菌和拟态弧菌的DNA分别用多重PCR反应体系进行扩增,检测其特异性。
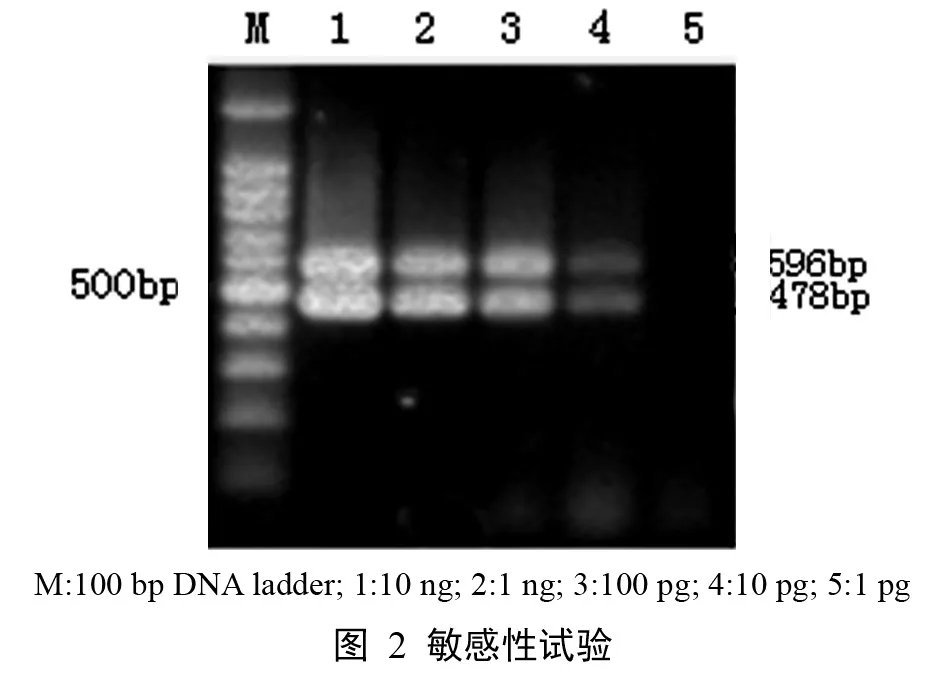
1.7 PCR敏感性 测定派琴虫和折光马尔太虫模板的DNA含量后,按10倍递增稀释,同时加入到最佳的PCR反应体系中进行扩增,检测其敏感性。
1.8 PCR产物的电泳分析及克隆测序 取50 uL PCR产物分别与5 uL溴酚兰混合,在10 g/L琼脂糖凝胶中电泳,经溴化乙锭染色后,在紫外光下观察拍照,与DNA标准分子量作比较,分析并记录结果。在紫外灯下用刀片切割所需的片段,然后用凝胶回收试剂盒纯化回收。取适量纯化回收的PCR产物,与PMD18-T于16 ℃连接过夜,转化DH5α大肠埃希氏菌。挑取在含氨苄青霉素的选择培养基上长出的白色菌落37 ℃培养,用碱裂解法抽提质粒进行PCR快速鉴定,阳性克隆菌送大连宝生生物技术有限公司进行测序,测序结果进行Blast比对分析。
1.9 检测临床样品 利用建立的贝类派琴虫和折光马尔太虫二重PCR方法,对广西沿海的119份牡蛎样品进行检测。
2 结果
2.1 PCR条件优化 通过对PCR的引物浓度、各反应温度、时间及循环次数等进行优化,最后确定PCR中Perkinsus1和Perkinsus2引物的最佳工作终浓度为0.5uM,Marteilia 1和Marteilia 2引物的最佳工作终浓度为0.4uM,PCR的最佳反应模式为94 ℃变性5 min,然后进入94 ℃变性1 min、57 ℃退火1 min、72 ℃延伸1 min的循环,共进行35个循环,最后再经72℃延伸10 min后,于4 ℃结束反应。
2.2 PCR特异性扩增结果 应用该程序对派琴虫和折光马尔太虫核酸,及对照菌株(单孢子虫、嗜水气单胞菌、荧光假单胞菌、副溶血弧菌、溶藻弧菌、河弧菌和拟态弧菌)的核酸进行PCR扩增,结果含有派琴虫和折光马尔太虫核酸模板的样品均能扩增出与试验设计大小相符的DNA扩增带;而其它对照菌株DNA在相同位置却无任何DNA扩增条带(图1)。
2.3 PCR的敏感性扩增结果 经过敏感性测定,该PCR最低能检出10 pg派琴虫和折光马尔太虫的DNA模板(图2)。
2.4 测序结果与序列分析 经测序结果分析及Blast比对分析,证明了派琴虫和折光马尔太虫PCR扩增产物,大小分别为596 bp和478 bp,与设计大小相符。PCR产物的核酸序列与引物设计模板的基因对应片段的同源性一致。
2.5 检测临床样品 对广西沿海的119份牡蛎样品进行检测,结果检出11份派琴虫和2份折光马尔太虫阳性,阳性率分别为9.24%和1.68%。
3 讨论
派琴虫和折光马尔太虫是危害海水养殖贝类的重要病原体,在欧洲和大洋洲等国家的感染普遍存在[1-4,9,12-15],在过去的二十多年里,我国从国外引进了多种海洋贝类作为贝种用于海水养殖,但在进口过程中都没有进行派琴虫和折光马尔太虫感染的检测,派琴虫和折光马尔太虫可能会随着贝类的引进而进入我国,并在不同贝类间传播。因此迫切需要建立一种快速敏感的派琴虫和折光马尔太虫检测方法。目前国内检测这两种原虫的方法有组织和细胞学检测法、电镜检测法和原位杂交法,但这些方法操作繁琐费时,在实际的工作中存在一定的局限性。
PCR方法具有操作简便、敏感性高、特异性强和重复性好等优点。多重PCR是一种特殊的PCR技术,由于多重PCR反应体系中存在二种以上的引物和模板,反应过程中相互之间会有一定的影响,而且反应总是有利于较小片段扩增的原则,为使多重PCR中各片段都得到最佳扩增,应尽可能使各扩增片段之间大小不要相差太悬殊,各引物所需扩增条件接近一致,特别各引物退火因尽可能相同,最终确保二种扩增产物量相对平衡。本试验中,我们根据派琴虫和折光马尔太虫的基因序列设计出特异性引物,从而达到一次二重PCR扩增,就可检测鉴别派琴虫和折光马尔太虫的目的。由于派琴虫和折光马尔太虫在临床上可能会出现混合感染,派琴虫和折光马尔太虫二重PCR方法的建立就非常有意义。通过对引物用量和PCR扩增条件优化,派琴虫和折光马尔太虫二种引物的最佳工作浓度分别为0.5uM和0.4uM,说明了要使二重PCR反应体系中每一目的片段都得到最佳扩增结果,适当的引物浓度是十分重要的。
本研究建立的派琴虫和折光马尔太虫二重PCR方法全程(包括核酸提取、荧光PCR扩增)仅需约5 h,最低能同时检出10 pg派琴虫和折光马尔太虫的DNA模板,这说明该二重PCR与常规PCR一样,都具有很高的敏感性,可以同时进行派琴虫和折光马尔太虫的检测和鉴别,这对于在贝类派琴虫和折光马尔太虫的发病早期提供准确的诊断结果,切断其传播途径有重要意义,同时这也是有效防制以上贝类原虫病,选育建立无派琴虫和折光马尔太虫病的健康贝类养殖群所必要的。可见,这些技术具有广阔的应用前景,对贝类原虫病的防制与净化,保证贝类养殖业可持续发展有着重要的现实意义,对食品安全也有着不可忽略的公共卫生意义。
牡蛎是中国南方沿海养殖的主要经济贝类,也是中国传统的出口海产品。因此本研究应用所建立的二重PCR技术,对取自对广西沿海的119份牡蛎样品进行检测。检测结果表明,在广西沿海牡蛎中,派琴虫和折光马尔太虫的感染率分别为9.24%和1.68%,结果提示在广西沿海地区养殖贝类中存在派琴虫和折光马尔太虫的感染。
[1]梁玉波,张喜昌,王立俊,等.北黄海菲律宾蛤仔帕金虫流行病害的研究[J].海洋与湖沼,2001,32(5):567-575.
[2]Hamaguchi M,Suzuki N,Usuki H,et al.Perkinsus protozoan infection in short-necked clam Tapes(=Ruditapes) philippinarum in Japan[J].Fish Pathol,1998,33(5):473-480.
[3]Choi K S,Park K I. Report on the occurrence of Perkinsus spp in the Manila clams,Ruditapes philippinarum,in Korea[J]. J Kor Aquac Soc,1997,10:227-237.
[4]Powell E N,Klinck J M,Hofmann E E.Modeling diseased oyster populations.II. Triggering mechanisms for Perkinsus marinus epizootics[J]. J Shellf i sh Res,1996,15(1):141-165.
[5]Audemard C,Barnaud A,Collins C M,et al. Claire ponds as an experimental model for Marteilia refringens life-cycle studies:new perspectives[J]. J Exp Mar Bio Ecol,2001,257(1):87-108.
[6]Itoh N,Momoyama K,Ogawa K. First report of three protozoan parasites (a haplosporidian,Marteilia sp. and Marteilioides sp.)from the Manila clam,Venerupis (=Ruditapes) philippinarum in Japan[J]. J Invertebr Pathol,2005,88(3):201-206.
[7]Lopez-Flores I,Robles F,Valencia JM,et al. Detection of Marteilia refringens using nested PCR and in situ hybridisation in Chamelea gallina from the Balearic Islands (Spain)[J]. Dis Aquat Organ,2008,82(1):79-87.
[8]Carrasco N,Arzul I,Berthe FC,et al. In situ hybridization detection of initial infective stages of Marteilia refringens(Paramyxea) in its host Mytilus galloprovincialis[J]. J Fish Dis,2008,31(2):153-157.
[9]Kleeman SN,Le Roux F,Berthe F,et al. Specificity of PCR and in situ hybridization assays designed for detection of Marteilia sydneyi and M. refringens[J]. Parasitology,2002,125(2):131-141.
[10]Almeida M,Berthe F,Thebault A,et al. Whole clam culture as a quantitative diagnostic procedure of Perkinsus atlanticus(Apicomplexa,Perkinsea)in clams Ruditapes decussatus[J].Aquaculture,1999,177(1/4):325-332.
[11]Sambrook J,Fritsh E T,Maniatis T. Molecular Cloning:a laboratory manuel [M]. New York:Cold Spring Harbor. Cold Spring Harbor Laboratory Press,1989.
[12]Audemard C,Sajus MC,Barnaud A,et al. Infection dynamics of Marteilia refringens in flat oyster Ostrea edulis and copepod Paracartia grani in a claire pond of Marennes-Olon Bay[J]. Dis Aquat Organ,2004,61(1/2):103-111.
[13]Lopez-Flores I,Garrido-Ramos MA,Herran R de la,et al.Identif i cation of Marteilia refringens infecting the razor clam Solen marginatus by PCR and in situ hybridization[J].Mol Cell Probes,2008,22(3):151-155.
[14]Carrasco N,Lopez-Flores I,Alcaraz M,et al. Dynamics of the parasite Marteilia refringens (Paramyxea) in Mytilus galloprovincialis and zooplankton populations in Alfacs Bay(Catalonia,Spain)[J]. Parasitology,2007,134(11):1541-1550.
[15]Russell S,Frasca S J,Sunila I,et al. Application of a multiplex PCR for the detection of protozoan pathogens of the eastern oyster Crassostrea virginica in fi eld samples[J]. Dis Aquat Org,2004,59(1):85-91.
