慢病毒介导的稳定沉默nm23-H1基因的肺癌细胞株的建立及生物学行为改变
2012-09-10罗猛朱大兴弓磊邱小明祖玲玲孙丽亚吴志浩周清华
罗猛 朱大兴 弓磊 邱小明 祖玲玲 孙丽亚 吴志浩 周清华
肿瘤侵袭转移是一个多基因调控、多阶段、多步骤发生的复杂过程,也是导致肿瘤患者治疗失败和死亡的主要原因。nm23-H1基因是第一个被发现的重要的肿瘤转移抑制基因,它的结构和功能的异常与癌细胞的侵袭和转移能力密切相关[1-5]。在前期工作中将化学合成的siRNA瞬时转染低转移的人大细胞肺癌细胞株NL9980以抑制nm23-H1基因的表达,研究发现NL9980细胞的侵袭力明显增强[6]。但化学合成的siRNA介导的基因沉默只能维持较短的时间(5 d-7 d),为了更深入地研究nm23-H1基因沉默后对肺癌细胞侵袭转移机制的影响,本研究利用慢病毒介导的shRNA技术,转染人大细胞肺癌细胞株NL9980和肺腺癌细胞株A549,建立nm23-H1基因稳定沉默的细胞株,并观察其体外侵袭力的改变,为进一步研究nm23-H1的功能、生化作用机制奠定基础。
1 材料与方法
1.1 材料 人大细胞肺癌细胞株NL9980由本实验室建立。pcDNA3.1(+)表达载体为本实验保存。A549肺腺癌细胞株购自美国ATCC。RPMI-1640、小牛血清购自美国Gibco公司。非靶标shRNA对照慢病毒颗粒(non-targeting shRNA, SHC002V)和特异性抑制nm23-H1基因的shRNA慢病毒颗粒(nm23-H1-shRNA;Clone ID:NM_000269.x-99s1c1、NM_000269.x-182s1c1和NM_000269.x-183s1c1)、嘌呤霉素和聚凝胺购自美国Sigma公司。克隆环购自美国Corning公司。M-MLV逆转录酶、dNTP mix、RNase抑制剂、随机引物、DNA Marker购自TAKARA公司。总RNA提取试剂Trizol Reagent购自美国Invitrogen公司。引物、Gold view核酸染料购自北京赛百盛公司。SYBR GREEN Master Mix、7500实时定量PCR系统购自美国ABI公司。nm23-H1鼠单抗(货号:SC-56928)购自美国Santa Cruz公司,β-actin鼠单抗(货号:A5441)购自美国Sigma公司。Boyden小室购自美国MiliPore公司。
1.2 方法
1.2.1 shRNA构建、慢病毒包装 慢病毒载体为pLKO.1-puro,由U6启动子引导shRNA的合成,并具有嘌呤霉素抗性筛选标记。将特异性靶向nm23-H1(NM_000269.2)mRNA不同序列(NM_000269.x-99s1c1:GCGTACCTTCATTGCGATCAA、NM_000269.x-182s1c1:TCCGCCTTGTTGGTCTGAAAT和NM_000269.x-183s1c1:CCGCCTTGTTGGTCTGAAATT)的21 bp反向互补发夹序列克隆入pLKO.1-puro载体,并包装生产慢病毒,病毒滴度为106TU,购自Sigma公司。
1.2.2 细胞培养、慢病毒转染和克隆细胞株筛选 转染前1天将2×105个NL9980和A549细胞铺板(6孔板),第2天细胞融合度为50%-60%,每孔加入含终浓度为8μg/mL的聚凝胺和慢病毒50 μL转染。转染24 h后加入嘌呤霉素1 μg/mL(选择浓度由杀菌曲线确定)。每隔2 d-3 d观察细胞情况,更换选择培养基。2周左右开始有克隆生长。克隆环方法挑取单克隆细胞入24孔板,90%-100%融合度后转入培养瓶扩增,鉴定,保种。
1.2.3 逆转录和定量PCR检测nm23-H1基因表达 根据总RNA提取试剂盒说明书提取RNA,并进行逆转录PCR。逆转录nm23-H1引物:Forward:5′CAAGTGCTGCGAACCACG3′;Reverse:5′GACCAACAAGGCGGAATC3′,扩增长度为420 bp。参照基因GAPDH引物序列:Forward:5′ATGGGGAAGGTGAAGGTCG3′;Reverse:5′GGGGTCATTGATGGCAACAATA3′,扩增长度为108 bp。PCR扩增条件为:94oC、3 min,94oC、30 s,55oC、30 s,72oC、2 min,30个循环;72oC、5 min。取PCR产物10 μL进行2%琼脂糖凝胶电泳检测。nm23-H1定量PCR引物:Forward:5′AAAGGATTCCGCCTTGTTGGT3′;Reverse:5′GCCCTGAGTGCATGTATTTCAC3′,扩增长度为124 bp。定量PCR条件为:50 °C、2 min、1个循环;95°C、10 min、1个循环;95 °C、15 s,60 °C、1 min,40个循环。做熔解曲线检测。2-ΔΔCT法计算基因表达差异[7]。
1.2.4 Western blot印迹检测nm23-H1表达的变化 细胞裂解后提取总蛋白,BCA方法测细胞蛋白浓度后进行12%SDS-PAGE电泳。100 V转膜1 h,抗nm23-H1和β-actin一抗4oC孵育过夜,洗膜后室温二抗1 h。ECL显影。
1.2.5 shRNA抵抗nm23-H1基因重组质粒转染拯救实验 根据shRNA(NM_000269.x-99s1c1:GCGTACCTTCATTGCGATCAA)序列设计nm23-H1基因shRNA抵抗序列,下划线标记为突变碱基,该突变为沉默突变,不改变nm23-H1氨基酸编码序列。突变引物:Forward:5′CGGATCCATGGCCAACTGTGA GCGAACATTTATCGCCATCAAACCA3′;Reverse: 5′GCTCTAGATCATTCATAGATCCAGTTCTGA3′。表达载体为pcDNA3.1(+)。PCR突变构建shRNA抵抗nm23-H1基因重组质粒。脂质体法将shRNA抵抗nm23-H1基因重组质粒3 μg转染稳定沉默nm23-H1基因表达的肺癌细胞株NL9980-99和A549-99,48 h后收获细胞做Western blot检测。
1.2.6 侵袭小室实验检测侵袭力改变 每个上室加300 μL无血清的RPMI-1640进行ECM胶水化1.5 h,下室加500 μL含10%胎牛血清的RPMI-1640;然后将实验组和对照组细胞接种于Transwell 6孔板的上室中,每孔接种细胞5×105,每组设3个平行孔。在细胞培养箱孵育48 h,对下室细胞消化后细胞计数,以穿过膜的细胞数目来表示肿瘤细胞的侵袭能力。
1.3 统计学处理 采用SPSS 13.0软件分析系统处理结果,计量资料采用Mean±SD表示,应用t检验分析数据。P<0.05为差异有统计学意义。
2 结果
2.1 nm23-H1基因稳定沉默细胞系mRNA和蛋白表达水平的检测 人大细胞肺癌细胞株NL9980细胞用慢病毒介导的nm23-H1 shRNA转染、筛选后,Western blot检测3个shRNA (Clone ID: NM_000269.x-99s1c1,NM_000269.x-182s1c1和NM_000269.x-183s1c1)均获得很好的nm23-H1基因沉默效果,以shRNA(NM_000269.x-99s1c1)最为明显,而非靶向干扰序列则对nm23-H1的表达没有抑制作用。故在A549肺癌细胞筛选实验中只选用shRNA(NM_000269.x-99s1c1)病毒颗粒作转染,并将nm23-H1基因稳定沉默的人大细胞肺癌细胞株NL9980和肺腺癌细胞株A549命名为NL9980-99和A549-99,将非靶标(non-target)对照细胞株命名为NL9980-non和A549-non。RT-PCR结果显示与对照细胞株相比NL9980-99细胞nm23-H1基因含量明显降低(图1A),A549-99细胞株实时定量PCR结果显示nm23-H1基因mRNA表达水平明显降低(P=0.008,501)(图1B),Western blot结果均证实nm23-H1蛋白表达明显抑制(图1C,图1D)。
2.2 shRNA抵抗nm23-H1基因重组质粒转染拯救实验 将shRNA抵抗nm23-H1基因重组质粒转染稳定沉默nm23-H1基因表达的肺癌细胞株NL9980-99和A549-99,48 h后收获细胞做Western blot检测,显示恢复nm23-H1的正常表达(图2A,图2B)。
2.3 nm23-H1 基因表达抑制后侵袭力改变 Boyden小室实验检测发现nm23-H1基因稳定沉默后,NL9980-99细胞和A549-99细胞体外侵袭能力明显增强,与对照组NL9980、NL9980-non和A549、A549-non细胞比较有统计学差异(P<0.01),提示nm23-H1基因稳定沉默促进肺癌细胞的侵袭能力(图3A,图3B)。
3 讨论
nm23基因是第一个被发现的肿瘤转移抑制基因[1]。迄今为止,人类nm23基因已报道了8个亚型,即nm23-H1至nm23-H8,其中nm23-H1基因与肿瘤侵袭转移的关系最密切,已得到人们的普遍重视[8]。nm23-H1具有二磷酸核苷激酶(nucleotide diphosphate kinase, NDPK)活性[9]、组氨酸蛋白激酶活性[10]和3’-5’核酸外切酶活性[11]。近期研究[12]显示nm23-H1参与了紫外线诱导的DNA损伤修复过程,并可能与紫外线诱发的黑色素瘤的形成有关。Conery等[13]报道nm23-H1表达的缺失可以导致细胞染色体不稳定,从而参与肿瘤的形成过程。尽管20多年来国内外做了大量的研究,nm23-H1基因抑制肿瘤侵袭转移的分子机制还未完全阐明。
我们的前期研究[14-16]显示nm23-H1基因的低表达和杂合性缺失与人肺癌的高转移性有密切关系。将野生型nm23-H1基因转染人高转移大细胞肺癌细胞株L9981可以逆转L9981的侵袭、转移表型[17]。将化学合成的siRNA瞬时转染低转移的人大细胞肺癌细胞株NL9980抑制nm23-H1基因的表达,NL9980细胞的侵袭力明显增强;通过基因芯片检测发现基因表达谱发生明显变化,表达上调的基因有707个,下调的有373个。其中上调基因主要有肿瘤转移相关基因、细胞增殖、细胞周期、生长发育(包括胚胎发育和神经系统发育)以及细胞运动迁徙相关基因;下调基因包括肿瘤抑制基因、细胞骨架相关基因等[6]。上述研究结果说明nm23-H1基因可能是肿瘤侵袭转移的上游调控基因,但nm23-H1基因调控的关键下游分子或靶点尚需进一步研究确定。
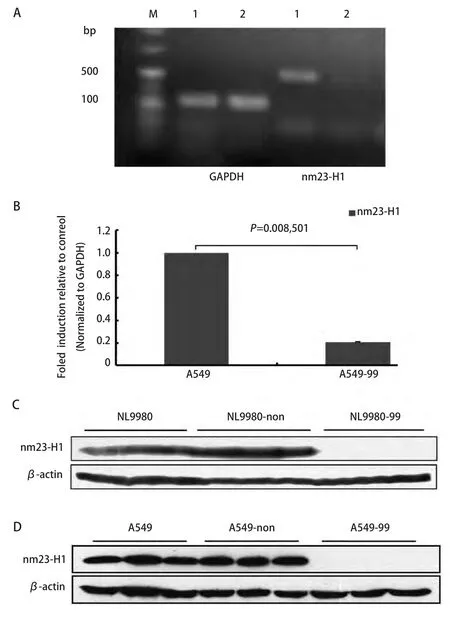
图1 RT-PCR、定量PCR及Western blot检测结果。A:RT-PCR检测nm23-H1 mRNA在NL9980-99细胞中的表达,相对内参为GAPDH,与对照相比nm23-H1含量明显降低;1:NL9980;2:NL9980-99;B:qRT-PCR检测nm23-H1 mRNA在A549-99细胞中的表达,相对内参为GAPDH(P<0.01);C:Western blot检测nm23-H1蛋白在 NL9980-99细胞中的表达,与对照相比表达量明显降低;D:Western blot检测nm23-H1蛋白在A549-99细胞中的表达,与对照相比表达量明显降低。Fig 1 Results of RT-PCR, qRT-PCR and Western blot.A: The results of nm23-H1 mRNA RT-PCR, nm23-H1 expression greatly reduced compared with GAPDH;M: DNA marker; 1: NL9980; 2: NL9980-99; B: The results of nm23-H1 mRNA qRT-PCR, analysis of expression normalized with GAPDH (P<0.01); C: The results of nm23-H1 expression in NL9980-99 cells by Western blot, nm23-H1 expression greatly reduced compared with β-actin; D: The results of nm23-H1 expression in A549-99 cells by Western blot,nm23-H1 expression greatly reduced compared with β-actin.
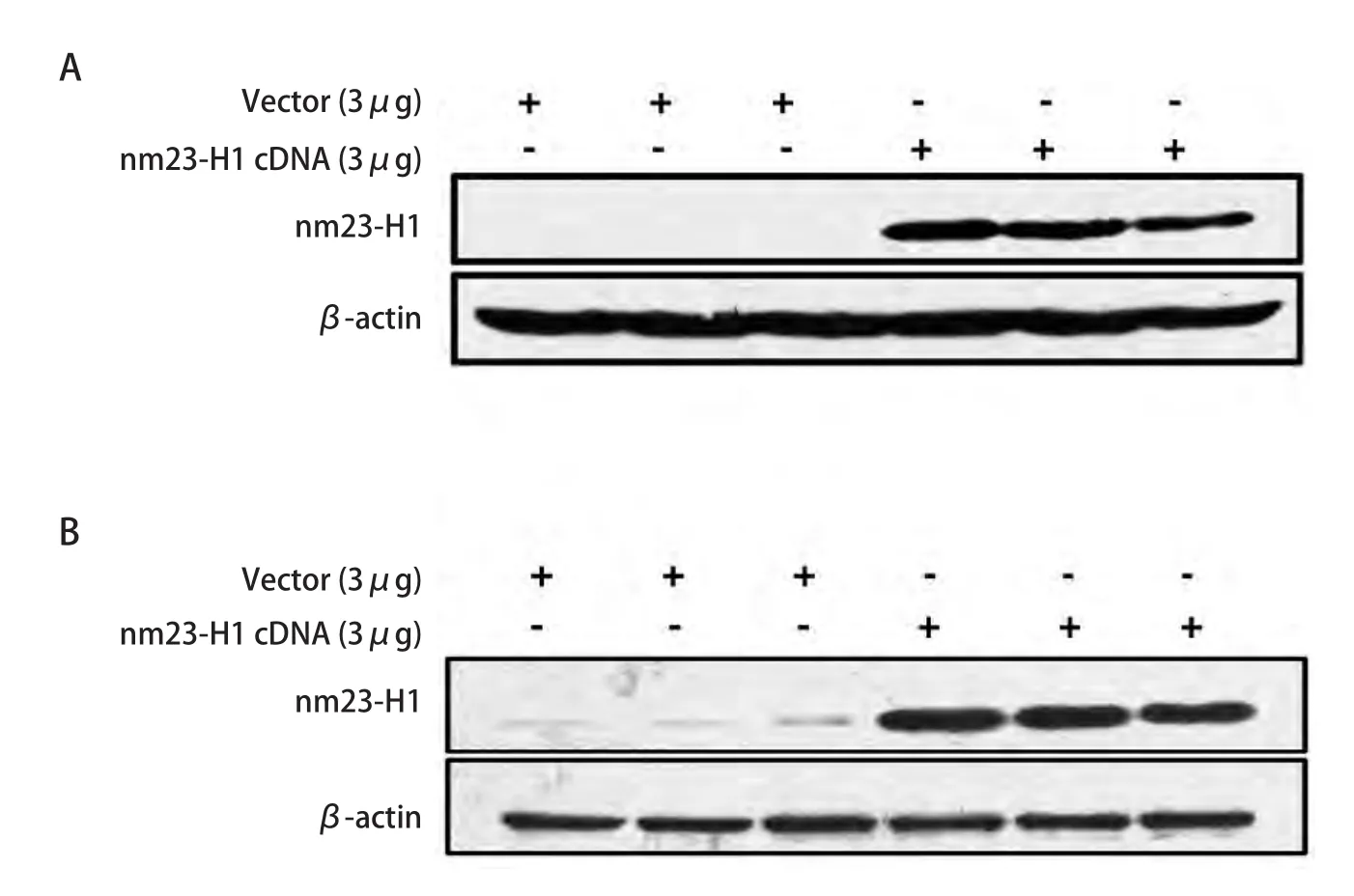
图2 NL9980-99和A549-99细胞shRNA抵抗nm23-H1基因重组质粒转染拯救实验。A:NL9980-99细胞nm23-H1基因shRNA抵抗拯救实验,与对照组相比nm23-H1基因重组质粒转染组重现nm23-H1的正常表达;B:A549-99细胞nm23-H1基因shRNA抵抗拯救实验,与对照组相比nm23-H1基因重组质粒转染组重现nm23-H1的正常表达。Fig 2 shRNA rescue experiments in NL9980-99 and A549-99 cells. NL9980-99 and A549-99 cells were transfected with vector containing shRNA-resistant nm23-H1 cDNA to rescue the expression of nm23-H1. A: shRNA rescue experiments in NL9980-99 cells analyzed by Western blot; B: shRNA rescue experiments in A549-99 cells analyzed by Western blot.
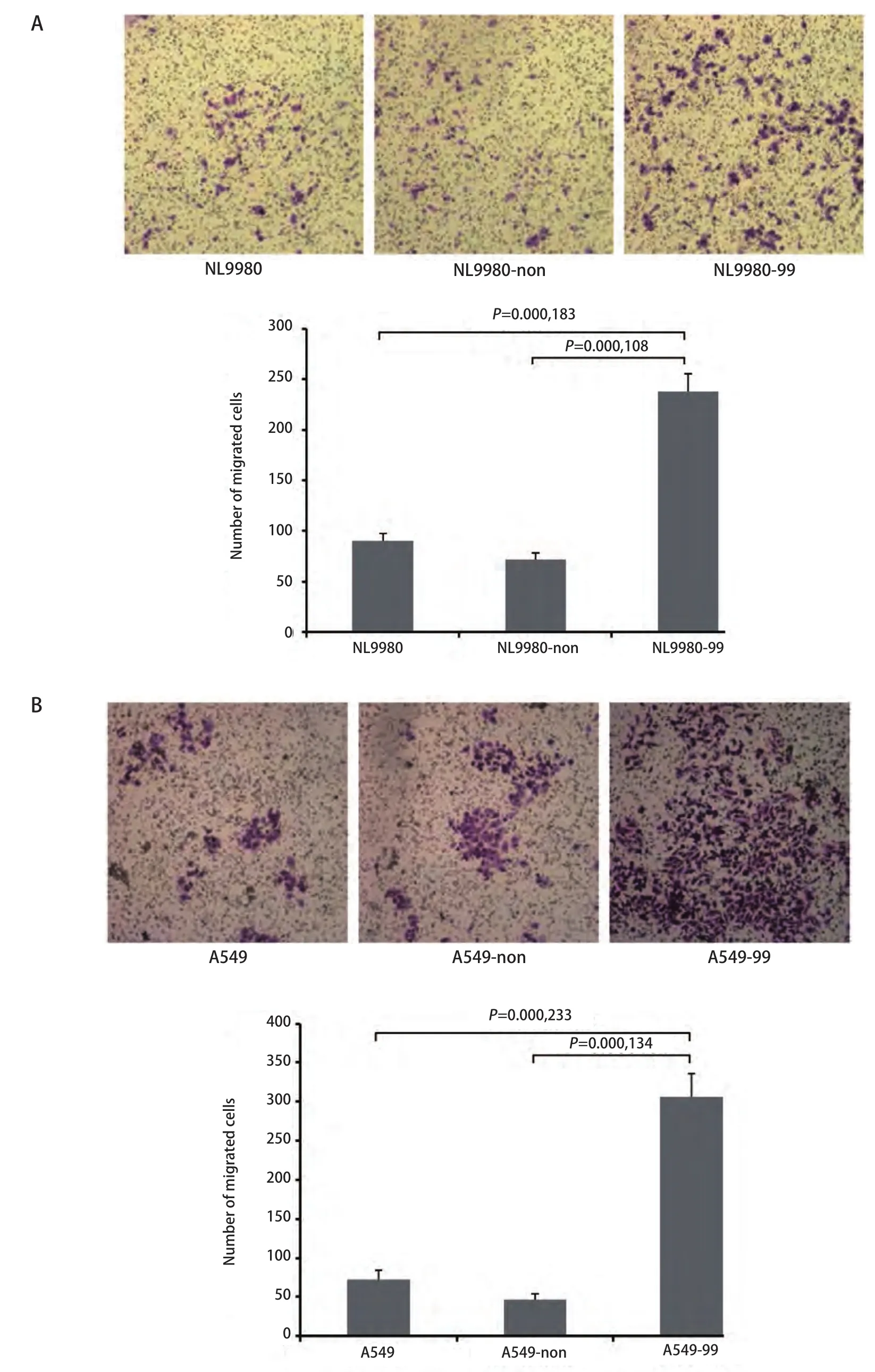
图3 Boyden小室检测NL9980-99和A549-99细胞侵袭力的改变。A:NL9980-99细胞与对照相比,侵袭力明显增强(P<0.01);B:A549-99细胞与对照相比,侵袭力明显增强(P<0.01)。Fig 3 Boyden chamber assay of NL9980-99 and A549-99 cells. A: Boyden chamber assay of NL9980-99 cells, compared with the control (P<0.01); B:Boyden chamber assay of A549-99 cells, compared with the control (P<0.01).
为了进一步研究这些功能改变及相关的分子机制,需要建立稳定沉默nm23-H1基因的肺癌细胞株。RNA干扰技术现已成为研究基因功能的重要工具[18],但化学合成的siRNA介导的基因沉默只能维持较短的时间(5 d-7 d),而且通常转染的效率较低[19]。因此,通过载体介导的RNA干扰就成为了选择。近年来,由于慢病毒技术的发展及其自身的优点,如免疫原性低、感染范围广,可以高效整合到宿主细胞基因组稳定产生siRNA,使得慢病毒介导的RNA干扰成为稳定基因沉默的最常用选择,并可克服化学合成siRNA的缺点[20]。
本研究通过慢病毒介导的特异性靶向nm23-H1基因shRNA,转染人大细胞肺癌细胞株NL9980和肺腺癌细胞株A549,经过嘌呤霉素筛选获得了稳定沉默nm23-H1基因表达的肺癌细胞株NL9980-99和A549-99。mRNA和蛋白水平检测均证实nm23-H1的表达明显降低,并通过转染shRNA抵抗的nm23-H1表达载体,恢复nm23-H1的表达。该拯救实验证实我们所建立的NL9980-99和A549-99细胞中nm23-H1基因沉默是由于RNA干扰机制降解了nm23-H1基因mRNA所致,而不是脱靶效应(offtarget effect)[19]。通过Boyden小室实验观察到nm23-H1基因沉默后,人大细胞肺癌细胞株NL9980和人肺腺癌细胞株A549细胞的侵袭力明显增强,差异具有统计学意义(P<0.01)。不同肺癌细胞株nm23-H1基因沉默后具有相似的侵袭力改变,逆向证明了nm23-H1基因肿瘤转移抑制的功能。以上结果显示本课题组成功建立了nm23-H1基因稳定沉默的人大细胞肺癌细胞株NL9980-99和肺腺癌细胞株A549-99,为更深入研究nm23-H1的功能、生化作用机制奠定了基础。
