Keap1在非小细胞肺癌中的表达及与化疗疗效相关性的研究
2012-09-10曹宝山朱翔陈森肖宇梁莉
曹宝山 朱翔 陈森 肖宇 梁莉
目前肺癌死亡率已位居男、女性恶性肿瘤的第一位[1],全球每年至少有160万的新发病例和130万的死亡病例。非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌的80%左右[2],发现时多处于进展期,化疗仍是进展期NSCLC治疗的主要手段。含铂两药方案是一线化疗首选方案,耐药是化疗失败的主要原因。目前关于肿瘤耐药机制尚不完全清楚,因此探索与肿瘤耐药相关的生物指标,对提高化疗疗效和患者生活质量显得尤为重要。
Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein1, Keap1)是细胞应对氧化应激和亲电性应激损伤的重要防御基因之一[3]。基础研究[3,4]表明Keap1的表达水平与NSCLC细胞对卡铂、顺铂、依托泊苷等药物的敏感性相关。因此,Keap1表达水平或许与NSCLC患者含铂化疗方案疗效相关。为此,本研究通过免疫组化方法检测了50例进展期NSCLC患者组织标本中Keap1的表达水平,并分析了Keap1表达水平与患者临床特征和一线含铂化疗方案疗效之间的关系。
1 对象与方法
1.1 研究对象 选取2008年1月-2011年12月在北京大学第三医院接受化疗的共50例NSCLC患者。入组前需病理确诊为NSCLC;不能手术切除的III期和IV期患者(依据国际肺癌研究协会颁布的第7版分期标准[5]);有足够的病理组织标本供免疫组化检测;一线方案是含铂两药方案;治疗前、治疗2个周期和4个周期后均有影像学检查(胸腹部CT、头颅MRI)。共纳入符合条件的病例50例,包括男性29例,女性21例;年龄范围48岁-77岁,中位年龄64岁;鳞癌患者23例,腺癌患者27例;III期患者20例,IV期患者30例;接受紫杉类药物联合铂类方案化疗患者10例,接受吉西他滨联合铂类方案化疗患者28例,接受长春瑞宾联合铂类化疗患者5例,接受培美曲塞联合铂类化疗患者4例,其它药物联合铂类化疗患者3例。
1.2 随访及后续治疗 所有患者每3个月通过定期来院或电话随访,随访开始时间为2008年1月,末次随访时间为2012年3月1日,最短随访时间为3个月,最长为50个月。50例患者中仅接受1种治疗方案的患者14例,接受≥2种治疗方案的患者36例;后续治疗中接受放疗患者5例,根治性手术切除2例,接受表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor, EGFR-TKI)靶向治疗患者13例。
1.3 临床资料收集及疗效评价标准 记录患者临床特征、化疗方案和影像学指标。疗效指标包括近期和远期疗效。近期疗效按照实体瘤疗效评价标准1.1版[6]分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD),获得CR或PR的患者4周或以后确认。远期疗效为无疾病进展生存期(progression free survival, PFS)和总生存期(overall survival, OS)。PFS定义为从治疗开始至疾病进展或任何原因导致死亡的时间,OS定义为从初次治疗开始至死亡或随访终点时间。
1.4 免疫组化检测Keap1表达
1.4.1 实验方法 活检组织标本经10%甲醛固定后,常规石蜡包埋,切片,4 μm厚度。采用免疫组化SP法检测(兔抗人Keap1抗体购于proteintech®公司,免疫组化二抗SP检测试剂盒购于北京中杉金桥生物技术有限公司,Keap1抗体按1:100稀释),应用PΒS代替一抗作为阴性对照,按照试剂说明书进行操作。
1.4.2 结果判定 采用双盲法,由两位独立的病理医师进行阅片,Keap1抗原阳性反应位于细胞浆内。随机选取5个高倍镜视野(200倍),每个视野记数200个肿瘤细胞。共计数1,000个细胞。阳性结果参照Solis等研究[7]的评判标准,按染色强度分为:0分,无染色;1分,染色呈淡黄色;2分,染色呈棕黄色;3分,染色呈棕褐色;按阳性细胞比例分为0%-100%;按照染色强度和阳性细胞比例乘积判定免疫组织化学表达水平。Keap1低或不高表达是指二者乘积<150%,反之为高表达。
1.5 统计学方法 应用SPSS 17.0统计学软件分析。率的比较采用卡方检验或Fisher精确检验,相关性检验采用Pearson检验,多因素分析采用Logistic回归模型(逐步后退法)。Kaplan-Meier方法进行生存分析,Log-rank检验差异性,多因素分析采用Cox多因素分析模型。P<0.05为差异有统计学意义。
2 结果
2.1 随访及疗效 随访率为100%。中位随访时间16个月,随访范围3个月-50个月。近期疗效中无患者为CR,17例(34.0%)患者为PR,23例(46.0%)患者为SD,10例(20.0%)患者为PD。因3例获得PR患者中2例接受了根治性手术切除,1例接受了根治性放射治疗,后期检查方式和间隔差别较大,故在评价远期疗效时将其剔除。远期疗效:PFS为1个月-12个月,中位PFS为5个月; OS为3个月-50个月,中位OS为16个月。
2.2 Keap1蛋白检测结果及与临床特征间的关系 Keap1主要表达在细胞浆中(图1)。Keap1高表达率为26.0%(13/50)。Keap1在PR患者中的高表达率为47.1%(8/17),明显高于PD患者的10.0%(1/10)(P=0.047)。但Keap1表达水平在性别、年龄、病理类型、分化程度、远处转移、吸烟和化疗方案组间无差异(P>0.05),见表1。
2.3 Keap1表达与化疗疗效、PFS、OS相关性分析 Pearson相关分析表明,Keap1表达与化疗疗效(r=-0.327, P=0.020)和PFS(r=0.439, P=0.002)相关,但与OS(r=0.018, P=0.904)无关,Keap1高表达NSCLC患者的疗效及PFS明显优于低或不表达者。
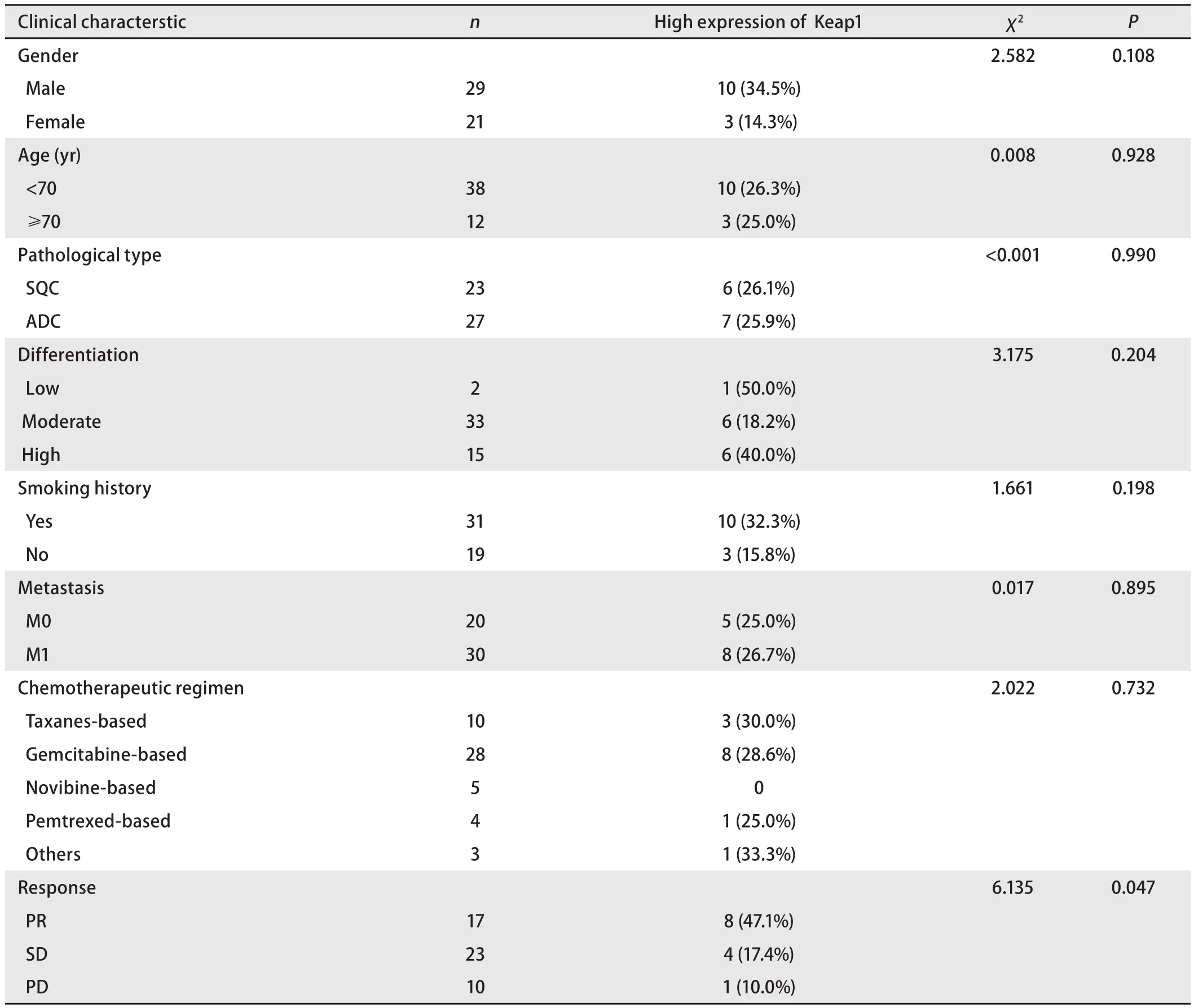
表 1 Keap1表达水平同接受化疗的NSCLC患者临床特征关系(n=50)Tab 1 The relationship between the protein expression level of Keap1 and clinical features of NSCLC patients with chemotherapy (n=50)
2.4 生存分析 Kaplan-Meier生存分析显示Keap1高表达NSCLC患者组的中位PFS和OS分别为8.0个月和19.0个月;低表达组分别为4.0个月和19.5个月, Keap1高表达组中位PFS明显高于低表达组(P=0.002,图2A),但两组在OS方面无统计学差异(P=0.760,图2Β)。
2.5 多因素分析 校正性别、年龄、病理类型、转移等因素后,Logistic回归分析表明Keap1表达水平有成为一线化疗疗效的独立预测指标的趋势(P=0.065),见表2。校正性别、年龄、病理类型、分化程度、化疗方案、转移、接受化疗方案种类、接受EGFR-TKI治疗与否等因素后,多因素分析表明Keap1表达水平是一线化疗PFS的独立预测因素(P=0.007),但不是OS的独立预测因素(P=0.700)。病理类型(P=0.026)、后续是否接受EGFR-TKI治疗(P=0.007)及接受化疗方案种类(P=0.046)是OS的预测因素,见表3。
3 讨论
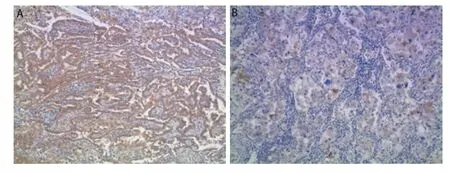
图 1 免疫组化检测Keap1在肺癌中的表达情况(×100)。A:Keap1高表达;B:Keap1低表达。Fig 1 Expression of Keap1 in lung cancer (×100). A:Keap1 high expression; B: Keap1 low expression.
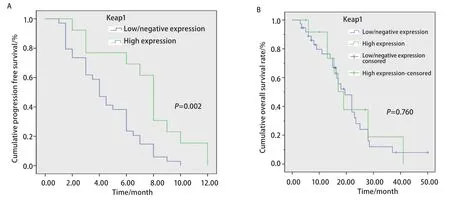
图 2 Kaplan-Meier生存曲线分析。A:Keap1高表达和低/不表达NSCLC患者的PFS生存曲线;B:Keap1高表达和低/不表达NSCLC患者的OS生存曲线。Fig 2 Kaplan-Meier cumulative survival time curves analysis. A: The PFS curves of Keap1 high expression and low/negative expression group of NSCLC patients; B: The OS curves of Keap1 high expression and low/negative expression group of NSCLC patients. PFS: progression free survival.

表 2 回归模型比较一线化疗疗效相关的各组变量(n=50)Tab 2 Comparsion of variable for chemotherapy induced response (n=50)
Keap1是细胞防御氧化和亲电性应激损伤的重要蛋白,其与核因子E2相关因子2 (nuclear factor erythroid-2-related factor 2, Nrf2)组成重要的细胞防御体系。生理状况下,Keap1结合Nrf2,并与E3泛素化连接酶结合,通过泛素化介导Nrf2蛋白降解,维持细胞浆内Nrf2处于较低水平。一旦细胞受到外源性或内源性的氧化应激或亲电性应激刺激,Keap1便成为敏感的传感器,其通过对自身半胱氨酸残基的修饰,阻止Nrf2降解,并促进Nrf2释放,累积的Nrf2进入细胞核内,激活抗氧化反应元件(antioxidant response element, ARE),进而激活ARE下游的细胞保护基因,包括:①细胞内氧化还原基因,如谷氨酸半胱氨酸连接酶、血红素氧合酶-1等;②II相解毒基因,如谷胱甘肽-S转移酶、NAD(P)H苯醌氧化还原酶-1等;③编码转运蛋白的基因,如多药耐药蛋白(multidrug resistant protein,MRP)等,从而保护细胞免受氧化应激或亲电性应激所致损伤[3,8]。
Solis等[7]应用免疫组化的方法发现Keap1高表达组NSCLC患者的PFS和OS明显高于低表达组;Takahashi等[9]和Li等[10]应用基因检测方法证实NSCLC Keap1的失活与预后差密切相关。近期研究[3,11-13]表明Keap表达下降后Nrf2表达升高,导致肺癌细胞对阿霉素、足叶乙甙、顺铂和紫杉类药物耐药。因此Keap1表达水平除与NSCLC患者预后相关,还应与化疗疗效相关。但目前缺乏Keap1表达水平与进展期NSCLC患者一线化疗疗效的相关研究。因进展期患者组织标本通常是通过支气管镜或CT穿刺活检获得,组织标本较小,而免疫组化方法所需组织标本量明显少于基因检测方法。因此,本研究以临床肺穿刺或支气管活检标本为研究对象,应用免疫组织化学方法检测Keap1蛋白,拟明确进展期NSCLC患者中Keap1表达情况及与一线化疗疗效的相关性。
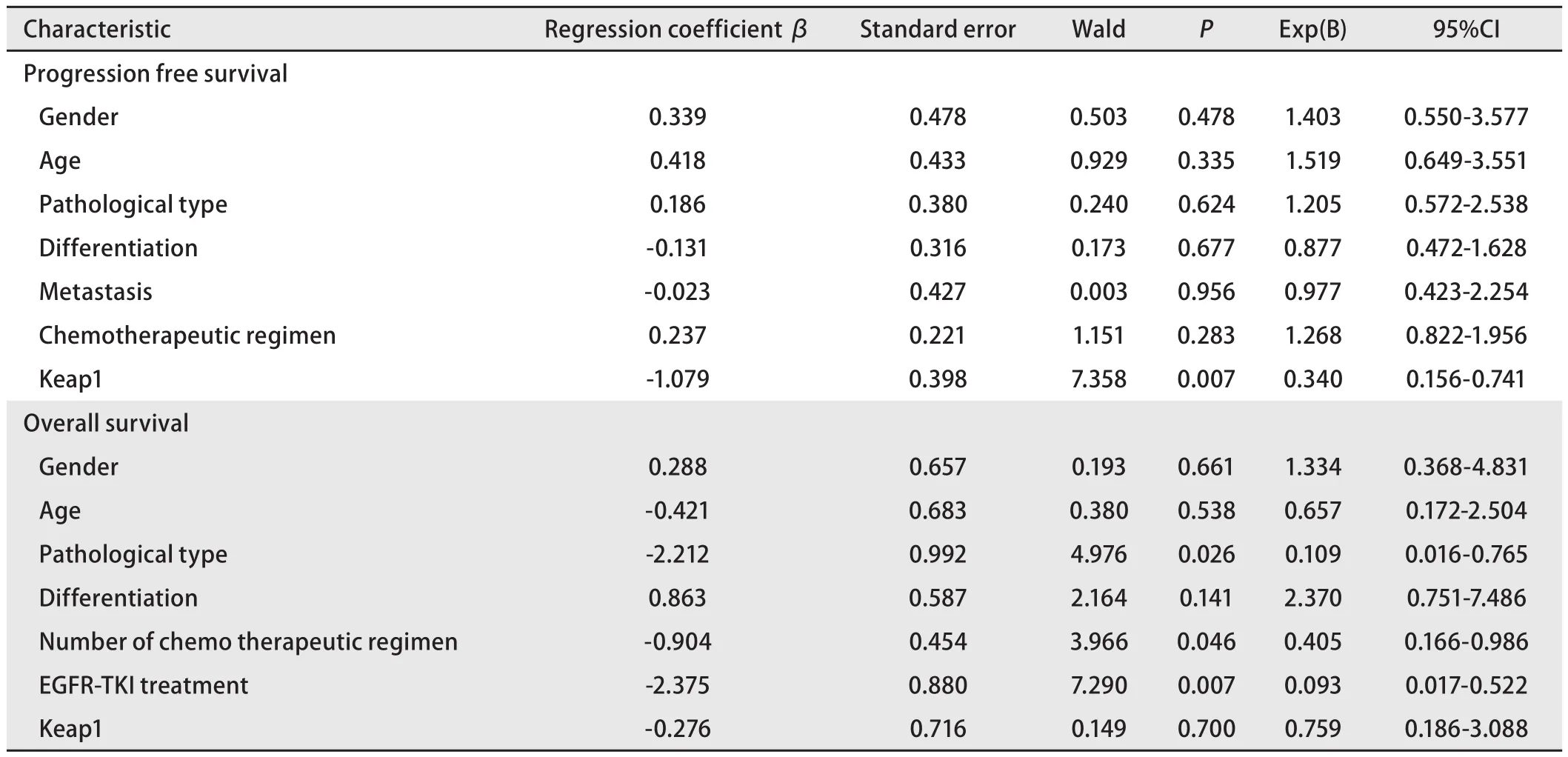
表 3 多因素分析NSCLC特异性生存率的预后因素(n=47)Tab 3 Cox regression analysis of the disease-specific survival of NSCLC patients (n=47)
本研究结果显示进展期NSCLC患者中Keap1表达存在个体差异,Keap1高表达率为26.0%。Keap1表达产生个体差异机制包括:①遗传背景本身所致;②Keap1自身突变不同所致,近期多项研究发现NSCLC标本中检测出Keap1突变[10,14,15],突变导致Keap1表达下降或缺失;③Keap1甲基化所致,Wang等[11]和Muscarella等[16]发现NSCLC组织标本和细胞株中存在Keap1基因启动子CpG岛甲基化,甲基化导致Keap1功能减低;④Nrf2突变所致,Nrf2突变的NSCLC细胞株中Nrf2过表达,间接抵消Keap1功能[17];⑤外源性刺激Nrf2活性增强,间接减弱Keap1功能所致,张凯茹等[18]发现耐顺铂的A549细胞株中Nrf2水平较亲本的A549明显升高。上述因素可以单一或同时存在。
本研究中Keap1高表达的NSCLC患者组获得PR率高于低表达或不表达患者组。其原因可能为在Keap1不表达或低表达的患者中,Keap1对Nrf2调控受限,从而促使Nrf2进入细胞核内激活ARE的下游基因,如II相解毒基因、编码转运蛋白的基因等,从而促进药物解毒、外排,产生耐药[3];而Keap1高表达者,可维持Nrf2处于较低水平,进而提高药物敏感性[4]。结合本研究结果,Keap1表达水平或许是预测化疗疗效的理想指标。
本研究中Keap1高表达组患者的PFS明显延长,可能与Keap1高表达患者组客观缓解率高或Keap1高表达的肿瘤细胞增殖、转移能力下降[4,19]相关。但在OS方面,本研究发现Keap1表达水平与OS无关,与Solis[7]和Merikallio[20]研究结果不同。其差异产生的原因可能在于:①Keap1表达情况随着外界环境刺激发生改变;②后续治疗不平衡,如患者接受化疗方案的种类以及是否接受EGFR-TKI治疗等不同;③二者研究对象不同,本研究涉及均是进展期患者,而Solis[7]和Merikallio[20]研究中多为术后患者。
本研究的主要限制在于样本量偏小,可能存在选择偏移。但本研究发现Keap1表达水平与一线化疗疗效、PFS相关,Keap1是PFS的独立预测因素。因此Keap1或许可成为预测NSCLC化疗疗效的生物指标,需要进一步扩大样本量,进行前瞻性研究验证Keap1对化疗疗效预测的临床价值。
