Ad-SPK1对家兔应激性溃疡的治疗作用
2012-09-10张东泽于国辉汪剑威
张东泽 于国辉 汪剑威
(内蒙古医学院,010059)
Ad-SPK1对家兔应激性溃疡的治疗作用
张东泽 于国辉 汪剑威
(内蒙古医学院,010059)
目的 探讨腺病毒介导的鞘氨醇激酶对家兔应激性溃疡愈合的作用及机制。方法 选取雄性日本大耳白兔30只,按体质量随机分为三组,分别是模型组、空白对照组、腺病毒介导的鞘氨醇激酶治疗组。模型组和腺病毒介导的鞘氨醇激酶治疗组以浸水法建立兔应激性溃疡模型后,分别给予模型组注射生理盐水,腺病毒介导的鞘氨醇激酶治疗组在溃疡部位注射携带SPK1的腺病毒,分别在第15天和第22天胃镜下观察溃疡区域,对愈合质量进行评价,硝酸还原法检测胃部NO含量。结果 动物实验显示,24 h后模型组和腺病毒介导的鞘氨醇激酶治疗组内镜和组织学检查提示,胃黏膜呈应激性溃疡改变,模型建立成功。模型组与空白对照组相比,NO水平明显降低(P<0.05);腺病毒介导的鞘氨醇激酶治疗组与模型组对比,电子胃镜下可见应用腺病毒介导的鞘氨醇激酶治疗组的溃疡愈合明显好于生理盐水模型组。模型组呈明显凹陷性溃疡,溃疡面被覆坏死组织。腺病毒介导的鞘氨醇激酶治疗组15 d时溃疡面明显红润,肉芽组织增生,少量黏膜上皮覆盖溃疡面,溃疡面皱缩;22 d时溃疡面明显缩小,溃疡凹陷不明显,溃疡面积明显缩小。同时,应用腺病毒介导的鞘氨醇激酶治疗组与模型组相比,NO水平明显升高(P<0.05)。结论 腺病毒介导的鞘氨醇激酶可促进实验兔胃溃疡黏膜上皮修复和溃疡面血管增生,加快溃疡愈合。其治疗机制可能与NO有关。
胃溃疡;鞘氨醇激酶;NO
鞘氨醇激酶(sphingosine kinase,SPK)是调控细胞生命活动的重要代谢酶,其催化产物是1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P),是膜脂质鞘磷脂的代谢产物,是一个新发现的同时具有细胞内第二信使和细胞外第一信使双重功能的脂类生物活性分子[1]。构建鞘氨醇激酶突变体基因,特异性抑制鞘氨醇激酶的活性,能准确地了解鞘氨醇激酶本身的生物学功能。腺病毒是目前使用较多的基因载体,已用于多项临床基因治疗中。利用腺病毒介导的鞘氨醇激酶这种基因疗法来治疗消化性溃疡,目前还比较少见。鞘氨醇激酶是维持细胞存活的一个关键分子,S1P是其下游分子,S1P是一种脂类促血管生长因子[2]。据推测:SPK-S1P在应激性溃疡愈合中发挥重要作用。本研究构建携带鞘氨醇激酶基因的腺病毒载体,转染应激性溃疡动物模型的黏膜上皮细胞,拟在以腺病毒介导的鞘氨醇激酶促进应激性溃疡黏膜上皮细胞增生、迁移以及溃疡周围血管新生的研究基础上,进一步探讨SPK1促进应激性溃疡愈合的作用及其相关的分子机制,研究结果将为应激性溃疡的治疗提供新的思路和靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 选取4月龄雄性日本大耳白兔30只,体质量(2.0±0.1)kg。国家标准啮齿类动物,清洁级,标准饲料喂养,自由饮食。随机分为三组,分别是模型组,空白对照组,腺病毒介导的鞘氨醇激酶治疗组。
1.1.2 主要实验试剂和仪器 BCA-200 Protein Assay kit(Pierce);95%乙醇;3%戊巴比妥;Olympus 260型内镜;一氧化氮;pH计;超纯水制备装置;垂直电泳装置;低温冰箱;低温层析柜;低温高速离心机;低温水浴槽。
1.2 应激性溃疡模型的建立 造模前实验家兔禁食12 h以上,自由饮水。实验时以30 g/L戊巴比妥钠(30 mg/kg)肌肉注射麻醉后固定于50 cm×25 cm实验用塑料平板上,然后直立浸于水温为20~25℃水槽中,水平面与实验家兔剑突水平齐。浸泡24 h后,擦干皮肤,放入笼中,造模完成。
1.3 实验给药及电镜观察 在造模24 h后分别于溃疡周围黏膜点注射生理盐水和Ad-SPK1各8 mL(病毒滴度1×109)。于给药后15 d和22 d后行电子胃镜检查。
1.4 胃部NO测定 NO用硝酸还原酶法原理(比色法)检测。
1.5 统计学分析 数据用SPSS 13.0软件进行数据分析,P<0.05为差异有统计学意义。
2 结果
2.1 应激性胃溃疡模型成功建立 两组造模组可见胃内有咖啡色内容物,冲洗掉之后可见部分胃黏膜充血,胃腺部分的胃黏膜呈弥漫性水肿,并可见多部位、广泛性的出血和血痂,血痂和胃黏膜结合比较牢固,分离较难。空白对照组未见上述改变。
2.2 应用腺病毒介导的鞘氨醇激酶 (SPK1基因)对胃溃疡治疗作用 在胃腺部溃疡模型中,电子胃镜下可见图1:电子胃镜下,生理盐水对照组可见明显清晰的溃疡,溃疡面被覆坏死组织;图2:空白对照组黏膜光滑、未见组织缺损;图3:腺病毒介导的鞘氨醇激酶治疗组治疗15 d溃疡面明显红润,肉芽组织增生,少量黏膜上皮覆盖溃疡面,溃疡面皱缩;图4:腺病毒介导的鞘氨醇激酶治疗组治疗22 d溃疡面明显缩小,溃疡凹陷不明显。应用腺病毒介导的鞘氨醇激酶治疗组溃疡愈合明显好于生理盐水对照组。对照组呈明显凹陷性溃疡,溃疡面被覆坏死组织;腺病毒介导的鞘氨醇激酶治疗组15 d时和22 d时溃疡面明显缩小,溃疡凹陷不明显。
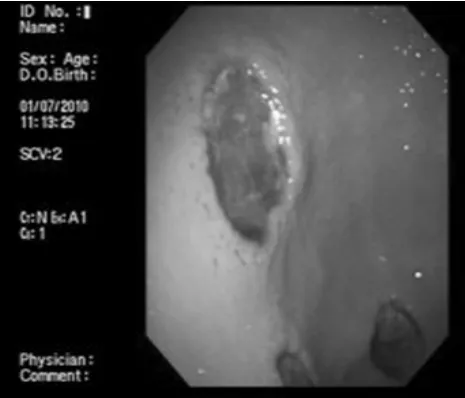
图1

图2
2.3 应用腺病毒介导的鞘氨醇激酶后胃部NO的变化(表1)从表1可以看出,模型组与空白对照组相比,胃部NO水平降低,有显著性差异;应用腺病毒介导的鞘氨醇激酶治疗后,腺病毒介导的鞘氨醇激酶治疗组与模型组相比,胃部NO水平升高,有显著性差异。

表1 应用腺病毒介导的鞘氨醇激酶后胃部NO水平的变化
3 讨论
消化性溃疡在我国的发病率很高,其发病机制和病因也是相当复杂的,主要病因包括幽门螺旋杆菌感染、胃酸和胃蛋白酶的作用、非甾体抗菌药物、遗传因素、胃和十二指肠动力异常、应激和精神因素等[3]。另外,胃、十二指肠黏膜也应该具有良好的血液循环,这样的话上皮细胞才能不断更新,黏膜的完整性才能被维持。在机体受到应激的刺激下,胃黏膜可能受到损伤,如果微循环的功能能保持完整,则可以通过上皮修复阻止黏膜损伤的进一步发展;如黏膜损伤较重,破坏了基底膜的完整性,便只能通过细胞增生、细胞外基质和深层细胞的重建来修复破损的黏膜[4]。在溃疡修复过程中,与成纤维细胞、血管内皮、黏膜上皮细胞以及浆细胞甚至平滑肌细胞等有关。这些细胞中,都含有某些特定因子直接影响着溃疡的修复质量,对溃疡修复过程起着非常重要的作用[5]。

图3
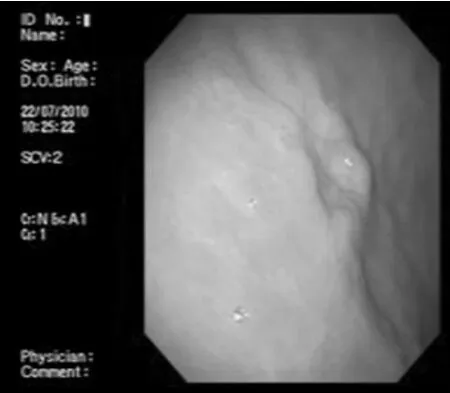
图4
研究表明[6],鞘氨醇激酶是催化生成S1P的限速酶,发挥第一信使功能。S1P是一种鞘脂代谢的主要中间产物,是目前公认的许多重要的生命过程中的一个强有力的调节物质。Zhang等[7]首次发现其主要对细胞的增生发挥着积极的影响,同时其可以引起炎症、细胞死亡、血管生成和发挥免疫调节的作用等。S1P、SphK1或S1P的受体与许多疾病,包括许多类型的癌症、炎症性疾病,如多发性硬化症、哮喘等进展密切相关[8-9]。腺病毒介导的SPK1基因治疗可以有效预防术后腹腔粘连的形成,其主要原因可能是SPK1通过促进上皮细胞的增生和迁移发挥其预防粘连形成的作用[10]。已往的一些研究结果表明,SPK1/S1P信号通路在胃肠上皮细胞的正常功能发挥中具有重要作用[11-12]。但系统研究SPK1/S1P信号在消化性溃疡修复中的作用,目前还未见相关报道。
国内资料表明:NO供体可增加胃黏膜NO、氨基乙酸含量、增加胃黏膜血流,有降低胃黏膜完整性的作用。相反,如果NO的合成受到抑制时,胃黏膜抵制损害因素侵袭的能力明显下降[13]。在一些实验中,NO合成抑制剂由于减少胃黏膜血流量而加重消炎痛诱发的胃黏膜损伤[14]。此外,NO尚有以下作用:减少组胺刺激所引起的胃酸分泌增加;增加胃黏液层厚度;抑制血小板聚集、黏附;抑制中性粒细胞对血管内皮的黏附和从血管中移出;能与超氧离子发生反应;具有抗氧化剂的作用;NO是胃黏膜的重要保护因素之一。NO还是一种舒血管物质,可直接扩张血管,也可作为其他扩血管物质的协同因子或终末介质,介导胃黏膜充血反应,保护胃黏膜[15]。我们的实验结果表明,模型组造模成功后,胃部NO水平与空白对照组相比,NO水平降低明显,差异有统计学意义。应用腺病毒介导的鞘氨醇激酶这种治疗方法能显著提高胃组织内NO的水平,差异有统计学意义,从而使胃黏膜血液供应改善,促进损伤组织修复。因而我们可以认为这种治疗方法可能是通过改善胃黏膜微循环、解除胃黏膜缺血缺氧及能量代谢障碍等多种途径实现的。
本研究阐明了SPK1基因治疗后对家兔应激性胃溃疡有一定的修复作用,可能与升高胃组织NO水平有关,这可能为应激性溃疡的治疗提供了新的治疗方向。
[1]Shida D,Takabe K,Kapitonov D,et al.Targeting SphK1 as a new strategy against cancer[J].Curr Drug Targets,2008,9(8):662-673.
[2]French KJ,Zhuang Y,Maines LW,et al.Pharmacology and antitumor activity of ABC294640,a selective inhibitor of sphingosine kinase-2[J].J Pharmacol Exp Ther,2010,333(1):129-139.
[3]Guillermet-Guibert J,Davenne L,Pchejetski D,et al.Targeting the sphingolipid metabolism to defeatpancreatic cancer cell resistance to the chemotherapeutic gemcitabine drug[J].Mol Cancer Ther,2009,8(4):809-820.
[4]Hait NC,Allegood J,Maceyka M,et al.Regulation of histone acetylation in the nucleus by sphingosine-1-phosphate[J].Science,2009,325(5945):1254-1257.
[5]Alvarez SE,Harikumar KB,Hait NC,et al.Sphingosine-1-phosphate is a missing cofactor for the E3 ubiquitin ligase TRAF2[J].Nature,2010,465(9128):1084-1088.
[6]Foneska A,Kaunitz JD.Gastroduodenal mucosal defense[J].Curr Opin Gastroenterol,2010,26(6):604-610.
[7]Zhang H,Desai NN,Olivera A,et al.Sphingosine-1-phos
phate,a novellipid,involved in cellularproliferation[J].J Cell Biol,1991,114(1):155-167.
[8]Tarnawski AS.Cellular and molecular mechanisms of gastrointestinal ulcer healing[J].Dig Dis Sci,2005,50(Suppl 1):S24-S33.
[9]UngerBL,McGeeDW.Hepatocytegrowth factorandkeratinocyte growth factorenhance IL-1-induced IL-8 secretion through different mechanisms in Caco-2 epithelial cells[J].In Vitro Cell Dev Biol Anim,2010,47(2):171-181.
[10]Li QF,Wu CT,Guo Q,et al.Sphingosine 1-phosphate induces Mcl-1 upregulation and protects multiple myeloma cells against apoptosis[J].Biochem Biophys Res Commun,2008,371(1):159-162.
[11]Li QF,Huang WR,Duan HF,et al.Activation of Sphingosine Kinase-1 MediatesBCR/ABL-induced Upregulation of Mcl-1 in ChronicMyeloid LeukemiaCells[J].Oncogene,2007(26):7904-7908.
[12]邵国富,张志琳,楚冰,等.川芎嗪和尼莫地平对血管内皮细胞分泌ET和NO的影响[J].江苏医药,1999,25(7):462-464.
[13]Lai WQ,Irwan AW,Goh HH,et al.Anti-inflammatory effects of sphingosine kinase modulation in inflammatory arthritis[J].J Immunol,2008,181(11):8010-8017.
[14]GralerMH.Targeting sphingosine1-phosphate(S1P)levels and S1P receptor functions for therapeutic immune interventions[J].Cell Physiol Biochem,2010,26(1):79-86.
[15]FyrstH,Saba JD.An updateon sphingosine-1-phosphate and other sphingolipid mediators[J].Nat Chem Biol,2010,6(7):489-497.
Objective To probe into the function and mechanism of using adenovirus-induced sphingosine kinase1 to treat rabbits'stress ulcer.Methods 30 male Japanese white rabbits were selected and randomly divided into three groups according to their body weight,which were the model group,the blank controller group,and the Ad-SPK1 treatment group.After setting up the rabbits'stress ulcer pattern through flooding method in the model group and the Ad-SPK1 treatment group,the model group were given injection of physiological saline while the Ad-SPK1 treatment group were given injection of SPK1-carried adenovirus at the ulcer position.The ulcer area was observed under gastroscope on the 15th day and the 22nd day respectively,and the quality of healing was assessed,and the No amount in the stomach was detected by nitrate reduction method.Results Animal experiment showed after 24 hours endoscope and histological examination in the model group and the Ad-SPK1 treatment group suggested gastric mucosa got stress ulcer and the pattern successfully set up.Compared with the blank controller group,the model group had a clearly lower NO amount(P<0.05).Comparison between the Ad-SPK1 treatment group and the model group showed that under electronic gastroscope,the ulcer healing in the Ad-SPK1 treatment group was clearly better than that in the model group.The model group presented obvious hollow ulcer which was covered by necrotic tissues.The Ad-SPK1 treatment group grew red at the ulcer face on the 15th day,granulation tissue accreted,and the ulcer face was covered only by a bit of mucosa epithelium.On the 22nd day the ulcer face clearly shrank without clear hollow area.Compared with the model group,the Ad-SPK1 treatment group had a clearly higher NO amount(P<0.05).Conclusion Adenovirus-induced sphingosine kinase1(Ad-SPK1)can promote the repair of gastric ulcer mucosa epithelium and the proliferation of blood vessels at the ulcer face.Its treatment mechanism perhaps is related to NO amount.
Gastric ulcer;Sphingosine kinase1;NO
1005-619X(2012)12-1079-03
汪剑威
2012-10-09)
