黄姑鱼♀与大黄鱼♂杂交试验与AFLP分析
2012-09-07隋班良蔡明夷王志勇
隋班良,蔡明夷,2,刘 颖,2,王志勇,2
(1.集美大学水产学院,福建厦门361021;2.农业部东海海水健康养殖重点实验室,福建厦门361021)
黄姑鱼♀与大黄鱼♂杂交试验与AFLP分析
隋班良1,蔡明夷1,2,刘 颖1,2,王志勇1,2
(1.集美大学水产学院,福建厦门361021;2.农业部东海海水健康养殖重点实验室,福建厦门361021)
开展了黄姑鱼♀与大黄鱼♂杂交试验,并对杂交F1初孵仔鱼进行了AFLP分析.黄姑鱼♀与大黄鱼♂杂交能够正常受精,杂交受精率为93.54%,受精卵正常发育、孵化,孵化率为86.23%,但仔鱼在开口后一周内全部死亡.利用8对选择性扩增引物组合对亲本和杂交后代 (家系)初孵仔鱼进行AFLP分析,共得到456个条带,其中母本特异条带 (Female Special Band,FSB)178条、父本特异条带 (Male Special Band,MSB)187条、双亲共有条带 (Mutual Band,MuB)91条.且其中84条 (47.2%)FSB、89条 (47.6%)MSB和75条 (82.4%)MuB为全部杂交仔鱼共有,其余94条 (52.8%)FSB、98条(52.4%)MSB和16条 (17.6%)MuB在杂交后代中发生了分离.分离的FSB和MSB中分别有33.0%和28.6%表现为偏分离.AFLP分析结果表明,黄姑鱼♀与大黄鱼♂杂交的初孵仔鱼含有双亲的条带,是真正的杂交种,是构建大黄鱼与黄姑鱼遗传图谱以及研究杂种在细胞和分子水平隔离机制的适合材料.
黄姑鱼;大黄鱼;AFLP;远缘杂交;初孵仔鱼
0 引言
远源杂交作为鱼类育种的基本手段之一,在杂种优势利用[1-2]、抗逆性能选育[3-5]、多倍体育种[6-8]、诱导雌核发育[9-11]等领域发挥了重要作用.黄姑鱼(Nibea albiflora)属石首鱼科 (Sciaenidae),黄姑鱼属(Nibea),是我国重要的海水经济鱼类[12],近年来在浙江、福建的养殖规模不断扩大.而大黄鱼(Larimichthys crocea)属石首鱼科,黄鱼属(Larimichthys),是我国最重要的海水养殖鱼类之一[13].虽然黄姑鱼与大黄鱼繁殖季节重叠,但在海区没有发现自然杂交种.刘颖等[14]开展了大黄鱼♀与黄姑鱼♂人工杂交试验,发现杂交F1受精率高但成活率低,在初孵仔鱼阶段含有双亲基因.大黄鱼♀与黄姑鱼♂杂交F1和异源三倍体已初步应用于大黄鱼遗传图谱构建和着丝粒作图中[15].然而,黄姑鱼♀与大黄鱼♂杂交的研究目前尚未见报道.因此,本文拟开展黄姑鱼♀与大黄鱼♂杂交试验,并用AFLP分析了杂交F1初孵仔鱼的遗传组成,以期为黄姑鱼♀与大黄鱼♂种间杂交F1的开发利用提供科学依据.
1 材料与方法
1.1 实验材料
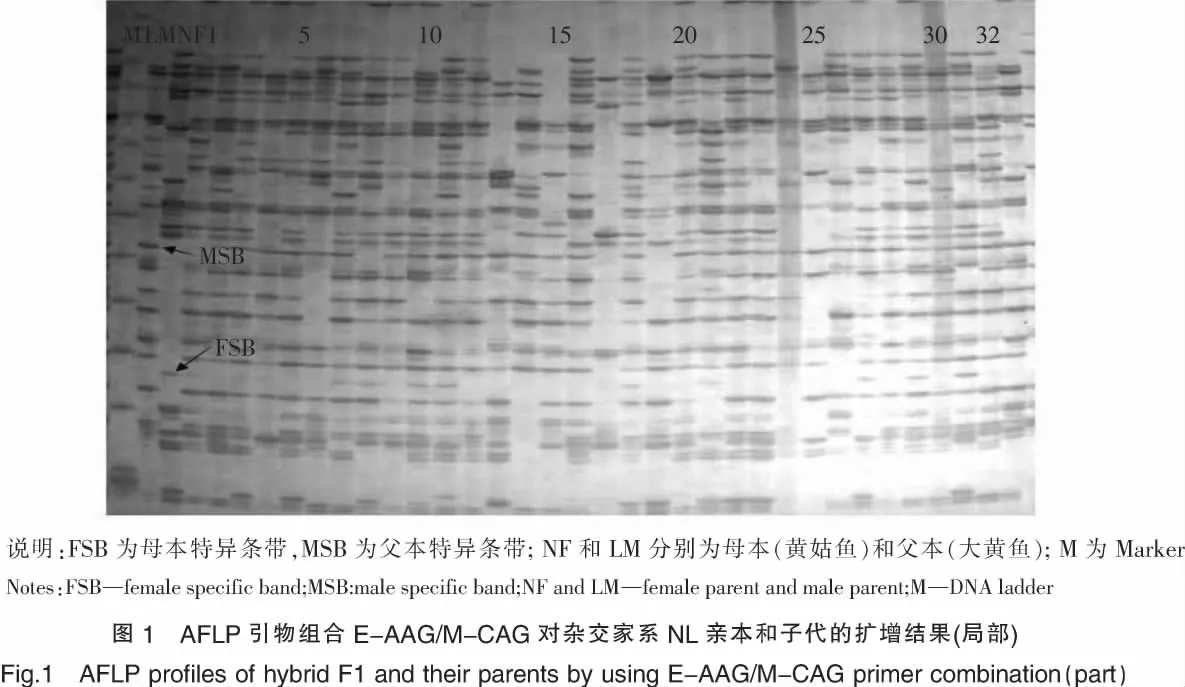
实验大黄鱼和黄姑鱼选自福建宁德三都澳海区网箱中养殖2周龄的候选亲本群体,从中挑选出体形正常、性腺发育良好、体表无外伤的雌鱼各3尾、雄鱼各2尾,注射LRH-A3进行人工催产,雄鱼催产剂量为0.5μg/kg,雌鱼为1μg/kg.达到效应时间后采用人工挤取精卵的方法进行干法授精,大黄鱼和黄姑鱼分别有2尾挤出的卵质量较好,分成2份,比较多的一部分用于异种杂交,少部分用于自繁对照.剪取雌、雄亲鱼少许胸鳍固定于体积分数为95%的乙醇中,用于后续的分子标记分析.各组仔鱼孵出后,视桶内鱼的数量取一定数量仔鱼固定于体积分数为95%的乙醇中,用于AFLP分析.为方便记录,将黄姑鱼♀与大黄鱼♂杂交家系记为NL,黄姑鱼母本记为NF,大黄鱼父本记为LM.
1.2 实验方法
1)DNA的提取 亲鱼 (胸鳍)和仔鱼 (整尾)基因组DNA的提取均用传统的蛋白酶K-苯酚/氯仿抽提方法[14].对提取的DNA样品先进行琼脂糖凝胶电泳,检测DNA的完整度.用紫外分光光度计测定DNA的OD260与OD280值,计算出DNA原液的浓度,然后取出适量原液稀释到50 ng/μL,保存于4℃备用,DNA原液置于-20℃保存.
2)AFLP分析 AFLP反应以及产物银染显色等按照Wang[16]等描述的程序进行.实验中使用的接头、预扩增引物、选择性扩增引物均由Invitrogen公司合成,选择性扩增引物序列为E-AAG/MCAG、E-AGG/M-CTG、E-AAG/M-CTC、E-AGG/M-CTC、E-AAC/M-CAG、E-ACC/MCAA、E-AAG/M-CAA和E-AGG/M-CAA,其中E-代表GACTGCGTACCAATTC,M-代表GATGAGTCCTGAGTAA.AFLP扩增产物使用6%的变性聚丙烯酰胺凝胶电泳结合银染法检测.
3)数据处理 以1和0代表扩增片段的有或无,将扩增获得的指纹图谱转换成数字矩阵,利用AFLP AnalyzerVer.1.3程序[17]计算雌雄亲本共有条带和特有条带、家系个体间、子代个体与亲本间的相似系数和遗传距离,根据遗传距离用UPGMA软件构建聚类图.其公式如下:相似系数Sij=2 Nij/(Ni+Nj),其中Nij为个体i与j共有的片段数量,Ni、Nj分别表示i个体与j个体各自具有的片段数量;遗传距离D=-Ln S,其中S表示相似系数.对在子代中发生分离的标记,用卡方检验检测该标记的分离是否符合孟德尔分离定律.
2 结果
2.1 受精率、孵化率和仔鱼畸形率
杂交家系(NL)与对照组(黄姑鱼自繁家系NN、大黄鱼自繁家系LL)的受精率、孵化率、畸形率见表1,杂交家系的受精率与对照组相当,孵化率略高于对照组,畸形率明显高于对照组.两个杂交家系仔鱼在孵出后逐渐死亡,1周龄时已死亡殆尽,成活率为0;对照组则正常存活和生长.
2.2 AFLP标记分析
由于2个黄姑鱼♀×大黄鱼♂杂交组受精卵及仔鱼发育与成活的情况基本一致,因此AFLP实验只取其中仔鱼较多的一组.采用8对引物组合对杂交家系NL(n=32)初孵仔鱼及其亲本进行扩增,得到456个不同迁移率的条带.其中,母本特异条带 (FSB)178条,父本特异条带 (MSB)187条,双亲的条带全部出现在子代中,未出现非亲条带(见表2,图1).
2.3 AFLP标记在杂交F1仔鱼中的传递与分离
AFLP条带在杂交家系中的传递与分离如表3所示.亲本所扩增出的父本特异条带 (MSB)、母本特异条带 (FSB)和共有条带 (MuB)在子代中都有检测到.84条 (47.2%)FSB、89条(47.6%)MSB和75条 (82.4%)MuB传递给全部杂交后代,94条 (52.8%)FSB、98条(52.4%)MSB和16条 (17.6%)MuB在杂交子代中分离.分离的FSB和MSB中分别有33.0%和28.6%表现为偏分离.NL中FSB和MSB分离位点的平均显性表型频率分别为 (0.62±0.18)和(0.55±0.19).
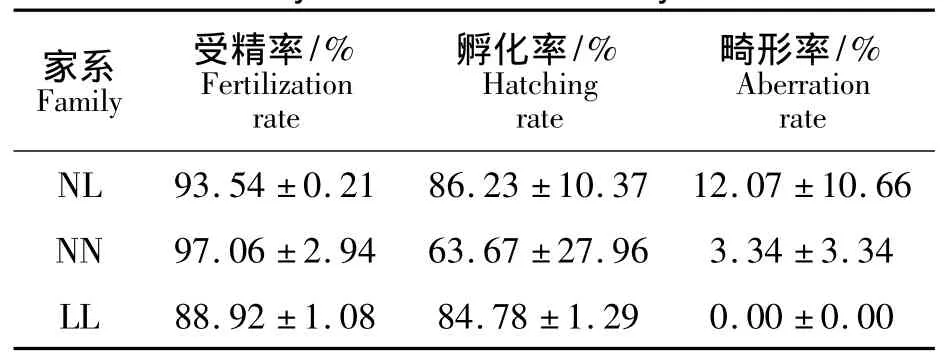
表1 杂交家系和对照组的受精率、孵化率、畸形率Tab.1 Fertilization rate,hatching rate,aberration rate and survival rate of the hybrid and control family
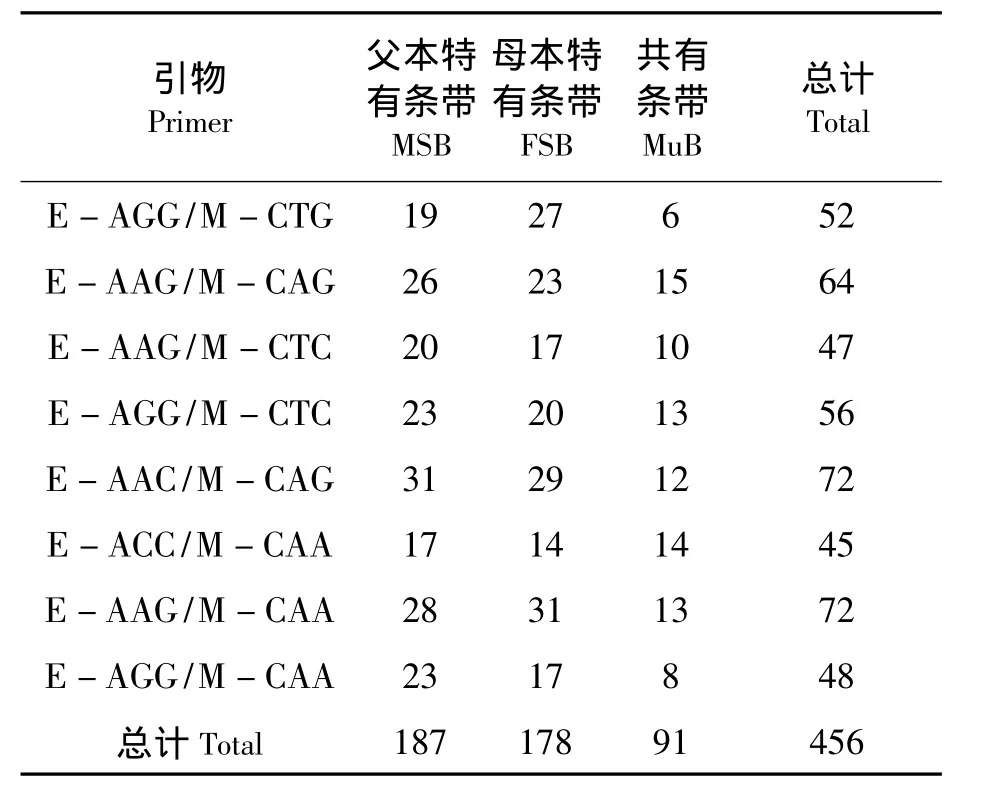
表2 8对引物在NL杂交家系中扩增出的各种条带数Tab.2 Numbers of amplified bands with 8 sets of selective AFLP primers in the NL hybrid family条No.
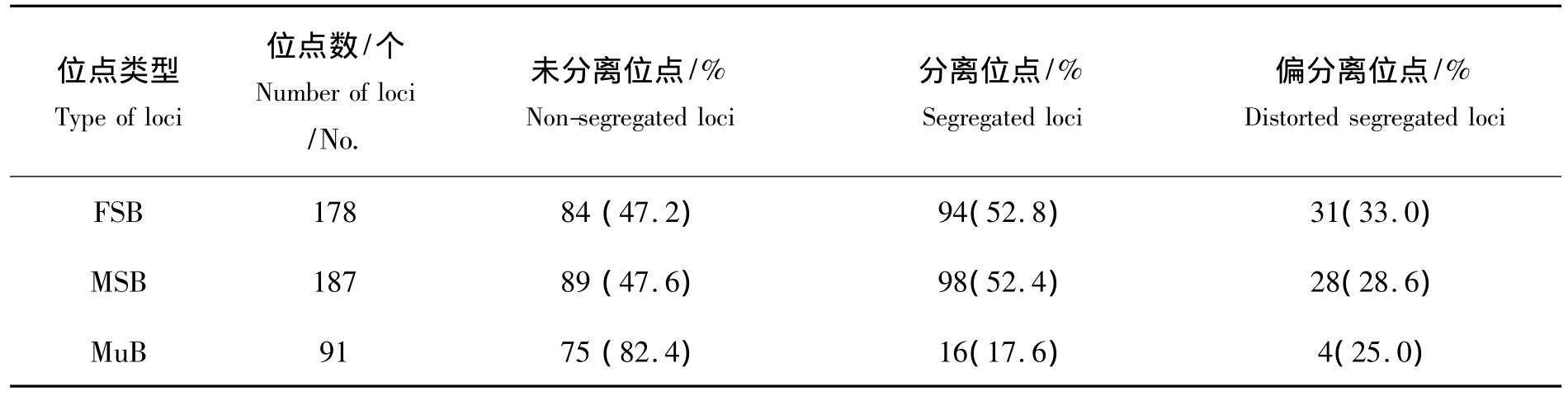
表3 AFLP标记在杂交家系NL中的传递与分离Tab.3 Inheritance and segregation pattern of AFLP markers in the hybrid F1 of N.albiflora(♀)×L.crocea(♂)
2.4 遗传距离与相似系数分析
根据AFLP条带转化的数字矩阵,计算得到母本、父本和子代之间的遗传相似系数和遗传距离(见表4).杂交家系中,父母本之间的遗传距离为1.100;杂交后代与母本之间的平均遗传距离为0.341,与父本之间的平均遗传距离为0.353.用UPGMA方法构建的聚类关系图 (见图2)显示,所有子代个体先聚类为一个相互间遗传距离较小的分支,然后与黄姑鱼母本聚合,最后再与大黄鱼父本聚合.显示所有杂交子代个体与母本的遗传相似度均略大于其与父本的遗传相似度.

表4 黄姑鱼♀×大黄鱼♂家系F1与亲本间的平均遗传距离 (上三角)和平均相似系数 (下三角)Tab.4 The average genetic distance(above diagonal)and genetic similarity(below diagonal)between F1 and their parents in the hybrid family of N.albiflora(♀)× L.crocea(♂)
3 讨论
由于“种间隔离”机制的存在,远源杂交常会发生杂交不受精、杂种不活、杂种不育等多种情况[18].由于远源杂交的复杂性,两种鱼正反交的结果也可能不同,如草鱼♀与三角鲂♂杂交时可以得到杂交苗,而三角鲂♀与草鱼♂杂交很难得到后代[7].本研究中,黄姑鱼♀与大黄鱼♂的杂交后代的受精率、孵化率都与自繁对照组相当,黄姑鱼♀与大黄鱼♂可以正常地进行精卵结合与孵化,没有出现配子不亲和的现象,这与大黄鱼♀与黄姑鱼♂的杂交结果[14]相似.黄姑鱼♀与大黄鱼♂杂交仔鱼在开口后1周内全部死亡,表现出杂种不活的现象,这与文献 [14]的结果也很相似.杂交子代在早期发育阶段成活率低下的现象在其他鱼类的杂交中也比较常见,如大黄鱼♀与黄姑鱼♂杂交、状黄姑鱼♀与大黄鱼♂杂交、大黄鱼♀与状黄姑鱼♂等杂交F1的早期成活率都在0.5%以下[9,14,19].杂种不活的可能机制包括:染色体数目配对和分离紊乱、酶的基因座位或表达的时空顺序不同、核质不相容等[18].黄姑鱼♀与大黄鱼♂的杂交F1无法存活的具体原因有待于进一步研究.
本研究中,8对AFLP引物共计扩出456个条带,其中父本特有条带 (MSB)187条,母本特有条带 (FSB)178条,父母本共有条带 (MuB)仅为91条,由此显示出,黄姑鱼与大黄鱼的AFLP指纹图谱存在较大差异;在双亲中检测到的扩增条带,可以全部在杂交子代中检测到,其中有84条 (47.2%)FSB,89条 (47.6%)MSB和75条(82.4%)MuB传递给全部杂交后代,说明子代同时含有父母本的基因组,为真正的杂交种.对子代与亲本遗传距离的进一步分析表明,子代与母本的遗传距离为0.341,与父本的遗传距离为0.353,显示子代在遗传上略偏向母本.本研究中FSB与MSB分离位点的平均显性表型频率没有显著差异,说明父母本的基因组都没有选择性的丢失,故出现这种遗传上偏向母本的情况可能与杂交子代只拥有母本的线粒体基因组有关.
AFLP标记是显性标记,本研究在亲本中检测到的条带中有 94条 (52.8%)FSB、98条(52.4%)MSB和16条 (17.6%)MuB在杂交子代中发生分离,表明这些条带所在位点在亲本中处于杂合状态.发生分离的FSB和MSB中,分别有33.0%和28.6%表现为偏分离.在大黄鱼♀与黄姑鱼♂的杂交中,也出现了一定比率的偏分离情况[14].AFLP条带在后代中分离出现一定比率的偏离孟德尔比率的现象在其他鱼类、贝类中也比较常见,如虹鳟 (Oncorhynchus mykiss)[20]、皱纹盘鲍 (Haliotis hannai)[21]、斑点叉尾鮰 (Ictalurus punctatus)[22]、牡蛎 (Crassostrea virginica)[23]、合浦珠母贝 (Pinctada martensii)[24]、尼罗罗非鱼(Oreochromis niloticus)[25].与这些结果相比,黄姑鱼♀与大黄鱼♂杂交后代的偏分离属于中等偏上水平.关于出现偏分离的原因,已有多种不同的解释[26].本研究检测的杂交仔鱼数量为32尾,进行随机减少仔鱼数量的模拟计算发现,随着分析的仔鱼数量减少,偏分离的位点比例相应地增加,因此推测本研究中偏分离检出的位点比例较高与检测的标本数还不够多有关;另外,鉴于在大黄鱼SSR分析中发现有致死基因的存在[27],因此也不能排除部分位点的偏分离可能是由于致死基因的存在而引起的.
本研究结果显示,黄姑鱼♀与大黄鱼♂可以成功受精,得到同时含有双亲基因组的杂交子代,且子代受精率、孵化率与对照组相当.杂交子代在遗传上偏向母本,但是成活率极低,本研究中杂交F1在孵化后1周内全部死亡.可见,黄姑鱼♀与大黄鱼♂杂交F1不具有直接应用于生产推广的潜力,但由于杂交子代同时含有双亲的基因组,杂交胚胎和仔鱼等材料仍可用于黄姑鱼和大黄鱼遗传连锁图谱构建和杂种发育的隔离机制等基础研究.

[1]楼允东,张克俭,徐庆登,等.高邮杂交鲫及其亲本遗传性状的比较研究 [J].遗传,1992,16(1):80-85.
[2]贾永义.奥利亚罗非鱼 (♀)×鳜 (♂)杂交的受精生物学及染色体核型的研究 [D].南京:南京农业大学,2005.
[3]王祖熊,黄文郁.鲮鱼混精受精的育种试验[J].水产学报,1985,9(2):203-206.
[4]吴维新,李传武,刘国安,等.鲤与草鱼杂交四倍体及其回交三倍体草鱼杂种的研究[J].水生生物学报,1988,12(4):355-363.
[5]刘国安,吴维新,林临安,等.兴国红鲤同草鱼杂交的受精细胞学研究 [J].水产学报,1987,11(1):17-21.
[6]吴清江,傅洪拓,叶玉珍.酶的基因剂量效应及其对鱼类远缘杂交的影响 [J].水生生物学报,1997,21(2):143-151.
[7]刘筠.中国养殖鱼类繁殖生理学 [M].北京:农业出版社,1993:117.
[8]李建中,刘少军,张轩杰,等.异源四倍体群体遗传多样性的RAPD分析[J].水生生物学报,2005,29(1):97-100.
[9]王晓清,王志勇,谢中国,等.大黄鱼 (♀)与鱼 (♂)杂交的遗传分析[J].水产学报,2008,32(1):51-57.
[10] STANLEY J G.Production of hybrid,androgenetic,and gynogenetic grass carp and carp [J].Trans Am Fish Soc,1976,105:10-16.
[11] BAKOS J.Crossbreeding Hungarian races of common carp to develop more productive hybrids [J].Advances in Aquaculture,FAO,1976,26:633-635.
[12]朱元鼎,罗云林,伍汉霖.中国石首鱼类分类系统的研究和新属新种的叙述 [M].上海:上海科学技术出版社,1963:50-51.
[13]福建省科学技术厅.大黄鱼养殖 [M].北京:海洋出版社,2004.
[14]刘颖,蔡明夷,刘贤德,等.大黄鱼♀与黄姑鱼♂杂交F1家系初孵仔鱼的AFLP分析 [J].水产学报,2010,34(6):852-857.
[15]蔡明夷,刘贤德,武祥伟,等.大黄鱼与黄姑鱼异源三倍体的诱导和微卫星分析 [J].水产学报,2010,34(11):1629-1635.
[16] WANG Z Y,TSOI K H,CHU K H.Applications of AFLP technology in genetic and phylogenetic analysis of penaeid shrimp [J].Biochemical Systematics and Ecology,2004,32(4):399-407.
[17]王志勇,柯才焕,王艺磊,等.从AFLP指纹和标记基因序列看中国养殖的四种鲍的亲缘关系 [J].高技术通讯,2004,14(12):93-98.
[18]楼允东.鱼类育种学 [M].北京:中国农业出版社,2009:87-89.
[19]马梁,王军,陈武各,等.状黄姑鱼与大黄鱼人工杂交子代的胚胎发育 [J].厦门大学学报:自然科学版,2002,41(3):378-382.
[20] YOUNG W P,WHEELER P A,CORYELL V H,et al.A detailed linkage map of rainbow trout produced using doubled haploids[J].Genetics,1998,148:1-13.
[21]刘贤德,刘晓,张国范.皱纹盘鲍杂交F1 AFLP标记偏分离现象初析[J].海洋科学,2007,31(10):70-76.
[22] LIU Z J,KARSI A,LI P,et al.An AFLP - based genetic linkage map of channel catfish(Ictalurus punctatus)constructed by using an interspecific hybrid resource family [J].Genetics,2003,165(2):687-694.
[23] YU Z N,GUO X M.Genetic linkage map of the Eastern oyster Crassostrea virginica Gmelin [J].Biol Bull,2003,204:327-338.
[24]王小玉,俞达辉,黄桂菊,等.合浦珠母贝印度家系F1代的AFLP分析[J].中国水产科学,2007,14(1):52-58.
[25] THOMAS D KOCHERA,WOO - JAI LEE,HALINA SOBOLEWSKA,et al.A genetic linkage map of a cichlid fish,the tilapia(Oreochromis niloticus)[J].Genetics,1998,148:1225-1232.
[26]房经贵,章镇,马正强,等.AFLP标记在两个芒果品种间杂交代的多态性及分离方式 [J].中国农业科学,2000,33(3):19-24.
[27] LI Y Y,CAI M Y,WANG Z Y,et al.Microsatellite-centromere mapping in the large yellow croaker(Pseudosciaena crocea)using induced gynogenetic diploid families[J].Marine Biotechnology,2008,10(1):83-90.
(责任编辑 朱雪莲 英文审校 曹敏杰)
Amplified Fragment Length Polymorphism Analysis on Hybrid Family Between Nibea albiflora♀and Larimichthys crocea♂
SUI Ban-liang1,CAI Ming-yi1,2,LIU Ying1,2,WANG Zhi-yong1,2
(1.Fisheries College,Jimei University,Xiamen 361021,China;2.Key Laboratory of Helthy Mariculture for the East China Sea,Ministry of Agriculture,Xiamen 361021,China)
Hybridization experiments between Nibea albiflora♀and Larimichthys crocea♂were carried out.The average fertilization rate and the hatching rate of the hybrid cross were 93.54%and 86.23%,respectively.However,the hybrids were all dead within one week after hatching.To elucidate the genetic composition of the hybrids,32 larvae from a hybrid family(NL)was investigated by using AFLP technology.Totally,456 AFLP bands were detected in parents and progenies,which included 178 female parent- specific bands(FSB),187 male parent specific bands(MSB)and 91 mutual bands(MuB).All of the fragments were detected in the hybrid progenies,including 84(47.2%)FSB,89(47.6%)MSB and 75(82.4%)MuB.MuB was found in all the progenies,while other bands were segregated in the progenies,with 33.0%of FSB and 28.6%of MSB distorted segregation.The AFLP results suggested that the larvae of N.albiflora♀ ×L.crocea♂were the true hybrids containing whole nuclear genome of both parents,so theyare applicable to construct the genetic maps of female N.albiflora and that of male L.crocea.
Nibea albiflora;Larimichthys crocea;AFLP;hybridization;larva
S 961.2
A
1007-7405(2012)04-0241-06
2012-04-05
2012-05-21
公益性行业 (农业)科研专项 (200903046-05);福建省自然基金面上项目 (2011J01229);集美大学创新团队基金 (2010A002)
隋班良 (1986—),男,硕士生,从事遗传育种与水产生物技术研究.通讯作者:王志勇(1963—),男,教授,博导,E-mail:zywang@jmu.edu.cn
