缩窄性心包炎诊断指标及诊断流程分析
2012-09-06郝宝顺郑荣琴
张 辉,郝宝顺,郑荣琴
缩窄性心包炎 (constrictive pericarditis,CP)是指心脏被致密增厚的纤维化或钙化心包包围,使心室舒张期充盈受限而产生一系列循环障碍的病征[1]。CP多继发于急性心包炎,在我国最常见的病因是结核感染,多是由于急性心包炎后纤维组织增生,造成心包增厚粘连,壁层与脏层融合钙化。当心包缩窄后,心室舒张期充盈受限,心房血量增多,心房增大,心室舒张期充盈减少,使心搏量下降。上下腔静脉回流也因心包缩窄而受限,出现静脉压升高、颈静脉怒张、肝大、腹腔积液、下肢水肿等体循环淤血的表现[2]。CP自然预后不良,最终因为循环衰竭而死亡。治疗该病的惟一有效措施是明确诊断后尽早手术[3]。但是CP多数起病缓慢,较为隐匿,入院诊断时易于漏诊[4],耽误了诊断与治疗时机,造成早期诊断困难的重要原因是其临床表现的多样性和非特异性。本研究通过对与CP有关的临床表现及实验室检查指标进行多因素分析,设置一个合理的诊断流程,以最大限度地减少CP的漏诊。
1 资料与方法
1.1 一般资料 选择2006年1月—2011年10月,在我科检查的临床疑似CP的患者及漏诊的CP患者共128例,最后经病理确诊为CP的患者共48例。
1.2 研究方法 通过症状 (胸闷、胸痛、发热、腹胀、下肢水肿)、体征 (颈静脉怒张、肝肿大、脾肿大、奇脉、心音减弱、心包摩擦音、心界扩大)、生化检验 (贫血、转氨酶增高、低蛋白血症)、胸片 (胸腔积液、心影增大)、心电图(低电压、心房纤颤、心房扑动)、超声检查 (肝脏增大、脾脏肿大、下腔静脉增宽且随呼吸变化率<50%[5-6]、心房扩大、室间隔抖动、左房室瓣E峰吸气相较呼气相>25%[7]、射血分数减低、心包积液[8]、腹腔积液)6个方面进行评估,通过多因素分析了解不同因素对CP的鉴别诊断作用,减少CP的漏诊。
2 结果
2.1 对CP表现的临床症状和实验室检查指标进行多因素分析,其中胸闷、胸痛、发热、腹胀、下肢水肿、肝脾肿大、转氨酶升高、胸腔积液、室间隔抖动、左房室瓣E峰吸气相较呼气相>25%、下腔静脉增宽且随呼吸变化率<50%、心包积液、腹腔积液对于CP的诊断有统计学意义 (OR>1),而颈静脉怒张、奇脉、心音减弱、心界扩大、心包摩擦音、贫血、心影增大、低电压、低蛋白血症、心房纤颤、心房扑动、心房扩大、射血分数减低对于CP的诊断无统计学意义 (OR<1,见表1)。
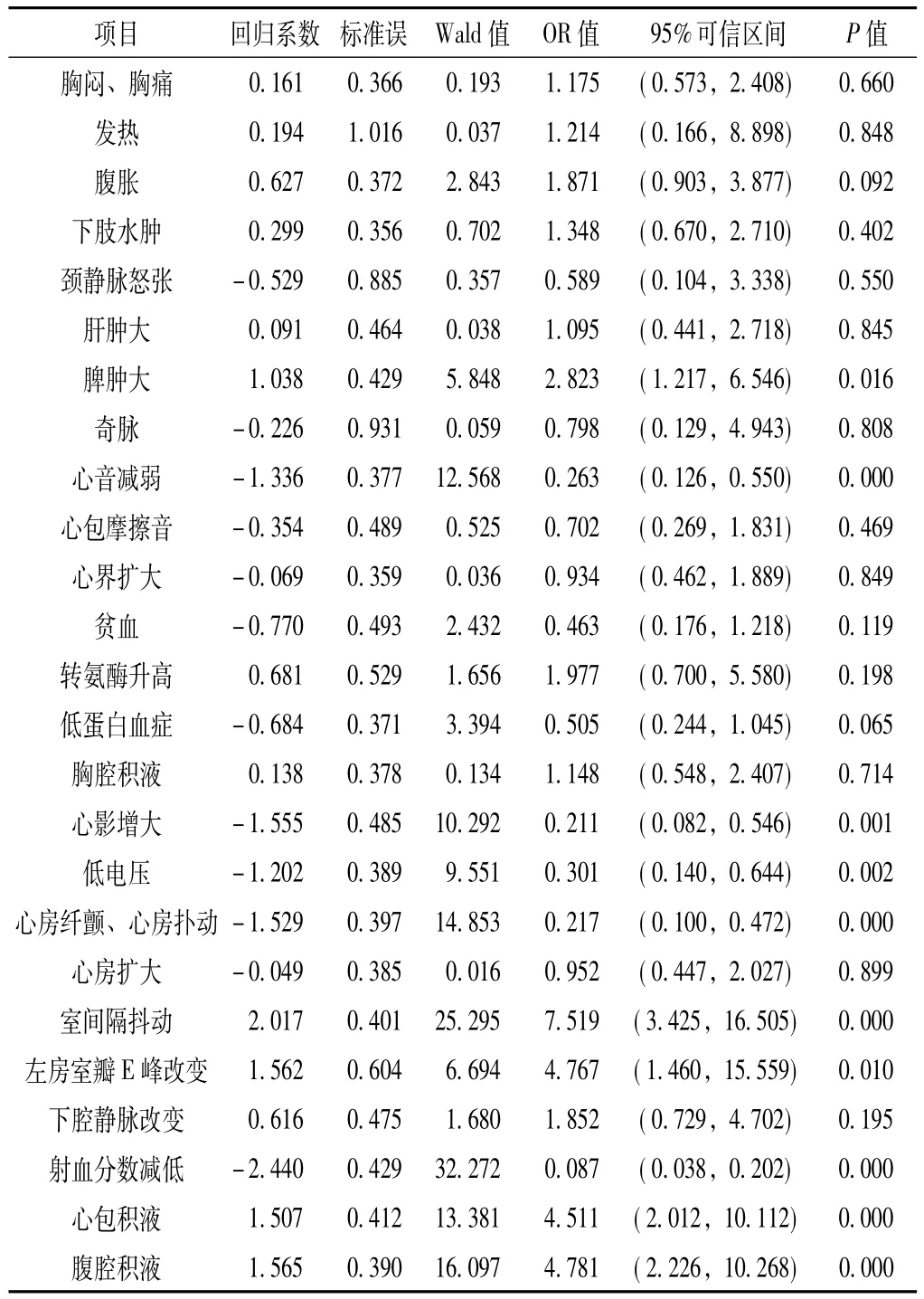
表1 CP临床表现和实验室检查的多因素分析Table 1 Multivariate analysis of the CP clinical manifestations and tests
2.2 根据多因素分析的结果设计了诊断流程 (见图1),多数患者是以非特异性的症状和体征就诊,生化检查、心电图和胸片会提供相关线索。上腹部超声检查有助于了解是否存在肝淤血的声像,从而指导临床医生判断病因,选择较为廉价的心脏超声或者进一步实施心脏CT检查,通过超声或者CT的间接表现 (如心包积液、室间隔抖动、左房室瓣E峰随呼吸改变)或直接表现 (心包增厚)做出诊断。而对于限制型心肌病,当上述检查难以鉴别时,可以通过有创检查 (如心导管检查或者心内膜活检)完成鉴别。
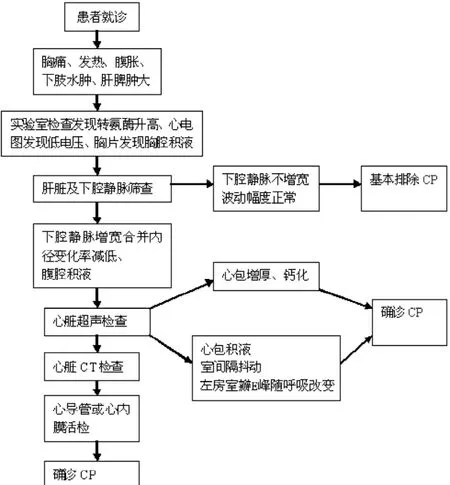
图1 疑似CP患者的诊断流程Figure 1 The diagnostic process of suspected CP patients
3 讨论
3.1 CP诊断中的各种影响因素 本研究结果发现,具有统计学意义的症状和体征,如胸闷、胸痛、发热、腹胀、下肢水肿、颈静脉怒张、肝肿大、脾肿大、奇脉、心音减弱、心包摩擦音、心界扩大的特异性不明显,但是,症状和体征中体循环淤血表现较明显,而许多心脏疾病患者的临床症状和血流动力学改变,如胸闷、胸痛、腹胀、下肢水肿、肝脾肿大、心音减弱、心界扩大与CP非常相似,没有足够的特异性。腔静脉系统压力升高的表现,对于CP的诊断有很大帮助,但是奇脉、颈静脉怒张、心包摩擦音出现的概率较低,难以作为常规的排除标准,而心音减弱、心界扩大特异性不佳。在实验室检查中同样也没有足够的特异性,很多疾病会出现贫血、低蛋白血症、低电压、心房纤颤、心房扑动、心影增大等表现。
3.2 合理设置诊断流程 如果发现体循环淤血的表现,应当首先进行肝脏及腹部血管超声检查。超声检查具有无创、廉价、无放射性和重复性好的优点,是首选的筛查手段,对于CP的诊断能够提供重要帮助。如果在检查中发现肝脏增大、腹腔积液、下腔静脉增宽合并内径变化率减低等声像时,应当直接考虑病变位于肝外,以上声像很可能是由于心脏病变造成,但是上述声像改变特异性仍然不够,因为很多疾病 (如扩张型心肌病、风湿性心瓣膜病、急性心肌炎等)都会造成上述声像变化。如果超声检查发现下腔静脉内径正常而且内径变化率正常,基本可以排除CP的可能。因为无论是心包增厚还是非心包增厚,均会造成血流动力学改变。腹部超声检查阳性的患者需要进行心脏超声检查,超声心动图是诊断CP的重要检查手段,可通过直接测量心包厚度和一些间接超声征象做出诊断。但是经胸超声心动图易受到肺内气体、组织厚度等的干扰,对视野造成影响,不能较为全面地观察心包,因此对于心包厚度常难以做出准确的测量和判断[9-10]。如果能够发现心包增厚的直接声像即可做出诊断,如果发现如心包积液、室间隔抖动、心房扩大、左房室瓣E峰血流随呼吸大幅度改变等声像,则基本可以确诊CP。CT/MRI检查可以发现增厚、钙化的心包,对于CP的诊断有较高的准确性,但是由于CT/MRI检查费用较为昂贵,一般不作为首选影像学检查手段[11-12]。而且,根据以往研究,一部分CP患者心包厚度正常,并不增厚[13-14]。对于难以与限制型心肌病鉴别的患者,需要进行心导管及心内膜活检确诊[15-16]。
综上所述,超声科医生不应仅局限于腹部或者心血管的专业分组界限,也不应局限于作为辅助科室的医生,而应当作为一名“超级医生”,主动为临床医生提供有用的信息,指导临床医生正确的诊治方向。临床医生应熟悉CP各种相关特征的诊断价值,正确选择检查项目和合理设置检查流程,对于CP诊断和鉴别诊断具有重要意义,有助于减少缩窄性心包炎的漏诊。
1 Goel PK,Moorthy N.Tubercular chronic calcific constrictive pericarditis[J].Heart Views,2011,12(1):40-41.
2 冯新恒,李昭屏,李卫虹,等.缩窄性心包炎的临床及超声心动图特征——附36例病例报告及文献复习[J].北京大学学报 (医学版),2007,39(6):642-644.
3 Scohy TV,Maat AP,McGhieJ,etal.Three - dimensional transesophageal echocardiography:diagnosing the extent of pericarditis constrictiva and intraoperative surgical support[J].J Card Surg,2009,24(3):305-308.
4 Gogin EE,Sidorenko BA,Erokhina MG,et al.Diagnosis and effective surgical treatment of constrictive pericarditis [J].Kardiologiia,2011,51(8):91-96.
5 EI Samady MM,AI Moukirish A,Hatle LK,et al.Doppler echocardiographic signs to differentiate between chronic lung disease and right ventricular dysfunction in a child with calcified pericardium [J].J Coll Physicians Surg Pak,2009,19(8):518 -519.
6 张静,田杰,钱永如.儿童缩窄性心包炎39例临床分析[J].中国实用儿科杂志,2006,21(10):748-750.
7 侯跃双,何亚乐,黄新胜,等.缩窄性心包炎二种少见的超声表现及临床意义 [J].中国实用内科杂志,2005,25(7):604-605.
8 Heyse A,Van Durme F,Goethals M.A rapid evolution from effusive- constrictive to constrictive pericarditis[J].Acta Cardiol,2010,65(3):351-352.
9 黄新胜,冯碧霞,何亚乐,等.高频超声对缩窄性心包炎的心包显像研究[J].中国超声医学杂志,2003,19(7):520-523.
10 Dal-Bianco JP,Sengupta PP,Mookadam F,et al.Role of echocardiography in the diagnosis of constrictive pericarditis[J].J Am Soc Echocardiogr,2009,22(1):24 -33.
11 Zurick AO,Bolen MA,Kwon DH,et al.Pericardial delayed hyperenhancement with CMR imaging in patients with constrictive pericarditis undergoing surgical pericardiectomy:a case series with histopathological correlation [J].JACC Cardiovasc Imaging,2011,4(11):1180-1191.
12 Mastouri R,Sawada SG,Mahenthiran J.Noninvasive imaging techniques of constrictive pericarditis [J].Expert Rev Cardiovasc Ther,2010,8(9):1335-1347.
13 Troughton RW,Asher CR,Klein AL.Pericarditis[J].Lancet,2004,363(9410):717-727.
14 Sparano DM,Ward RP.Pericarditis and pericardial effusion:management update[J].Curr Treat Options Cardiovasc Med,2011,13(6):543-555.
15 Mookadam F,Jiamsripong P,Raslan SF,et al.Constrictive pericarditis and restrictive cardiomyopathy in the modern era[J].Future Cardiol,2011,7(4):471 -483.
16 Sengupta PP,Krishnamoorthy VK,Abhayaratna WP,et al.Disparate patterns of left ventricular mechanics differentiate constrictive pericarditis from restrictive cardiomyopathy[J].JACC Cardiovascular Imaging,2008,1(1):29-38.
