粪便嗜酸粒细胞阳离子蛋白对溃疡性结肠炎活动性的评价价值
2012-09-06李俊霞冯珍如邢凌生李志艳柏明见王美玲闫存林郑新芝
龙 彦,李俊霞,冯珍如,邢凌生,李志艳,柏明见,王美玲,闫存林,郑新芝
溃疡性结肠炎 (UC)是一种慢性非特异性肠道炎症性疾病,发病率呈逐年上升趋势,发病机制尚未明确。其临床特点是缓解期和活动期交替发作,维持缓解状态和预防复发是治疗本病的关键[1]。疾病活动性的准确判断是制定合理的治疗方案、监测治疗效果及判断预后的重要依据[2]。目前尚无判断UC疾病活动性的“金标准”,临床以 Mayo疾病活动指数(UCAI)使用最为广泛,但其需综合患者临床症状等多项指标进行判断,具有一定的主观性;内镜判断UC准确、可靠,但因其为有创检查,患者常难以接受;实验室指标血清C-反应蛋白 (CRP)和红细胞沉降率 (ESR)等均为非特异炎性指标。嗜酸粒细胞阳离子蛋白 (ECP)是嗜酸粒细胞的主要颗粒成分之一,是嗜酸粒细胞参与炎症反应的主要物质[3],在粪便标本中相对稳定且检测方法相对成熟[4]。国外文献报道ECP与UC活动性相关,但目前未达成共识[2,4-11];笔者未检索到国内相关报道。本研究通过测定不同活动期UC患者粪便ECP水平并与血清CRP、ESR水平进行比较,旨在探讨粪便ECP对UC活动性的评价价值。
1 资料与方法
1.1 一般资料 选择2010年1月—2012年4月北京大学第一医院消化内科确诊的UC患者45例为病例组,其中男25例,女20例;年龄13~80岁,中位年龄42岁。患者均符合2010年世界胃肠病学组织关于炎症性肠病诊断和治疗实践指南中的诊断标准[1]。根据UCAI、腹泻次数、便血情况、黏膜表现及医师对病情的评定,将患者分为缓解期组和活动期组。缓解期组患者19例,其中男11例,女8例;年龄13~56岁,中位年龄39岁。活动期组患者26例,其中男17例,女9例;年龄21~80岁,中位年龄41岁;根据UCAI将患者分为轻度活动5例,中度9例,重度12例。选择同期本院健康体检正常者30例为对照组,其中男19例,女11例;年龄21~83岁,中位年龄42岁;均无消化道症状及消化道疾病史,便常规正常,便隐血化学法及免疫法均阴性。病例组和对照组均排除变态反应疾病及寄生虫感染病史者。
1.2 标本采集
1.2.1 粪便标本 采用一次性无菌容器留取患者随机粪便标本5.0~10.0 g,24 h内进行预处理或-80℃保存,预处理前室温复融。
1.2.2 粪便标本预处理 (1) 称取粪便标本0.1~1.5 g,按1∶4(体积)比例用提取缓冲液稀释,充分混匀2 min,使其成悬浮液; (2)吸取混悬液1.0 ml于 EP管中,4℃,20 800 g离心30 min,弃去上清,称取剩余半固体质量; (3)吸取剩余混悬液50 μl用提取缓冲液稀释至1.5 ml,充分混匀,4℃放置30 min,4℃,20 800 g离心30 min,留取上清液待测,标本进行重复测定; (4)采用瑞典ImmunoCAP250酶免分析仪,荧光酶免法定量检测,将测得非粪便ECP水平(μg/L)换算为半固体质量 (μg/g),以消除患者粪便性状对结果的影响。粪便ECP提取缓冲液配置:0.05 mol/L Tris-HCl缓冲液,pH 7.4,10 mmol/L乙二胺四乙酸二钠 (EDTA·Na2),0.2%十六烷基三甲基溴化铵 (CTAB),20%甘油,0.05%吐温20,1%小牛血清清蛋白。
1.2.3 血清标本 采集患者清晨空腹肘静脉血3 ml,置于分离胶真空采血管,2 h内3 000 r/min,离心半径5 mm离心10 min,留取患者血清,24 h内或-80℃保存备用,用于血清CRP检测;同时采集患者清晨空腹静脉血2.7 ml,与枸橼酸盐抗凝剂以1∶9比例混匀,置于抗凝真空采血管,用于ESR检测。
1.3 主要仪器及试剂 Sartorius BP211D分析天平,SIGMA 3k15高速离心机,BECKMAN COULTER Allegra X-22R普通离心机,1 000 μl、100 μl加样器,1.5 ml EP 管,一次性无菌标本盒,瑞典Phadia AB Uppsala Sweden ImmunoCAP250免疫分析仪及配套ECP检测试剂盒,MZMY-BX-012 709-80℃冰箱,SAMSUNG BCD-183D 4℃冰箱。
1.4 统计学方法 应用SPSS 13.0软件进行统计分析,粪便ECP、血清CRP水平及ESR经正态分布检验均呈非正态分布,以中位数 (四分位数)表示,两组间比较采用Mann-Whitney秩和检验,以P<0.05为差异有统计学意义;多组间比较采用Bonferroni校正P值后,再分别进行两组间Mann-Whitney秩和检验,以P<0.017为差异有统计学意义;相关性采用Spearman相关分析 (r值);绘制受试者工作特征 (ROC)曲线并计算曲线下面积 (AUC)及Youden's指数,评价各指标判断UC疾病活动性的诊断效能。
2 结果
2.1 各组粪便ECP和血清CRP水平及ESR比较 各组粪便ECP水平比较,差异有统计学意义 (P=0.000);其中活动期组粪便ECP水平高于缓解期组,差异有统计学意义 (检验统计量值为0.00,P<0.05);缓解期组高于对照组,差异有统计学意义 (检验统计量值为0.00,P<0.05)。各组血清CRP水平比较,差异有统计学意义 (P=0.002);其中活动期组血清CRP水平高于缓解期组,但差异无统计学意义 (检验统计量值为0.376,P>0.05);缓解期组高于对照组,差异有统计学意义 (检验统计量值为0.001,P<0.05)。各组血清 ESR比较,差异有统计学意义 (P=0.012);其中活动期组血清ESR高于缓解期组,差异有统计学意义 (检验统计量值为0.013,P<0.05),缓解期组低于对照组,但差异无统计学意义 (检验统计量值为0.097,P>0.05,见表1)。
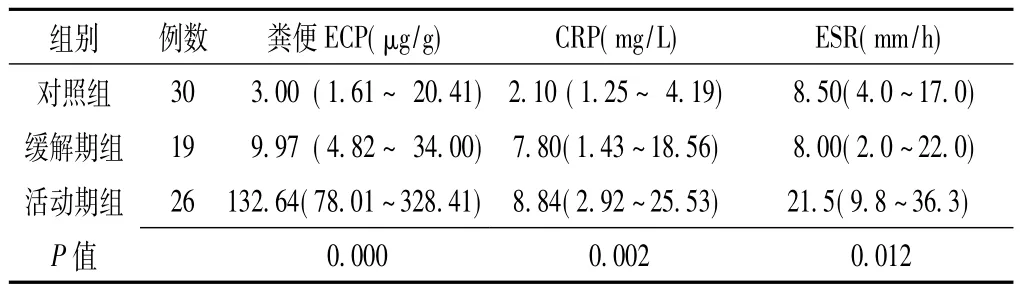
表1 各组粪便ECP和血清CRP水平及ESR比较〔中位数 (四分位数)〕Table 1 Comparison of fecal ECP,serum CRP levels and ESR in patients in each group
2.2 不同活动度活动期UC患者粪便ECP和血清CRP水平及ESR比较 不同活动度活动期UC患者粪便ECP水平比较,差异有统计学意义 (P=0.012);其中轻度活动组与重度活动组比较,差异有统计学意义 (P=0.002);轻度活动组与中度活动组、中度活动组与重度活动组比较,差异均无统计学意义(P值分别为0.019和0.095)。不同活动度活动期UC患者血清CRP水平和ESR比较,差异均无统计学意义 (P>0.017,见表2)。
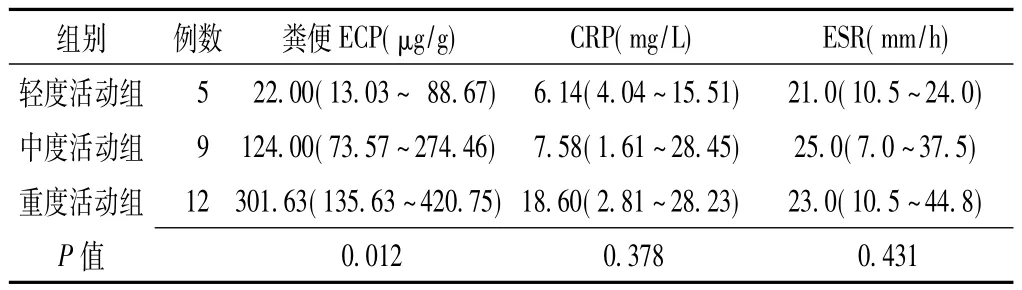
表2 不同活动度活动期UC患者粪便ECP和血清CRP水平及ESR比较〔中位数 (四分位数)〕Table 2 Comparison of fecal ECP,serum CRP levels and ESR in patients with different disease activity
2.3 粪便ECP水平与UCAI的相关性分析 Spearman相关分析显示,粪便 ECP水平与 UCAI呈正相关 (r=0.809,P=0.000,见图1)。
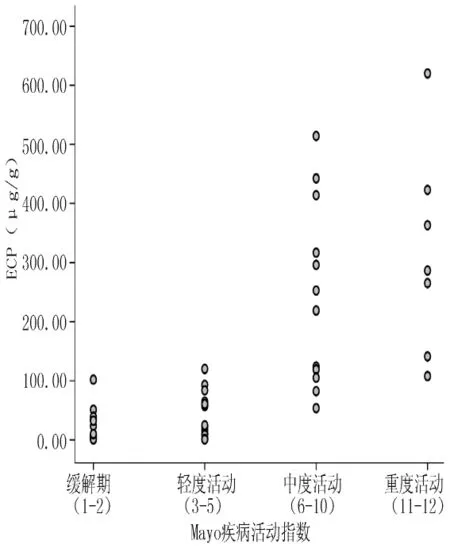
图1 粪便ECP水平与UCAI的相关性分析Figure 1 Correlation of fecal ECP and UCAI
2.4 粪便ECP和血清CRP及ESR判断UC疾病活动性的诊断效能比较 粪便ECP判断UC疾病活动性的AUC为0.939,标准误为 0.033,95%CI为 (0.875,1.004); 血清 CRP 判断UC疾病活动性的AUC为0.578,标准误为0.088,95%CI为(0.405,0.751);血清 ESR判断 UC疾病活动性的 AUC为0.721,标准误为 0.078,95%CI 为 (0.568,0.873,见图2)。当粪便 ECP水平为52.41 μg/g时,Youden's指数最高(1.779),即判断UC疾病活动性的诊断效能最好。

图2 粪便ECP和血清CRP及ESR判断疾病活动性的ROC曲线Figure 2 The ROC curve of fecal ECP,serum CRP and ESR evaluating the disease activity of UC patients
3 讨论
目前尚无判断UC疾病活动性的“金标准”,UCAI能较全面地反映疾病的活动程度,是目前临床应用最广且较为简单的疾病活动度评分系统,由2010年《对我国炎症性肠病诊断治疗规范的共识意见》推荐使用,但其需综合患者临床症状等多项指标进行判断,具有一定的主观性;内镜检查因其有创而不易被患者接受;实验室指标血清CRP、ESR对UC活动程度判断特异性较低,尤其是当患者合并肠道内感染时,且ESR受很多因素的影响。因此,临床迫切需要一种理想的标记物,能快速、简便、敏感且特异地反映UC的病情活动。
ECP是嗜酸粒细胞颗粒的主要成分之一,最先由Olsson等[3]于1972年从慢性粒细胞白血病患者白血病细胞分离,富含精氨酸及锌指结构,分子量为16~22 kDa,等电点10.8,具有细胞毒性和免疫调节作用,是嗜酸粒细胞参与炎症反应的主要物质。研究证明,肠道黏膜嗜酸粒细胞激活与多种消化道疾病发病机制有关,如嗜酸粒细胞性胃肠炎[10],胶原性肠病[11]及 UC 等[4-11],且能反映疾病的活动性。
Peterson等[8]研究发现,UC患者肠道黏膜病理内镜下可见嗜酸粒细胞浸润增加,Bischoff等[10]通过免疫组化法检测发现,UC患者肠道黏膜细胞间隙ECP沉积增加,Peterson等[4]和Kristjánsson等[5]检测UC患者肠道灌洗液和粪便标本发现,其ECP水平明显升高。这些研究均提示ECP有望成为反映肠道炎症的可靠标记物。
本研究结果显示,各组粪便ECP水平间差异有显著性,且活动期组粪便ECP水平高于缓解期组,缓解期组高于对照组,差异均有显著性,与Peterson等[4]研究结果一致。不同活动度活动期UC患者粪便ECP水平差异有显著性,且轻度活动组与重度活动组粪便ECP水平差异有显著性,轻度活动组与中度活动组、中度活动组与重度活动组粪便ECP水平差异均无显著性。分析可能与嗜酸粒细胞参与UC肠道活动期炎症反应,但并非主导其活动度的主要因素有关,也可能与本研究样本量较小有关,有待于进一步扩大样本量进行证实。
本研究同时发现,粪便ECP水平与UCAI呈正相关,与文献报道一致;通过绘制ROC曲线发现,粪便ECP的AUC明显大于血清CRP和ESR,当粪便ECP水平为52.41 μg/g时,判断UC疾病活动性的诊断效能最好。
临床处于缓解期的UC患者可能仍有“轻微”或“局限性”黏膜炎症存在,易导致复发,但内镜检查对此类“轻微”或“局限性”黏膜炎症漏检率较高。Lampinen等[9]通过对UC患者肠道黏膜洗脱细胞进行流式细胞术和免疫组化检测发现,缓解期UC患者肠道黏膜未激活嗜酸粒细胞计数明显高于活动期组和健康对照组。本研究结果发现,部分UC缓解期患者粪便ECP水平升高不明显,但病理组织活检仍可见大量嗜酸粒细胞浸润,提示缓解期UC患者部分存在复发风险。有文献报道缓解期UC患者嗜酸粒细胞计数增加可能与肠道黏膜上皮修复和纤维化过程有关[10]。因此,临床上发现UC缓解期患者粪便ECP水平轻度升高应引起重视,以预防疾病复发。
此外,Shichijo等[12]采用抗ECP抗体促进葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎肠道黏膜上皮再生并下调肠道黏膜免疫反应,进而诱导小鼠结肠炎缓解。明确ECP在UC发病机制中的作用有助于为临床提供更有效的UC治疗方法,有待进行更多临床试验进一步证实。
综上所述,粪便ECP与UCAI有很好的相关性,诊断效能优于血清CRP和ESR,有助于临床判断UC活动性,但对活动期患者活动度的判断价值有限;可作为一种简便、经济、准确、灵敏、无创的生物标记物用于监测UC活动性。
1 Bernstein CN,Fried M,Krabshuis JH,et al.World Gastroenterology Organization Practice Guidelines for the diagnosis and management of IBD in 2010 [J].Inflamm Bowel Dis,2010,16(1):112-124.
2 James D,Lewis.The utility of biomarkers in the diagnosis and therapy of inflammatory bowel disease [J].Gastroenterology,2011,140(6):1817-1826.
3 Venge P,Byström J,Carlson M,et al.Eosinophil cationic protein(ECP):molecular and biological properties and the use of ECP as a marker of eosinphil activation in disease [J].Clin Exp Allergy,1999,29(9):1172-1186.
4 Peterson CG,Eklund E,Taha Y,et al.A new method for the quantification of neutrophil and eosinophil cationic proteins in feces:establishment of normal levels and clinical application in patients with inflammatory bowel disease [J].Am J Gstroenterol,2002,97(7):1755-1762.
5 Kristjánsson G,Venge P,Wanders A,et al.Clinical and subclinical intestinal inflammation assessed by the mucosal patch technique:studies of mucosal neutrophil and eosinophil activation in inflammatory bowel diseases and irritable bowel syndrome [J].Gut,2004,53(12):1806-1812.
6 Saitoh O,Kojima K,Sugi K,et al.Fecal eosinophil granule-derived proteins reflect disease activity in inflammatory bowel disease[J].Am J Gastroenterol,1999,94(12):3513-3520.
7 Desreumaux P,Nutten S,Colombel JF,et al.Activated eosinophils in inflammatory bowel disease:do they matter? [J].Am J Gastroenterol,1999,94(12):3396-3398.
8 Peterson CG,Sangfelt P,Wagner M,et al.Fecal levels of leukocyte markers reflect disease activity in patients with ulcerative colitis[J].Scand J Clin Lab Invest,2007,67(8):810-820.
9 Lampinen M,Rönnblom A,Amin K,et al.Eosinophil granulocytes are activated during the remission phase of ulcerative colitis [J].Gut,2005,54(12):1714-1720.
10 Bischoff SC,Mayer J,Nguyen QT,et al.Immunohistological assessment of intestinal eosinophil activation in patients with eosinophilic gastroenteritis and inflammatory bowel disease [J].Am J Gastroenterol,1999,94(12):3531-3539.
11 Sangfelt P,Carlson M,Thörn M,et al.Neutrophil and eosinophil granule proteins as markers of response to local prednisolone treatment in distal ulcerative colitis and proctitis [J].Am J Gastroenterol,2001,96(4):1085-1090.
12 Shichijo K,Makiyama K,Wen CY,et al.Antibody to eosinophil cationic protein suppresses dextran sulfate sodiuminduced colitis in rats[J].World J Gastroenterol,2005,11(29):4505-4510.
