能量平衡与HPO生殖轴功能的关系
2012-09-04王人卫
赵 璨,王人卫
知网搜索数据显示,1992年至今,国内对生殖系统的研究论文有5 003篇,其中与能量相关的研究仅有11篇;同时20年来对月经失调的研究有911篇,其中与能量相关的研究只有7篇。美国国家生物技术信息中心(National Center of Biotechnology Information, NCBI)建立的生物医学文献数据库(PubMed)是目前世界上此领域最全最新的数据库,使用PubMed进行搜索显示,国外20年内对生殖系统研究的论文有53 026篇,其中与能量相关的有1 333篇,近10年则有731篇,呈现较高的增长率。另外,通过PubMed搜索显示,国外20年来对月经紊乱的研究论文有2 448篇,其中与能量相关的文章也只有118篇。目前越来越多的外国学者对能量平衡与生殖系统间的关系产生兴趣,并提出大胆的设想,本文就国内外能量平衡与生殖系统,特别是下丘脑-垂体-卵巢轴(Hypothalamus-pituitary-ovarian axis,HPO轴)的关系进行阐述,为运动性月经失调的机制研究提供参考。
维持细胞的生物合成和代谢需要源源不断的燃料供应,但食物的可获得性和能量的需求在大多数的栖息地是有波动的。控制能量平衡的机制与控制生殖系统的机制之间不仅相互联系,而且交互作用,它们共同促使机体在波动的代谢条件下维持高耗能的生殖功能,成功完成繁殖的任务。因此,如果不了解控制能量平衡的机制与生殖系统HPO轴的关系,就很难理解能量平衡的生理机能,以及人类总是趋向于积极的能量平衡和过多的储能的现象[1-5];而对于了解运动性月经失调(Exercise-Associated Menstrual Disturbances,EAMD)的产生机制也是如此[6]。
至于这些机制之间的联系则产生于生物学的核心统一的原则及综合进化论。根据这一理论,我们观察到的生理机制,是由祖先族群通过随机的基因变异行动的自然选择的结果。因此,控制能量摄入、存储和消耗的机制之所以存在,因为其在某种程度上作为一个繁殖优势是可遗传的,也正因为这些机制的存在动物才得以生存与繁殖。
监控内部和外部能量的可利用率的能力对于联系生殖系统和能量平衡之间是极为重要的。这种能力让动物根据波动的能量和生殖的条件安排他们的行为选择。例如,当食物丰富和能量需求很低,能源是开放给生命的所有过程,包括蛋白质的生物合成、离子梯度的维护、代谢废物的处理、运动、觅食、摄食和消化。反之,则只趋向于维持生存的能量供给[6]。
1 能量对HPG系统的影响
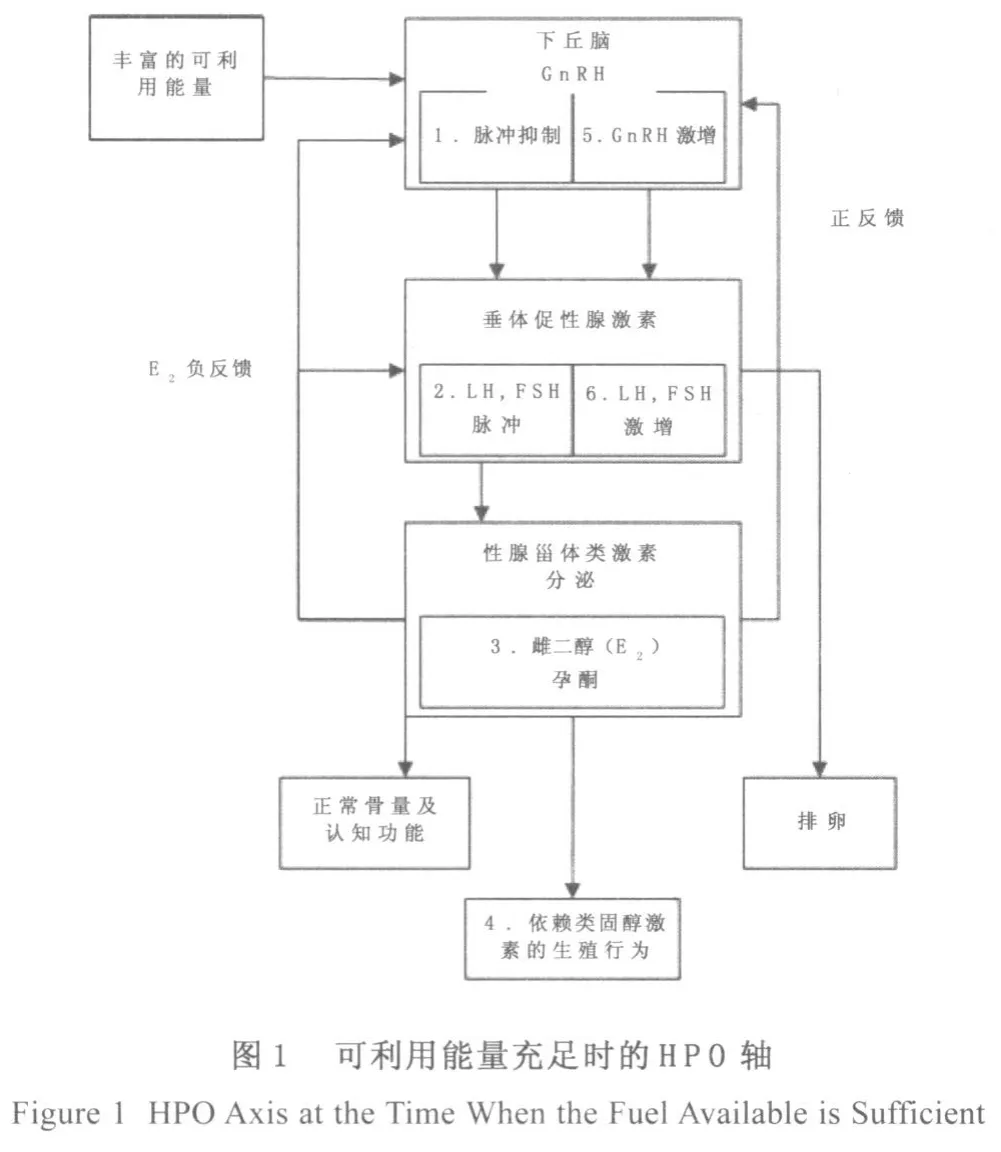
在能量平衡的维持过程中涉及大量的化学信使和代谢过程。能量平衡的调控机制与繁殖成功率有关,这些信使及代谢过程中很大程度上影响生殖过程,如下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonadal axis, HPG轴)。当女性没有处于能量供应方面的挑战时,HPG系统的调控过程如图1所示。HPG系统的关键控制在于涵盖视前区(preoptic area,POA)到下丘脑的弓形核(arcuate nucleus, Arc)的这部分区域促性腺素释放激素(gonadotropinreleasing hormone,GnRH)神经元胞体的定位。神经激素Gn RH的分泌有两种模式。脉冲模式发生在卵泡期,当雌二醇(E2)浓度低的时候,对GnRH及黄体生成素(Luteinizing Hormone,LH)的分泌有负反馈的影响;也就是说,E2限制Gn RH和LH分泌在相对较低的水平上。E2在排卵周期突然大量分泌,此时对GnRH起到积极的反馈影响。目前对GnRH脉冲发生器的研究并未明了,多数学者认为GnRH脉冲发生器是一种振荡的神经回路,其导致GnRH脉动式地从第三脑室正中隆起末端分泌到垂体门脉系统。GnRH的每一个脉冲,促使LH的一个脉冲释放到垂体前叶[7],卵泡刺激素(folliclestimulating hormone,FSH)也能被释放,LH和FSH脉冲对于卵泡的形成和激素的分泌是至关重要的。当E2的浓度不断上升,对GnRH和LH进行积极地反馈,而E2的这种活动对于LH来说是必须的,从而触发排卵(图1)。
代谢的挑战,如食物的限制,将在许多层面抑制HPG系统[8](图2和3),然而关键所在是Gn RH脉冲发生器,而且这些影响男性和女性是类似的[9](图2)。在缺少食物或者限制饮食的大鼠、羊、猪、牛、猴和妇女中,通过GnRH脉冲性的治疗,LH的脉动式地分泌、卵泡的形成、排卵都可以得到恢复[10-18]。代谢调节机制所面临的能源方面的挑战对于HPG系统的抑制,一部分通过增加E2的负面反馈作用的灵敏度,另一部分是由于甾体类化合物单独作用的效果。此外,这类挑战除了影响LH的脉冲分泌,也改变了GnRH、LH、FSH的波动。在雄性大鼠中,食品的剥夺会抑制GnRH合成[19]。通过FOS样免疫活性(c-f os-p rotein-like immunoreactivity,FOS-like immunoreactivity)检测发现,限制叙利亚雌性仓鼠的食物或其它代谢机制的紊乱,将导致其GnRH神经元免疫反应中的神经激活降低[9]。能量的挑战,如剥夺羊的食物,可抑制GnRH分泌到垂体门脉系统的循环[20,21]。能量的挑战使GnRH免疫反应性基因表达要么不变要么增加,这或许反映神经元GnRH释放受到抑制[22,23,18]。GnRH分泌的抑制导致一连串的抑制效果,包括减少性激素的分泌,卵泡发育迟缓,抑制甾体类性激素的合成,以及在啮齿动物和非人类的灵长类动物,需甾体类激素参与的生殖行为随之减少。此外,国内学者王人卫等[24]指出,可利用能量短缺可导致HPO轴细胞超微结构的改变,大鼠的细胞结构甚至出现核裂解,从结构上证明了HPO轴的调控障碍,而这类障碍大都被GnRH的分泌抑制所影响。在鸟类和哺乳动物中,GnRH转录或转化可能是诱导排卵的一个重要的关键步骤;食物限制引起麝鼩的生殖功能的障碍,可通过重新供给食物而迅速逆转[25-27]。相对于自由进食的雌性鼩,食物限制导致雌性麝鼩下丘脑视前区的GnRH前体细胞免疫反应增加和正中隆起的GnRH-I含量升高,然而通过90 min的任意进食可逆转麝鼩的这种变化[26,27]。这些研究结果强调了能量代谢的挑战对GnRH神经元的直接影响。
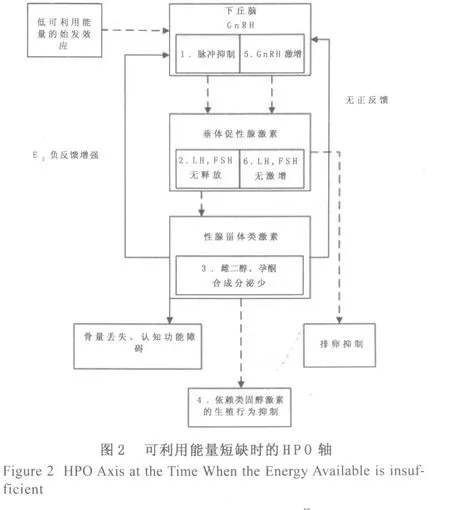
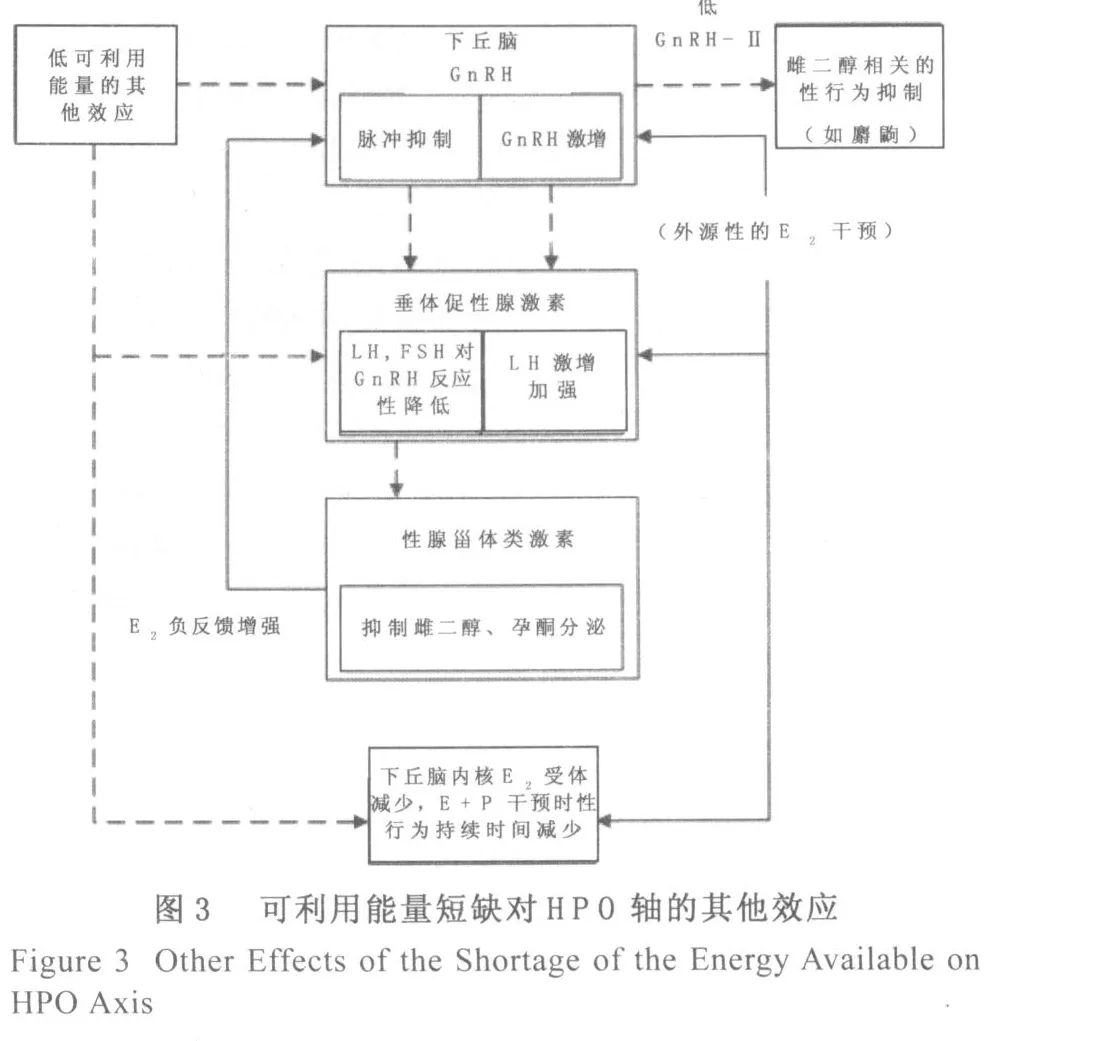
图1当有丰盛的代谢燃料时,排卵周期以GnRH脉动式地从下丘脑内分泌细胞的末端分泌释放为特征。每一个脉冲的GnRH被释放到垂体门脉系统,进而刺激LH从垂体前叶脉冲分泌进入血液循环。FSH与LH通过各自在卵巢卵泡中的受体脉冲分泌,从而刺激卵泡的形成。在卵泡的形成时期(即排卵周期中的卵泡期),相对低的E2循环浓度对下丘脑GnRH与垂体促性腺激素的分泌有负反馈的影响。E2也刺激自己的合成及分泌,因此,E2浓度在体循环继续上升。在浓度较高时,E2对于下丘脑GnRH和垂体促性腺激素的分泌具有积极的反馈影响。E2诱导LH的激增,从而诱发排卵[28,29]。
图2可利用代谢燃料短缺的初步效果是抑制下丘脑GnRH脉冲发生器导致一连串的事件,抑制垂体促性腺激素分泌,抑制卵泡发展和分泌及E2和P的分泌。抑制甾体类激素的影响是抑制发情的行为和抑制LH激增。当卵巢的甾体类激素长期维持较低的水平时,将导致女性骨量的丢失,也许甚至出现认知功能障碍。由于在限制食物的雌性动物中,通过特异性的GnRH的脉冲外源性的补充治疗,可以恢复垂体促性腺激素的分泌、卵泡的发育、卵巢激素的分泌以及发情的行为,推断GnRH脉冲发生器是能量负平衡引发生殖功能障碍的始发部位[28,29]。
图3可利用代谢燃料的短缺对GnRH脉冲发生器以外的生殖系统的功能有直接的影响。通过对禁止进食或长期限制饮食的动物进行外源性的GnRH或者E2和P的供给,已经证明了这些效应。例如,与禁止进食的动物相比,随意进食的羊或大鼠在补充外源性的GnRH后,脑垂体的反应表现更为明显。卵巢切除的仓鼠在禁止进食的情况下接受E2联合P的外源性供给,出现发情行为延迟,在前凸的姿势的维持时间明显比任意进食的仓鼠要短。麝鼩是种没有自发的排卵周期的动物,而且它的性行为是独立于E2水平,限制麝鼩的进食则会抑制其性行为。麝鼩在限制进食的情况下,通过GnRH-II的治疗,其性行为会恢复,但GnRH-I的治疗则无法恢复。另外,关于禁止饮食或者限制饮食有一个模棱两可的效果是:当进行高剂量的E2治疗时,引起垂体LH反应的是增强的效果,而不是抑制[28,29]。
另外,大量能量代谢因子与性腺轴功能密切相关,如ghrelin在体内能量不足时能抑制GnRH、LH、E2的释放进而抑制生殖功能[30,31];leptin、T3、IGF-1对生殖功能有正向调节作用[32-36]。我国学者刘晓丽通过典型相关分析探讨能量代谢指标与性腺轴激素之间的关系,其研究表明ghrelin、leptin、T3、IGF-1为能量代谢指标对性激素功能影响的主要因素[37]。
总之,有研究表明,能量代谢的挑战在许多层面抑制生殖活动,包括Gn RH脉冲发生器(图2)、Gn RH、LH、FSH波动(图3),最后,通过可利用能量对大脑机制的直接效应,有效地优化支配求爱、交配和摄食行为(图3)。
2 运动性月经失调和能量代谢
运动性月经失调和能量代谢的相关性研究经历了漫长的过程。早在20世纪70年代研究证明,运动与青春期延缓或继发性闭经之间存在联系。20世纪80年代人们对运动与闭经的关系有了更进一步的了解,尤其是芭蕾舞演员(Frisch et al.1980; Warren et al.1986)和长跑运动员的闭经问题。1997年美国运动医学学会(ACSM)提出女运动三联征会相互影响饮食失调、闭经和骨质疏松三因素形成的综合症[38]。三联征发生的可能原因是当能量摄入不能满足运动耗能要求,引起体内能量再分配,此时机体牺牲耗能较高的生殖系统,从而支持运动的能耗[39,40]。
21世纪初,Loucks[41-45]提出,运动性月经失调发生的始发因素是长期的能量短缺,即可利用能量(机体摄入的能量与活动消耗的能量之间的差值)假说,该假说认为能量摄入与能量消耗之间的不平衡是形成月经失调的重要原因。运动员的能量摄入甚至高于普通人群,但是能量消耗却可能比普通人群高出好几倍[46],Raymond等已明确提出“没有很强的生物学指令让能量摄入适应性地增加以满足过大的能量消耗”,食物缺乏导致饥饿,由运动引起的能量负平衡却不会引起该效应[47]。国内学者尚焦在对不同专项的运动员进行饮食和能量的监控后,发现月经正常组和月经紊乱组在能量的摄入和消耗方面存在差异,该研究说明了可利用能量处于负平衡状态容易导致月经紊乱[48]。2007年ACSM明确指出可利用能量减少是引起EAMD的关键因素[49]。
EAMD包括运动性闭经(Athletic Amenorrhoea, AA)、月经初潮延迟、月经稀疏、无排卵周期和LPD等,按严重程度划分为闭经>月经稀疏>无排卵周期>LPD[44]。王杰龙等研究发现,月经失调在女运动员中发生率很高,发生较轻程度的月经失调(LPD和无排卵)时,月经中期LH峰值降低或消失;无排卵时雌激素与孕激素分泌抑制,LPD时孕激素分泌抑制,卵巢功能抑制[50]。且有Souza等研究发现月经稀疏的女性尿液中E2浓度较低[51]。运动性闭经是下丘脑型的,并伴随着循环系统中促性腺激素和卵巢激素的低下和慢性抑制[45],且有研究报道可利用能量短缺成为导致成年女性E2以及P表达降低的一个重要诱因[52]。研究证明,哺乳动物GnRH神经元活性和LH脉冲性分泌受脑内可利用葡萄糖的调控。闭经运动员的血糖水平比月经正常的运动员和不运动女性低1 0%,并可表现出低血糖水平[53]。S.E.Tomten[54]等人通过比较月经正常和失调运动员血清中FSH、LH和E2水平发现,月经正常运动员LH为7.6 U/L,E2为32 pg/ml,而AMI运动员LH为2.8 U/L,E2为10 pg/ml,AMI运动员的雌激素和孕激素水平明显下降,并且分泌状况接近于绝经后妇女。
3 展望
既然EAMD是由于机体能量负平衡引起,因此,在不改变运动员的运动负荷下,可通过营养干预提高机体的能量摄入来逆转运动性月经失调状态。Williams等对灵长类动物猕猴进行了一项实验,在保持其训练负荷不变的情况下增加能量的摄入,运动性闭经的猴月经周期恢复,这对可利用能量和月经周期的关系提供了有力的证据[55]。国内学者李擎等[56]报道:高能量膳食饮食可以有效地改善动情周期抑制大鼠的卵巢功能,然而大鼠的FSH和LH水平与安静组无显著性差异。大量实验研究表明了机体能量的有效补充能改善运动性月经失调,给未来的实验和防治运动性月经失调临床实践提供了理论及实验依据。
由于葡萄糖液的高渗性,单纯摄入葡萄糖液会对胃的排空产生一定的抑制作用;低聚糖在提供等量葡萄糖的条件下,渗透压平均仅为葡萄糖的1/4。较低的渗透压有助于水的快速吸收,以保证运动中水的补充,且避免了一次大量吸收后血糖急剧升高引起的胰岛素反应[57]。未来研究可探讨逆转EAMD三大能源物质的比例和能量补充的阈值,以及补糖方式对EAMD的恢复作用及运动性月经失调与能量平衡、内分泌激素变化之间的关系。
[1]Bronson FH. (1989). Mammalian reproductive biology. The University of Chicago Press. Chicago, London
[2]Bronson FH. (2000). Puberty and energy reserves: a walk on the wild side.In: Wallen K, Schneider JE, editors. Reproduction in context: social and environmental influences on reproduction.MIT Press; Cambridge: 15-34.
[3]Schneider JE, Watts AG. (2002). Energy balance, ingestive behavior and reproductive success. In: Pfaff D, Etgen A, Fahrbach SE, Rubin RT, editors. Hormones, brain and behavior. San Diego(CA): Elsevier; p. 435-23.
[4]Wade GN, Schneider JE. (1992). Metabolic fuels and reproduction in female mammals. Neurosci Biobehav Rev;16:235-72.
[5]Wade GN, Schneider JE, Li H-Y. (1996). Control of fertility by metabolic cues. Am J Physiol;270:E1-19.
[6]Group, The eshre capri workshop. (2006). Nutrition and reproduction in women[J]. Human Reproduction Update, 12(3):193-207.
[7]Clarke IJ, Cummins JT. (1982). The temporal relationship between gonadotropin releasing hormone (GnRH) and luteinizing hormone (LH) secretion in ovariectomized ewes. Endocrinology;111:1737-1739.
[8]Group, The ESHRE Capri Workshop. (2006). Nutrition and reproduction in women[J]. Human Reproduction Update, 12(3):193-207.
[9]Berriman SJ, Wade GN, Blaustein JD. (1992). Expression of Foslike proteins in gonadotropin-releasing hormone neurons of Syrian hamsters: effects of estrous cycles and metabolic fuels.Endocrinology;131:2222-2228.
[10]Armstrong JD, Britt JH. (1987). Nutritionally-induced anestrus in gilts: metabolic and endocrine changes associated with cessation and resumption of estrous cycles. J Anim Sci;65:508-523.
[11]Bronson FH. (1986). Food-restricted, prepubertal female rats:rapid recovery of luteinizing hormone pulsing with excess food,and full recovery of pubertal development with gonadotropinreleasing hormone. Endocrinology;118:2483-2487.
[12]Cameron JL. (1996). Regulation of reproductive function in primates by short-term changes in nutrition. Rev Reprod;1:117-126.
[13]Cameron JL, Nosbisch C. (1991). Suppression of pulsatile luteinizing hormone and testosterone secretion during short term food restriction in the adult male rhesus monkey (Macaca mulatta).Endocrinology;128:1532-1540.
[14]Day ML, Imakawa K, Zalesky DD, Kittok RJ, Kinder JE. (1986).Effects of restriction of dietary energy intake during the prepubertal period on secretion of luteinizing hormone and responsiveness of the pituitary to luteinizing hormone-releasing hormone in heifers. J Anim Sci; 62:1641-1647.
[15]Foster DL, Olster DH. (1985). Effect of restricted nutrition on puberty in the lamb: patterns of tonic luteinizing hormone (LH)secretion and competency of the LH surge system.Endocrinology;16(1): 375-381.
[16]Kile JP, Alexander BM, Moss GE, Hallford DM, Nett TM. (1991).Gonadotropin-releasing hormone overrides the negative effect of reduced dietary energy on gonadotropin synthesis and secretion in ewes. Endocrinology;128(2):843-849.
[17]Manning JM, Bronson FH. (1991). Suppression of puberty in rats by exercise: effects on hormone levels and reversal with GnRH infusion. Am J Physiol;260:R717-723.
[18]McShane TM, Petersen SL, McCrone S, Keisler DH. (1993).Inf luence of f ood restriction on neuropeptide-Y,proopiomelanocortin, and luteinizing hormone-releasing hormone gene expression in sheep hypothalami. Biol Reprod;49(4):831-839.
[19]Gruenewald DA, Matsumoto AM. (1993). Reduced gonadotropin-releasing hormone gene expression with fasting in the male rat brain. Endocrinology;132:480-482.
[20]Foster DL, Bucholtz DC. (1995). Glucose as a possible metabolic cue timing puberty. In: Bergada C, Moguilevsky JA, editors.Serono international symposium on puberty: basic and clinical aspects. Rome, Italy: Ares-Serono Symposia; p. 319-332.
[21]I’Anson H, Manning JM, Herbosa CG, Pelt J, Friedman CR,Wood RI, et al. (2000). Central inhibition of gonadotropinreleasing hormone secretion in the growth-restricted hypogonadotropic female sheep. Endocrinology;141:520-527.
[22]Ebling FJ, Wood RI, Karsch FJ, Vannerson LA, Suttie JM, Bucholtz DC, et al. (1990). Metabolic interfaces between growth and reproduction: III Central mechanisms controlling pulsatile luteinizing hormone secretion in the nutritionally growth-limited female lamb. Endocrinology;126(5):2719-2727.
[23]I’Anson H, Terry SK, Lehman MN, Foster DL. (1997). Regional differences in the distribution of gonadotropin-releasing hormone cells between rapidly growing and growth-restricted prepubertal female sheep. Endocrinology;138:230-236.
[24]王人卫,陆爱云,郭仕达等.运动性动情周期抑制的大鼠下丘—垂体轴细胞超微结构的变化[J].中国运动医学杂志,2001,20(3):260-262.
[25]Gill CJ, Rissman EF. (1997). Female sexual behavior is inhibited by short- and long-term food restriction. Physiol Behav;61:387-394.
[26]Temple JL Rissman EF. (2000). Acute re-feeding reverses food restrictioninduced hypothalamic-pituitary gonadal axis deficits.Biol Reprod;63:1721-1726.
[27]emple JL, Rissman EF. (2000). Brief re-feeding restores reproductive readiness in food restricted female mush shrews (Suncus murinus). Horm Behav;38:21-28.
[28]Mangels RA, Jetton AE, Powers JB, Wade GN. (1996). Food deprivation and the facilitory effects of estrogen in female hamsters: the LH surge and locomotor activity. Physiol Behav;60:837-843.
[29]Sprangers SA, Piacsek BE. (1997). Chronic underfeeding increases the positive feedback efficacy of estrogen on gonadotropin secretion. Proc Soc Exp Biol Med;216:398-403.
[30]WILLIAMS N.I., J.L. REED, H.J. LEIDY. (2010). Estrogen and progesterone exposure is reduced in response to energy deficiency in women aged 25-40 years[J]. Hum. Reprod, 25(9): 2328-2339.
[31]Fernandez-Fernandez R, Martini AC, Navarro VM, et al. (2006).Novel signals for the integration of energy balance and reproduction [J]. Mol Cell Endocrinol, 254-255:127-132.
[32]Barb CR, Hausman GJ, Lents CA. (2008). Energy Metabolism and Leptin: Effects on Neuroendocrine Regulation of Reproduction in the Gilt and Sow[J]. Reprod Dom Anim, 43(2):324-330.
[33]Gregoraszczuk EL, Ptak A, Wojciechowicz T, et al. (2007).Action of IGF-I on expression of the long form of the leptin receptor (ObRb) in the prepubertal period and throughout the estrous cycle in the mature pig ovary[J]. J Reprod Dev, 53(2):289-295.
[34]Gregoraszczuk EL, Rak A, Wojtowicz A, et al. (2006). Gh and IGF-I increase leptin receptor expression in prepubertal pig ovaries: the role of leptin in steroid secretion and cell apoptosis[J]. Acta Vet Hung, 54(3):413-426.
[35]Williams NI, Helmreich DL, Parfitt DB, et al. (2001). Evidence for a Causal Role of Low Energy Availability in the Induction of Menstrual Cycle Disturbances during Strenuous Exercise Training[J]. J Clin Endocrinol Metab, 86(11):5184-5193.
[36]Tropea A, Tiberi F, Minici F, et al. (2007). Ghrelin affects the release of luteolytic and luteotropic factors in human luteal cells[J]. J. Clin Endocrinol. Metab, 92:3239-3245.
[37]刘晓丽.补充两种糖对大鼠运动性动情周期抑制的缓解和改善[D]. 上海:上海体育学院,2012.
[38]DIPIETRO L, STACHENFELD NS. (1997). The female athlete triad[J]. Med Sci Sports Exerc, 12: 1669-1671.
[39]Williams NI, Caston-Balderrama A, Helmreich DL. (2001a).Longitudinal changes in reproductive hormones and menstrual cyclicity in cynomolgus monkeys during strenuous exercise training, abrupt transition to exercise induced amenorrhea[J].Endocrinology, 142: 2381-2389.
[40]王人卫,黄雅君.运动性月经失调研究进展[J].中国运动医学杂志,2008,27(5):661-666.
[41]Loucks AB, Heath EM. (1994). Induction of low-T3 syndrome inexercising women occurs at a threshold of energy availability.Am J Physiol Regul Integr Comp Physiol, 266:R817-R823.
[42]Loucks AB. (2003). Introduction to menstrual disturbances in athletes. Med Sci Sports Exerc, 35 (9): 1551 -1552.
[43]Loucks AB. (2003). Energy availability, not body fatness, regulates reproductive function in women. Exerc Sport Sci Rev, 31:144-148.
[44]Loucks AB, Stanchenfeld NS. (2006). The female athlete triad:do female athletes need to take special care to avoid low energy availability. Med Sci Sports Exerc, 38 (6):1694-1700.
[45]Loucks AB. (2006). The response of luteinizing hormone pulsatility to 5 days of low energy availability disappears by 14 years of gynecological age. J Clin Endocrinol Metab, 91(8):3158-3164.
[46]Ziomkiewicz A, Ellison PT, Lipson SF. (2008). Body fat, energy balance and estradiol levels: a study based on hormonal profiles from complete menstrual cycles[J]. Human Reproduction Update, 23(11):2555-2563.
[47]Raymond C B, Peter JM, Kelly CA. (2008). Modeling circadian rhythms of food intake by means of parametric deconvolution:results from studies of the night eating syndrome[J]. Am J of Clinical Nutrition, 87(6):1672-1677.
[48]尚焦,王人卫.女运动员月经失调与可利用能量及骨密度之间关系的实验研究[M].上海体育学院硕士学位论文,2006,6:22-23.
[49]Otis CL, Drink BL, Johnson M. (2007). ACSM Position Stand on the female athlete triad[J]. Med Sci Sports Exerc, 29:i-ix.
[50]王杰龙,王人卫,方子龙等.女运动员黄体功能不全和无排卵发生率研究[J].中国运动医学杂志,2009,28(2):142-146.
[51]Souza MD, Toombs RJ, Scheid JL. (2010).High prevalence of subtle and severe menstrual disturbances in exercising women:confirmation using daily hormone measures[J]. Hum. Reprod,25:491 - 503.
[52]WILLIAMS N.I., J.L. REED, H.J. LEIDY. (2010). Estrogen and progesterone exposure is reduced in response to energy deficiency in women aged 25-40 years[J]. Hum. Reprod, 25(9): 2328-2339.
[53]Souza M J De, N I Williams, J L Vanheest. (2007). Correction of misinterpretations and misrepresentations of the female triad[J]. Br J Sports Med, 41: 58-59.
[54]S.E.Tonmen,A.T.H?stmark. (2006). Energy balance in weight stable athletes with and without Menstrual disorders[J]. Scand J Med Sci Sports, 16:127-133.
[55]WILLIAMS NI, HELMREICH DL, PARfiTT DB. (2001b).Evidence for a casual role of low energy availability in the induction of menstrual cycle disturbances during strenuous exercise training[J]. J Clin Endocrinol Metab, 86: 5184-5193.
[56]李擎,王人卫,金晶等.高能量饮食对运动性动情周期抑制大鼠血清FSH、LH和下丘脑NPYmRNA水平的影响[J].中国运动医学杂志,2009,28(4):407-410.
[57]Laughlin GA, Yen SSC. (1996). Nutritional and endocrine-metabolic aberrations in amenorrheic athletes[J]. J Clin Endocrinol Metab, 81:4301-4309.
