若干生物医用材料的设计、制备及性能研究
2012-08-29张其清刘玲蓉李学敏袁平中国医学科学院生物医学工程研究所天津市生物医学材料重点实验室天津300192
张其清 刘玲蓉 李学敏 袁平 关 (中国医学科学院生物医学工程研究所天津市生物医学材料重点实验室 天津300192)
1 概述
围绕国家重大需求和临床急需解决的组织病缺损再生修复、恶性肿瘤高效低毒治疗和临床医学弱信号采集难等重大科学问题,将生物医用材料研究与物理学、化学和生物学等相互交叉结合组织研究。设计构建了系列生物医用材料,研究了材料组成和结构与生物学性能、效应等的相关性,在引导组织再生(GTR)材料和组织工程支架材料、控缓释靶向药物载体和纳米生物器件等交叉领域做出了系统性、创造性的贡献。
2 研究成果
2.1 阐明了胶原基生物医用材料在机体内引导组织再生的作用机制
引导组织再生是指依靠机械屏障等作用,选择性地引导细胞向受损的部位附着、增生,达到组织修复的目的。早期使用的聚四氟乙烯膜是一种不能降解的材料,不能被组织吸收,增加了患者第二次创伤的机会;天然的胶原材料拥有天然细胞外基质的化学组成和结构特性,具有良好生物相容性和降解性,是研究和应用最广泛的生物医用材料之一。本项目以天然胶原为主要成分,模拟天然细胞外基质成分,引入天然多糖壳聚糖(Chi)、透明质酸(HyA)和硫酸软骨素(CS)及羟基磷灰石(HA)等,设计制备了用于组织病缺损修复的GTR胶原膜材料,通过对材料组成、结构与生物学性能、效应等的相关性进行深入研究,阐明了材料降解速度与组织再生速度相匹配和选择性引导受损部位组织再生的作用机制,为新型功能性GTR材料的研究和应用奠定了基础和科学依据。[1-5]
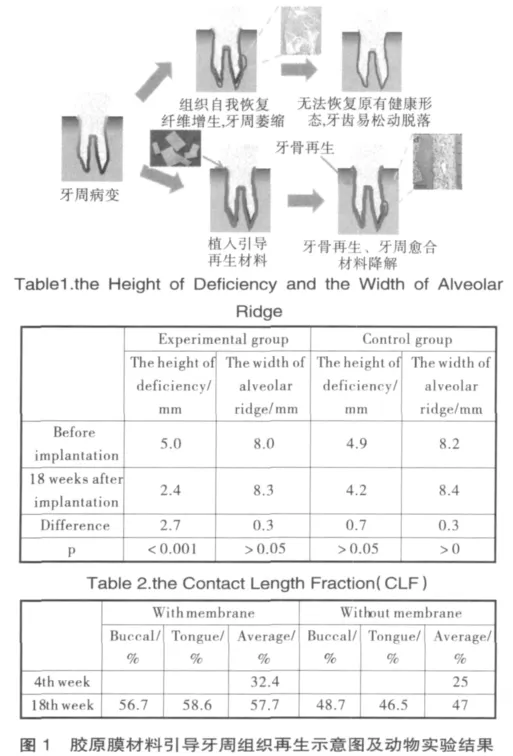
20世纪90年代初,我们与国外同期在国内率先开展了GTR材料的研究,采用酶消化法从哺乳动物结缔组织中提取可生物降解胶原并以其为基本原料,通过涂覆、喷涂或冻干方法成型,经化学交联改性得到膜状材料。研究发现,通过控制交联方法(甲醛交联、戊二醛交联)、交联条件(交联剂浓度、pH值及交联时间)以及与其他生物材料(天然多糖、PVA等)复合可调控胶原膜材料的降解性能、力学性能和表面性能,从而改善材料的生物学性能,这为更合理研制组成、结构与性能可调控,更适合临床应用的GTR材料奠定了基础。[1,5]本项目在制作小型猪及狗的口腔内局限型牙周病缺损模型的基础上,阐明了胶原膜引导牙周组织再生作用的效应及机制,并通过口腔种植颊侧造成裂隙状骨缺损模型研究胶原膜在种植体周围引导骨再生的效应及其作用机制(见图1)。[3]上述研究发现为临床上丧失功能的牙周组织重建以及骨缺损再生问题提供新的方法和依据。
利用本项目发现研发的BME-10X医用引导组织再生胶原膜已获国家药监局批号(国食药监械(准)字2005第3640508号)并推向市场,结束了我国该类产品只能依靠进口的历史。该产品在我国再生医学和骨科、口腔科、整形外科等领域进行临床应用,且取得了显著的临床效果。
2.2 发现了胶原基组织工程支架材料组成和结构与生物学性能的相关性
本项目模拟天然细胞外基质将软骨细胞外基质的主要成分CS、HyA及其结构类似物Chi引入胶原支架制备仿生复合的多孔软骨组织工程支架材料;[2]在分析天然骨组织力学、生物学特点的基础上,将胶原与HA、粘多糖-CS、细胞生长因子-骨形态发生蛋白(BMP)复合制备胶原基骨组织工程支架材料;[4,7]采用Chi和PVA对胶原材料进行改性,在碳化二亚氨的活化作用下将粘多糖物质CS与胶原基材料结合制备了组织工程真皮支架材料(见图2)。[6,8-9]研究发现了胶原基支架材料组成和结构与生物学性能的相关性,研究了材料降解时限与细胞生长速度相匹配等关键科学问题,阐明了不同支架材料、不同培养条件等对构建组织工程化人工器官的影响,提出了制备组成和结构及理化性能均接近正常软骨、骨和真皮的新方法,为胶原基支架材料作为组织工程化人工软骨、骨、皮肤的研究和临床应用提供了实验数据和科学依据。

2.3 发现了生物医用材料作为药物载体实现高效低毒肿瘤治疗的作用机制
目前,化疗是癌症治疗的主要手段之一,但抗肿瘤药物的选择性低,不良反应严重,甚至不得不中断化疗而延误治疗时机。因此,寻找高效低毒的肿瘤治疗新策略是临床迫切需要解决的问题。本项目以天然胶原、天然多糖、聚乳酸(PLA)、聚乳酸-聚乙醇酸共聚物(PLGA)等作为抗肿瘤药物载体,解决了控缓释靶向药物载体制备的关键科学、技术问题,揭示了药物控缓释载体在细胞和组织内分布的调控机制及其增强药效的作用机制,为实现高效低毒肿瘤治疗提供了方法学和理论上的依据及支持。[10-17]
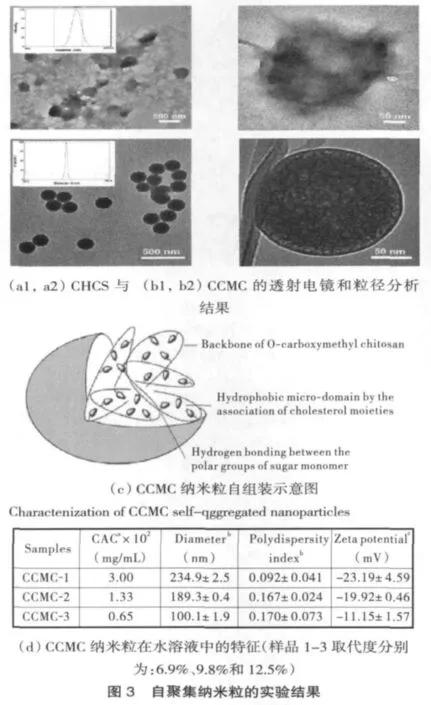
本项目利用胆甾醇、脱氧胆酸、聚乙二醇等物质为改性基团,对具有良好生物相容性和生物可降解性的Chi、普鲁兰、可德兰等天然多糖进行双亲性分子设计和改性,并制备了其自聚集纳米粒,探讨了疏水改性多糖及PLA纳米粒的自组装机理。研究发现,改性多糖纳米载体材料的化学结构、组成、疏水基团取代度、性质等的改变可控制纳米载体的结构、粒径大小及分布、CMC、电荷、形态和稳定性等理化性能(见图 3);[10-12,14]通过改变制备条件可调控PLA纳米粒的粒径大小及分布。[15]以表阿霉素为模型药物,考察了改性多糖与PLA载药纳米粒载药、释药特性的影响因素。研究发现,通过改变药载比、初始溶剂、透析速度和相对分子量等可调控载药纳米粒的载药特性;载药纳米粒的载药量、粒径、取代度及释放介质的pH值等是调控载药纳米粒释药速度的主要因素。[10-11,13-14]采用胶原为载体,结合负载长春新碱(VCR)的PLGA微球制备了定向控制释放抗肿瘤药物系统,通过改变药膜的组成和结构可调控载体的降解速度和药物的释放速度,从而达到缓释和恒定释放的效果。[16]
本项目还以表阿霉素、紫杉醇为模型药物,进一步开展了纳米药物载体的体内外生物学评价,研究其增强药效的机制。分析研究结果发现,靶向性药物载体在细胞和组织内分布的调控机制是:①组织导向,通过控制载药纳米粒的尺寸、电荷等实现其对肿瘤部位的被动靶向,同时,可采用叶酸、生物素等导向性分子修饰纳米粒,实现纳米粒的主动靶向作用;②组织渗透;③细胞摄取,载药纳米粒主要经过受体介导的内吞作用进入胞浆或溶酶体再释放药物,最终以游离药物的形式进入靶细胞器。载体的靶向性是减小全身毒性反应,增强局部药物效应,实现肿瘤治疗高效低毒的主要因素(见图4)。[13]

2.4 发现了生物医用材料构建的纳米生物器件提高医学弱信号采集的新方法
围绕疾病早期诊断中临床医学弱信号采集难的问题,构建了纳米金阵列和改性电极,发现了通过纳米金阵列和氨基修饰碳纳米材料等改性电极提高多巴胺等检测灵敏度的新方法,拓展了生物医用材料在纳米生物器件研究中的应用新领域。
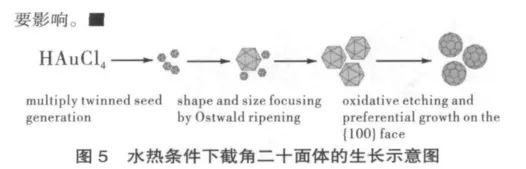
本项目首次成功合成了金纳米截角二十面体,揭示了合成不同尺寸、形貌金纳米粒的调控因素及其生长机理,为可控合成不同形貌的纳米材料提供了一种全新有效的方法(见图5)。[18]采用溶剂热法合成了表面氨基修饰的碳纳米材料(核-壳结构碳纳米颗粒、实心/空心碳微米管和空心碳球),研究发现,空心碳微管修饰的金电极在高浓度的抗坏血酸中可选择性检测多巴胺,而碳纳米管的空腔结构是造成研究底物氧化-还原行为发生变化的原因。[19]利用纳米金簇对掺硼金刚石电极改性发现,改性后的电极检测灵敏度可提高至纳摩尔级别,克服了传统掺硼金刚石电极无法分辨多巴胺与抗坏血酸氧化特性的缺点,提出了通过纳米金阵列采集海马神经动作电位的新方法。[20]
上述本项目研究成果为新型胶原基功能性GTR材料和组织工程支架材料的基础研究及临床应用、实现高效低毒肿瘤治疗及合理设计、制造纳米生物器件提供了科学依据,对于推动相关学科的发展意义重大,对于经济建设和社会发展产生了重
[1]Q iqing Zhang,Ling-rong Liu,LeiRen,etal.Preparation and characterization ofcollagen-chitosan composites[J].Journalof A pplied Polymer Sciences,1997(64):2127-2130.
[2]Jihong Y an,X uemin Li,Lingrong Liu,etal.PotentialU se of Collagen-Chitosan-H yaluronan tri-copolymer scaffold for Cartilage Tissue Engineering[J].A rtificial Cell,Blood Substitutes and Immobilization Biotechnology,2006,34(1):27-39.
[3]Q iqingZhang,K angde Y ao,Lingrong Liu,etal.Evaluation of porous collagen membrane in guided tissue regeneration[J].A rtificial Cell,Blood Substitutes and Immobilization Biotechnology,1999,27(3):245-253.
[4]Q i-qing Zhang,Lei Ren,Chun W ang,etal.Porous hydroxypatite reinforced w ith collagen protein[J].A rtificialCellBlood Substitutes and Immobilization Biotechnology,1996,24(6):693-702.
[5]Q iqing Zhang,Lei Ren,Chun W ang,etal.Structure investigation of polyvinyl alcohol-collagen composite[J].Journal M aterials Science&Technology,1997(13):179-183.
[6]H ongyi Y ang,Q iqing Zhang.Preparation and characterization of collagenG A G s bioactive matrices for tissue engineering[J].Journal of M aterials Science&Technology,2001,17(5):495.
[7]Lingrong Liu,LihaiZhang,BaizhiRen,etal.Preparation and characterization of collagen-hydroxyapatite composite used forbone tissue engineering scaffold[J].A rtificial Cell, Blood Substitutes and Immobilization Biotechnology,2003,31(4):435-448.
[8]Zhang lihai,M a dongrui,Zhang qiqing.The modification of scaffold material in building artificial dermis[J].A rtificialCell,Blood Substitutesand Immobilization Biotechnology,2002,30(4):319-332.
[9]M G uan,L Ren,LP Sun,etal.Potential w ound dressing w ith improved antimicrobial property[J].J A ppl Poly Sci,2007(105):1679-1686.
[10]W ang Y S,Liu L R,Jiang Q,etal.Self-aggregated nanoparticles of cholesterol-modified chitosan conjugate as a novelcarrier of epirubicin[J].Eur.Polym.J.,2007(43):43-51.
[11]X indu Y ang,Q iqing Zhang,Y insong W ang,etal.Self-aggregated nanoparticles from methoxy poly(ethylene glycol)-modified chitosan: Synthesis characterization; aggregation and methotrexate release in vitro [J]. Colloids and Surfaces B:Biointerfaces,2008(61):125-131.
[12]W ang Y S, Liu L R, W eng J,etal.Preparation and characterization of self-aggregated nanoparticles of cholesterol-modified O-carboxylmethyl chitosan conjugates[J].Carbohydr.Polym.,2007(69):597-606.
[13]Y in-song W ang,Q ian Jiang,Rong-shan Li,etal.Self-assembled nanoparticles of cholesterol-modified O-carbosymethyl chitosan as a novel carrier for pacliaxel[J].N anotechnology,2008(19):101-145.
[14]Fu-Ping G ao,H ui-Zhu Zhang,Ling-Rong Liu,etal.Preparation and physicochemical characteristics of self-assembled nanoparticles of deoxycholic acid modified-carboxymethyl curdlan conjugates [J].Carbohydrate Polymer,2008,71(1):606-613.
[15]M in Liu,Zhimin Zhou,X iaofeng W ang,etal.Formation of poly(l,d-lactide) spheres w ith controlled size by direct dialysis[J].Polymer,2007(48):5767-5779.
[16]H ongli Chen,H an Chen,Lingrong Liu,etal.The study of improved controlled release of vincristine sulfate from collagen-chitosan complex film[J].A rtificial Cells,Blood Substitutes and Immobilization Biotechnology,2008(6):372-385.
[17]K angde Y ao,Tao Peng, Q iqing Zhang ,etal.pH—dependent hydrolysis and drug release of chitosan/polyetherinterpenetrating polymernetw ork hydrogel[J].Polymer international,1994(34):213-219.
[18]Jun X u,Siyue Li,Jian W eng,etal.H ydrothermal syntheses ofgold nanocrystals:from icosahedral to its truncated Form[J].A dvanced Functional M aterials,2008,18(2):277-284.
[19]X iaofeng W ang,X iaoqing Liu, Linfei Lai, etal.Syntheses,properties and electrochemical activity of carbon microtubesmodified w ith amino groups[J].A dvanced Functional M aterials,2008(18):1809-1823.
[20]Jian W eng,Junmin X ue,John W ang,etal.G old cluster sensors formed electrochemically at boron-doped diamond electrodes:detection ofdopamine in the presence of ascorbic acid and thiols[J].A dvanced Functional M aterials,2005,15(4):639-647.
