生理体液法分析肝硬化及肝癌患者的血清氨基酸变化
2012-08-20马亚楠刘树业
马亚楠,刘树业
(1.天津医科大学,天津 300070;2.天津市第三中心医院 天津市人工细胞重点实验室,天津 300170)
生理体液法分析肝硬化及肝癌患者的血清氨基酸变化
马亚楠1,刘树业2*
(1.天津医科大学,天津 300070;2.天津市第三中心医院 天津市人工细胞重点实验室,天津 300170)
*通讯作者,liushuye@tijmu.edu.cn
氨基酸代谢与人的健康和疾病状态有直接关系,早在70、80年代,就有学者把血、尿样本中氨基酸的变化应用于临床疾病研究。如 McGregor[1]等在膀胱癌患者中检测尿液氨基酸,与正常人对比,探讨了其诊断价值。肝脏是机体物质代谢的中枢器官,许多物质合成、分解和转化等代谢过程在肝脏中进行。基于此,我们分析了肝硬化及肝癌患者血清中氨基酸的变化,探讨肝硬化及肝癌患者的氨基酸代谢模式。
1 材料与方法
1.1 病例来源肝硬化与肝癌患者均为2010年9月至2011年3月期间在天津市第三中心医院住院病人。年龄63.5±11.7岁,其中男33例,女17例,剔除合并影响氨基酸代谢的疾病和已使用氨基酸药物的病人,所有病例均为临床确诊病例。对照组40例来自体检中心且各项检查合格的健康人,平均年龄36.6±10.3岁。
1.2 主要试剂及仪器磺基水杨酸、茚三酮反应液购自天津市光复精细化工研究所;无水乙醇购自国药集团化学试剂有限公司;L-8900-PF-Kit缓冲液购自日本和光纯药工业公司;标准鸟氨酸、色氨酸及牛磺酸为美国sigma公司产品;血清氨基酸谱检测采用L-8900型日立高速全自动氨基酸分析仪(日本产)。
1.3 样本采集与处理入院次日晨空腹用分离胶促凝管采集3ml静脉血,3 000转/min离心10 min,取上清液,然后15 000转/min离心10min,吸取300μl血清加8%磺基水杨酸600μl混匀,15 000转/min离心30min,取上清液分装-80℃保存待用。
1.4 氨基酸的定量分析
1.4.1 色谱条件 填充柱4.6mm×60mm(填料为3μm磺酸型阳离子树脂分离柱)(P/N855-3507)一套,氨基酸混合溶液AN(P/N G370380),氨基酸混合溶液B(P/N G370381)。一个样本的进样量为20μl,分析周期为150min。柱平衡时间为35min,检测波长570nm,其中脯氨酸为440nm。
1.4.2 参数设置参考说明书。
1.4.3 标准曲线的制备 从氨基酸混合物标准溶液AN和B(日本和光纯药工业公司生产,含量均为5ml)中分别提取2ml样品,以0.02N-盐酸稀释成50ml的溶液。以该溶液作为生理性体液分析方法的标准样品。
1.4.4 氨基酸含量的检测 采用离子交换柱分析法,将所得上清液解冻后用0.45μm的过滤膜过滤后,放入样品瓶中再放到样品架上。然后按照氨基酸分析仪的使用说明开始操作。
1.5 统计学处理所有数据均以±s表示,应用SPSS17.0统计软件分析,组与组之间数据采用t检验。水准以α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 血清氨基酸定量分析
与对照组比较,肝硬化组患者血清Tau、Asp、Cysthi、Ile、Arg浓度及支芳比值下降;β-Ala、β-Aiba、GABA、α-AAA、Met、Tyr、Phe浓度升高,差异有统计学意义(P<0.05),其余氨基酸浓度与对照组相比,差别没有统计学意义。肝癌组患者Asp、Cysthi、Ile、Leu、Lys、Arg浓度及支芳比值下降;Met、β-Ala、β-Aiba、GABA、α-AAA、3Mehis、Tyr、Phe浓度升高,差异有统计学意义(P<0.05),其余氨基酸浓度与对照组相比,差别没有统计学意义。与肝硬化组比较,肝癌组血清Val、Lys、Arg浓度下降,Tau、3Mehis浓度升高,差异有统计学意义(P<0.05)(见表1)。
2.2 氨基酸分析图谱肝硬化和肝癌患者的氨基酸分析图谱分别见图1、2。
图1可见Tau、Asp、Cysthi、Ile、Arg浓度及支芳比值下降;β-Ala、β-Aiba、GABA、α-AAA、Met、Tyr、Phe浓度升高。
表1 各组间血清氨基酸比较结果(μmol/L,±s)

表1 各组间血清氨基酸比较结果(μmol/L,±s)
★ 肝硬化组VS,对照组,肝癌组VS对照组,P<0.05;# 肝硬化组VS肝癌组,P<0.05
氨基酸 对照组 肝硬化组 肝癌组Tau 120.6±63.9 47.7±25.6★ 91.0±23.0#Asp 30.9±5.1 7.4±3.2★ 10.2±3.2★Thr 142.5±23.9 132.7±45.6 132.8±13.9 Glu 125.2±36.7 112.0±53.4 146.8±38.3α-AAA 6.0±1.4 9.2±3.9★ 10.2±4.4★Ala 411.1±36.7 406.6±71.0 409.9±87.1 Val 283.8±40.9 316.9±30.5 250.5±59.7#Met 24.1±5.1 42.4±12.3★ 40.5±6.8★Cysthi 6.9±2.4 3.5±1.9★ 4.7±1.8★Ile 82.8±33.6 54.8±19.2★ 56.1±12.7★Leu 175.3±77.6 133.3±58.8 104.2±21.2★Tyr 80.2±10.4 115.9±13.0★ 102.4±29.8★Phe 117.5±20.1 151.5±17.4★ 154.7±10.5★β-Ala 3.2±1.3 16.6±8.1★ 18.5±9.2★β-Aiba 5.6±2.5 30.3±14.8★ 34.6±15.2★GABA 8.7±3.3 12.3±3.6★ 13.5±5.1★Lys 144.7±23.2 132.6±18.8 112.3±19.3★#1Mehis 12.6±2.0 16.6±1.3 15.2±1.1 3Mehis 6.7±2.3 9.1±4.3 18.3±2.6★#Arg 86.4±10.3 53.9±4.7★ 34.6±6.1★#BCAA/AAA 3.1±0.4 1.6±0.5★ 2.4±0.9★
由图2可见 Asp、Cysthi、Ile、Leu、Lys、Arg浓度及支芳比值下降;Met、β-Ala、β-Aiba、GABA、α-AAA、3Mehis、Tyr、Phe浓度升高。
3 讨论
氨基酸是生命活动中的一类重要物质,是构成蛋白质的基本单位。它在体内通过一系列的生化途径转化为糖和脂类,并合成具有多种生物活性的重要物质,如激素、酶、核酸、多胺及神经递质等。正常人体内游离氨基酸水平是相对恒定的,体内不能合成必需氨基酸,靠饮食摄入,而非必需氨基酸受体内代谢合成、释放、利用等因素的影响,氨基酸的失衡会导致机体各种生理病理学改变。

图1 肝硬化患者血清氨基酸图谱
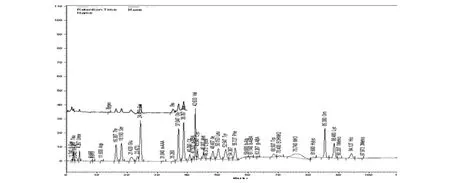
图2 肝癌患者血清氨基酸图谱
肝脏是蛋氨酸和芳香族氨基酸的主要代谢部位,其血浆浓度依赖于肝脏对它们的处理能力,肝功能不全时,这些氨基酸代谢受阻;肝病患者通常处于高代谢状态和负氮平衡[2],患者分解代谢增加,进入血液的内源性氨基酸是正常饮食时外源性氨基酸的5倍,氨基酸的浓度升高与内源性蛋白质分解增加成正相关。而肝脏处理支链氨基酸的能力严格受限,外周组织特别是肾脏、骨骼肌对支链氨基酸具有巨大的转氨基和氧化作用,其血浆浓度主要被外周组织代谢所控制。肝功能不全时,胰岛素在肝内灭活下降,产生高胰岛素血症,胰岛素促使骨骼肌及脂肪组织对支链氨基酸的摄取,又由于血中氨基酸浓度的升高,可以兴奋胰岛α细胞,使血中胰高血糖素升高,二者共同作用,使支链氨基酸,如亮氨酸、异亮氨酸显著降低。另外,慢性肝脏疾病中营养不良非常常见,肝病患者常因食欲不振、饮食习惯不良或其它合并疾病而经常处于“饥饿”状态,长期饥饿使BCAA氧化功能增加,血浆BCAA降低。这些原因造成了肝病时血清蛋氨酸及芳香族氨基酸、支链氨基酸浓度的差异。Hirayama等[3]研究结果提示:肝癌患者外周血中芳香族氨基酸及蛋氨酸较正常人明显增高,与肝硬化患者无明显差异,我们的研究与其相符。
肿瘤患者多数为高代谢状态,体内蛋白质合成及分解代谢均增高,产生的代谢产物及血液中各种物质成分也随之改变。而作为蛋白质合成的原料及分解代谢产物,氨基酸成分及浓度改变也往往反应了肿瘤患者的不同状态。癌肿快速生长和癌细胞无限制增殖需要大量的营养底物,特别是氨基酸会被大量摄取并消耗,这必然会引起癌组织氨基酸代谢库的改变[4]。癌肿对氨基酸的大量需求,近乎掠夺,国内外一些学者称癌肿为宿主的“氮陷井”[5]。恶性肿瘤细胞的过度增生引起体液中蛋白质、氨基酸等成分的改变[6],另外肿瘤的不同分期体内氨基酸水平也有不同[7]。测定其含量具有一定的临床意义,如血清丝氨酸、谷氨酞胺的升高可作为恶性骨肿瘤的诊断和预后的重要指标之一[8]。
国内外实验表明[9]癌肿氨基酸代谢有其特异性。在影响体内氨基酸代谢因素中,营养不良是主要原因,恶性肿瘤快速生长和肿瘤细胞无限制地增殖需要氨基酸作为合成自身蛋白质的底物,从而被大量消耗,导致宿主营养不良。其次,肿瘤的分期也可能影响体内氨基酸水平,Yamanaka等检测了63例术前胃癌患者血浆氨基酸水平,发现在Ⅰ-Ⅲ期患者中无明显差异,而Ⅳ期患者较早期患者则呈显著性下降[10]。肿瘤的类型也可能影响体内氨基酸水平,Norton等[11]发现在食道癌、骨肉瘤、淋巴瘤、软组织肉瘤以及转移性肿瘤血清氨基酸检测中发现了不一致。肝癌的分期不同,是否对氨基酸代谢不同,这有待于进一步的研究证实。
我们的研究发现与肝硬化组相比,肝癌组血清缬氨酸、赖氨酸及精氨酸浓度明显下降(P<0.05),牛磺酸及3-甲基组氨酸浓度升高,提示检测这几种氨基酸的血清浓度有助于了解肝硬化的病情发展。
[1]Hirs HW,Moore S,Stein WH.The chromatography of amino acid on ion exchange resins use of volatile acids for elution[J].Journal of American Chemical Society,1954,76(1):6063.
[2]Muller MJ,Bottcher J,Selberg O,et al.Hypermetabolism in clinically stable patients with liver cirrhosis[J].Am J Clin Nutr,1999,69(6):1194.
[3]Hirayama C,Suyama K,Horie Y,et al.Plasma amino acid patterns in hepatocellular carcinoma[J].Biochem Med Metab Biol,1987,38(2):127.
[4]周淑芬,刘树业,丁 贤.肝硬化与肝癌患者血浆氨基酸分析[J].临床肝胆病杂志,2009,25(3):220.
[5]Medina MA.Glutamine and cancer[J].Nutrition,2001,131(3):2539.
[6]Naini AB,Dickeron JW,Brown MM,et al.Preoperative and postoperative levels of plasma protein and amino acid in esophageal and lung cancer patients[J].Cancer,1988,62(2):355.
[7]李 娴,刘树业.肝细胞肝癌患者血浆氨基酸水平与Child-pugh分级的变化及分析[J].中国实验诊断学,2009,13(9):1172.
[8]Masiar PJ,Medekova E.The role of serine and glutamine in the metabolism of malignant bone tumors and their significance in the diagnosis and prognosis of bone tumors[J].Neoplasma,1988,35(2):197.
[9]Wang Qian.Tumor and amino acids of imbalanced solution[J].Digestive Surgery,2002,1(3):219.
[10]Yamanaka H,Kanemaki T,Tsuji M,e t al.Branched-chain amino acid-supplemented nutritional support after gastrectomy for gastric cancer with special reference to plasma amino acid profiles[J].Nutrition,1990,6(3):241.
[11]Norton JA,Gorschboth CM,Wesley RA,et al.Fasting plasma amino acid evels in cancer patients[J].Cancer,1985,56(5):1181.
1007-4287(2012)11-2088-03
2011-07-20)
