功能影像检测食管癌放疗过程中再增殖和乏氧以及预测临床疗效研究
2012-08-18于金明
于金明
(山东省肿瘤医院放射治疗科,济南 250117)
1 前言
食管癌是我国常见的恶性肿瘤,根据世界卫生组织的报告,全世界约50%的食管癌发生在中国,中国食管癌患者90%以上为鳞癌。食管癌在早期常无明显的症状,明确诊断时约3/4为不能手术的局部晚期患者。目前局部晚期食管鳞癌患者的治疗方案主要包括根治性同步放化疗和新辅助放化疗+手术。放射治疗肿瘤协作组(RTOG)8501临床试验奠定了以5-Fu+DDP为基础的同步放化疗方案,避免了手术的并发症,但有较高的肿瘤残留率和复发率。RTOG 94-05将放疗剂量由50.4 Gy提高至64.8 Gy,结果显示高剂量放疗方案无生存受益,局部失败率和残留率较RTOG 8501方案无明显提高(56%比52%)[1]。如何降低较高的局部失败率或残留率,从而提高食管癌患者远期疗效成为亟待解决的问题。
2 肿瘤加速再增殖是食管癌根治性同步放化疗后复发和转移的原因之一
肿瘤在放射治疗过程中,可启动肿瘤内存活的克隆源细胞,使之比照射前分裂得更快,称之为加速再增殖。加速再增殖是临床放射生物学的重要理论,与临床疗效密切相关,容易导致复发和转移,是放疗疗效不佳的根源之一。Yamada等[2]通过分析162例食管癌手术与术后放疗时间间隔对预后的影响,提出术后40天残留肿瘤细胞会出现加速再增殖,另外Kajanti等[3]研究发现缩短放疗疗程可以提高食管鳞癌患者的局部控制率,延长远期生存,其认为食管鳞癌放疗疗程延长会导致肿瘤加速再增殖。针对食管癌的加速再增殖,施学辉等[4]应用后程加速超分割的放疗方案,对85例食管鳞癌患者进行了随机分组的前瞻性临床研究,结果显示5年局部控制率提高了30%,5年生存率达33%。
通过活检病理来检测肿瘤增殖动力学指标是种创伤性的检查手段,容易导致并发症和活检误差。寻找一种体外无创伤性、简单、重复性好的反映肿瘤细胞增殖的检查手段成为研究的热点。如何通过一些非创伤性的检查手段检测食管癌放疗过程中的加速再增殖,从而通过积极的治疗手段如加速超分割放疗或给予加速再增殖区域高生物调强放疗,降低食管癌肿瘤残留率或复发率,提高远期生存率?
2.1 18F-FLT PET检测肿瘤加速再增殖的可行性
3-脱氧-3-F-氟代胸苷 (F-FLT)为一种反映肿瘤细胞增殖状态的PET示踪剂,18F-FLT作为一种胸腺嘧啶类似物,能够和胸腺嘧啶一样进入细胞内并掺入DNA,并在肿瘤增殖细胞中胸腺嘧啶核苷激酶I(TK-1)的作用下发生磷酸化生成18FFLT-磷酸盐,从而滞留在肿瘤细胞内,可通过PET显像进行观察。TK-1在细胞DNA合成期浓度会增加10倍,18F-FLT通过反映TK-1的活性而反映肿瘤细胞的增殖状况,是其作为PET细胞增殖示踪剂的基础[5]。研究表明,18F-FLT作为一种反映细胞增殖的正电子示踪剂,应用于PET显像可以无创、定量地在分子水平观察机体内肿瘤的增殖情况,FLT 的摄取与增殖参数 Ki-67 显著相关[6~9]。Vesselle等[10]利用荷纤维肉瘤的裸鼠模型证明18F-FLT的摄取与增殖细胞核抗原呈显著相关性(r=0.71,p ﹤ 0.05)。
岳金波等[11]前期对接受放疗的28例非手术局部晚期食管鳞癌患者进行一系列18F-FLT PET检查。每位患者治疗前进行18F-FLT PET扫描,然后在肿瘤放疗剂量达 2、6、10、20、30、40、46、50 Gy 或60 Gy时给予患者相应的1~3次18F-FLT PET检查。发现有2例患者在肿瘤剂量分别达2 Gy和46 Gy时表现食管肿瘤的18F-FLT摄取较前升高,这提示肿瘤的加速再增殖,见图1和图2。同步放化疗前,肿瘤 SUVmax=7.02,PV(增殖体积)=23.8 cm3,见图1(a)。2 Gy/1次后,SUVmax=8.22,PV=27.9 cm3,箭头示食道肿瘤,见图 1(b)。在2 Gy/1次后椎体摄取明显下降,而此时食管肿瘤增殖较治疗前升高。同步放化疗前,肿瘤SUVmax=5.7,PV=12.5 cm3,见图 2(a);DT 30 Gy/15 次,SUVmax=1.26,PV=0,见图 2(b);DT 40 Gy/20次,SUVmax=1.16,PV=0,见图2(c);DT 46 Gy/23 次,SUVmax=1.82,PV=0.57 cm3,箭头为再增殖区域,见图2(d)。在前期食管鳞癌同步放化疗过程中应用18F-FLT PET检测到肿瘤的加速再增殖的基础上,目前山东省肿瘤医院正在进行以病理为金标准,在动物和人体上进一步验证肿瘤的加速再增殖。

图1 同步放化疗过程中的加速再增殖Fig.1 Tumor repopulation in concurrent chemoradiation
2.2 验证18F-FLT PET能否检测肿瘤加速再增殖的方法
1)动物验证。目前肿瘤放疗过程中的加速再增殖的检测,是在动物试验中通过放疗过程中的时间-效应关系,分析不同放射治疗总疗程时间和50%肿瘤控制剂量(50% tumor control dose,TCD50)的差别来检测肿瘤放疗过程中的再增殖。Baumann等[12]以30次分割照射FaDu人咽鳞癌裸鼠移植瘤,其实验方法比较接近临床放疗中时间-分割的实际情况,总疗程从15 d延长至10周时,TCD50从43 Gy增加至102 Gy,疗程中肿瘤有效倍增时间短于治疗前倍增时间,提示放疗过程中存在肿瘤细胞加速再增殖。Petersen等[13]通过FaDu人咽鳞癌裸鼠移植瘤模型,给予裸鼠移植瘤3~18次照射,每日或隔日照射,发现放疗22 d后肿瘤出现明显的加速再增殖(见图3)。

图2 同步放化疗过程中的加速再增殖Fig.2 Tumor repopulation during concurrent chemoradiation

图3 FaDu人咽鳞癌裸鼠移植瘤模型放疗过程中的加速再增殖Fig.3 Tumor repopulation during radiotherapy in rats
Petersen等[14]的动物试验为18F-FLT PET能否检测肿瘤放疗过程中的加速再增殖提供了重要的研究基础,更重要的是Petersen等在随后研究中,应用免疫组化的方法进一步验证了放疗过程中的再增殖。其通过在放疗过程中出现加速再增殖前后的不同时间点,切除肿瘤,应用免疫组化检查分析增殖动力学参数 Ki-67、抗溴化脱氧尿嘧啶核苷(BrdUrd),结果发现Ki-67、BrdUrd标记指数在放疗开始时降低,然而在放疗后期又开始升高,这种现象与肿瘤放疗过程中的再增殖恰好吻合(见图4)。如果在Petersen等动物试验的基础上,于放疗过程中出现加速再增殖前后的不同时间点给予相应的18F-FLT PET检 查,分 析18F-FLT 摄 取 值(SUVmax、SUVmean、肺组织放射性计数比值)的变化与病理增殖指标(Ki-67、BrdUrd标记指数)变化的关系,将为验证18F-FLT PET能否检测肿瘤加速再增殖提供直接证据。
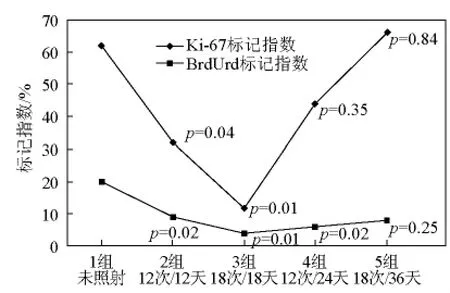
图4 组织病理证实FaDu人咽鳞癌裸鼠移植瘤放疗过程中的再增殖Fig.4 Tumor repopulation during radiotherapy in rats
2)食管癌患者验证。目前除山东省肿瘤医院报道的应用18F-FLT PET检测到2例食管癌同步放化疗中因放疗中断出现加速再增殖外[11],尚未有在人体放疗过程中发现加速再增殖的文献报道。前期研究[11]的28例非手术局部晚期食管鳞癌患者在接受放疗过程中,通过一系列18F-FLT PET检查,发现放疗未中断的患者,均无肿瘤加速再增殖出现,而2例患者皆因放疗中断(分别中断2 d和5 d)出现加速再增殖,尽管发现加速再增殖患者例数少,但至少表明放疗中断可能会导致肿瘤加速再增殖。目前的食管癌新辅助放化疗+手术治疗方案,通常在患者放化疗结束4~6周后给予手术[15],根据前期的临床观察,4~6周的放疗中断很可能导致部分患者出现肿瘤加速再增殖,这为18F-FLT PET能否检测食管癌患者肿瘤加速再增殖提供了人体模型。目前课题组正在进行该课题研究,即在新辅助放化疗前、后和手术前不同时间点给予相应的18F-FLT PET检查,分析18F-FLT 摄取值(SUVmax、SUVmean、PV)的变化与病理增殖指标(Ki-67、PCNA、BrdUrd标记指数)变化的关系,将为验证18F-FLT PET能否检测食管肿瘤的加速再增殖提供直接证据。
2.3 18F-FLT PET早期预测食管鳞癌新辅助放化疗疗效研究
美国国立综合癌症网络确定了新辅助同步放化疗对食管癌尤其是鳞癌患者有明显的生存获益,目前新辅助放化疗+手术为局部晚期食管癌的标准治疗方案之一。然而发表在临床肿瘤学杂志的一项研究表明:放化疗+手术治疗局部晚期食管鳞癌仅提高了肿瘤的局部控制时间,没有延长患者的生存时间,但新辅助放化疗后的临床有效是延长生存时间有利的预后因子[16]。法国FFCD 9102临床试验也表明对放化疗无效的局部晚期食管癌,尤其是鳞癌,放化疗后+手术并不比单纯放化疗更好[17]。临床资料已证实新辅助放化疗后病理达到缓解的食管癌患者具有较好的预后[18,19],根据新辅助放化疗后残留活性肿瘤细胞的数量,Becker等[20]建立了与生存期直接相关的食管癌患者评价食管癌患者新辅助放化疗疗效的金标准,其分级见表1。如何通过非创伤性的检测手段早期预测食管癌新辅助放化疗后病理是否达到缓解,及时调整治疗方案,避免患者接受不必要的治疗是需要解决的问题。

表1 根据残留肿瘤细胞数量所确定的组织病理反应分级[20] Table 1 Histomorphology and grading of regression [20]
2.4 18F-FLT PET早期预测食管鳞癌新辅助放化疗疗效的潜在优势
1)高度敏感地反应肿瘤增殖活性变化。传统的影像技术如CT、X线钡餐、腔内B超,不能敏感地反应食道肿瘤大小的变化,甚至于治疗后数周也不能发现肿瘤大小的明显改变,因而不适合早期预测食管癌放化疗疗效[21]。18F-FLT PET/CT能较早地估计食管肿瘤增殖变化[22],S Apisarnthanarax 等[23]通过研究接受多西他赛化疗联合放疗后食管癌细胞和动物模型研究,发现18F-FLT PET能先于肿瘤大小改变检测出肿瘤增殖变化;与FDG相比,在体外SEG-1细胞中FLT摄取值降低更快,幅度更大,动力学更接近胸腺嘧啶核苷代谢;在大鼠移植瘤SEG-1模型中,FLT摄取值在治疗后48 h就出现明显下降,FLT摄取与病理组织中Ki-67表达明显相关而且空间一致,这表明18F-FLT PET可能提供一种非创伤性体外早期预测食管癌新辅助放化疗疗效的手段,较18F-FDG PET更具有特异性。
岳金波等[24]对19例非手术局部晚期食管鳞癌患者在接受同步放化疗前10 Gy、20 Gy时分别行18F-FLT PET/CT扫描,发现当同步放化疗开始一周时,即食道肿瘤剂量达1Gy/5次后,所有患者照射野内骨髓显像完全消失,食道肿瘤SUVmax明显下降,早于CT下食道肿瘤直径的变化,见图5。如图5(a)可知同步放化疗前,SUVmax=16.7,PV=38.4 cm3,箭头示食道肿瘤 ;图 5(b)为 10 Gy/5 次,SUVmax=2.6,PV=1.3 cm3,箭头示食道肿瘤,PET最大密度投影图像中椎体显像完全消失,但仍可看出残留肿瘤摄取。
1例患者仅接受2 Gy的照射,照射野内椎体FLT摄取值就出现明显的下降,见图5。应用Logic回归分析表明PV差值变化百分比(△PV=[PV治疗前–PV放疗10 Gy或20 Gy] ×100%/PV治疗前)对临床有效有显著性意义(p=0.033,p=0.023);应用 ROC 曲线分析,增殖体积差值变化百分比-10 Gy和-20 Gy对于评价临床疗效具有显著性意义(p=0.001,p=0.005),这表明18F-FLT PET/CT能在治疗开始后一周预测食管癌同步放化疗的临床疗效,图6为应用ROC曲线分析放疗剂量达10 Gy(AUR=0.943,p=0.001)和 20 Gy(AUR=0.886,p=0.005)增殖体积差值变化(PV)百分比预测临床疗效的价值,放疗剂量达10 Gy时PV下降43%和放疗剂量达20 Gy时PV下降85%为预测食管癌同步放化疗临床疗效最佳阈值。

图5 同步放化疗过程中的肿瘤反应Fig.5 Tumor response during concurrent chemoradiation

图6 18F-FLT PET增殖体积对预测食管癌同步放化疗疗效的价值Fig.6 The value of proliferation volume in predicting response of concurrent chemoradiation
2)鉴别放化疗诱导的炎症与肿瘤残留。尽管18F-FDG PET能在肿瘤大小变化之前检测肿瘤细胞代谢的改变,并发现新辅助放化疗过程中18FFDG代谢变化与疗效相关,但是18F-FDG PET不能准确鉴别放化疗所引起的炎症和肿瘤残留,限制了其在判断疗效方面的应用[25,26]。食管癌在同步放化疗过程中,通常于20 Gy/10次以后,会出现放射性食道炎,而且同步化疗更会加重食道炎的症状。研究表明18F-FDG除了被肿瘤细胞摄取外,还大量聚集在巨噬细胞和肉芽组织中,急性或慢性炎症、脓肿、炎性淋巴结病变或非特异性放疗后反应都可能与肿瘤显像类似而导致假阳性率增高[27]。
动物试验已证明18F-FLT PET较18F-FDG PET具有较高的肿瘤特异性,能鉴别肿瘤与炎症[28~30],但尚未在人体上得以验证。山东省肿瘤医院前期通过2例非手术局部晚期食管鳞癌患者在接受同步放化疗后给予18F-FDG PET和18F-FLT PET检查,发现18F-FLT PET显示食管肿瘤增殖完全消失,而18F-FDG PET显像均示食管壁高代谢,食管镜活检病理提示均为炎症,图7(a)为同步放化疗后18F-FDG PET食管原发肿瘤部位高代谢,图7(b)为相应的18F-FLT PET原发肿瘤部位代谢完全消失,而且照射野椎体无代谢,图7(c)为同步放化疗后1个月原发肿瘤部位18F-FLT PET显像示无18F-FLT摄取,但照射野内椎体与同步放化疗刚结束相比已有18F-FLT摄取,表明脊髓已恢复再增殖,图7(d)为同步放化疗后18F-FDG PET/CT水平面(SUVmax=9.5),图7(e)为给予延迟扫描30 min后18F-FDG PET/CT水平面 (SUVmax=7.7),SUVmax较初次扫描下降,表明炎症可能性大,图7(f)为示食道镜活检病理示炎症浸润,间质水肿(放大倍数100×)。但鉴于病例数少,仍需进一步增加患者数量,研究18F-FLT PET是否较18F-FDG PET更好地鉴别食管癌放化疗所诱导的炎症和肿瘤残留。
3 乏氧是食管癌根治性同步放化疗后复发和转移的原因之一
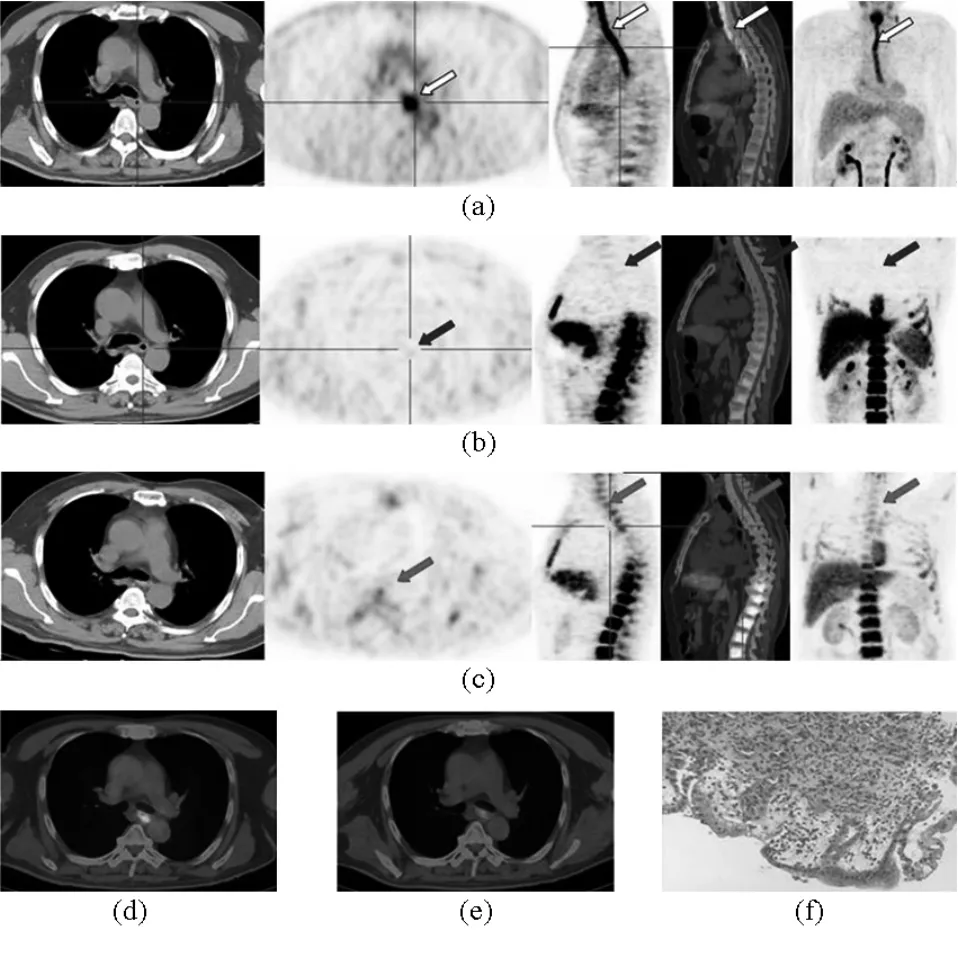
图7 与18F-FDG PET相比,18F-FLT PET可能更好地鉴别炎症和肿瘤残留Fig.7 Compared with18F -FDG PET,18F-FLT PET could distinguish inflammation and tumor residue
实体瘤生长的血管形成过程中,因不能满足生长中肿瘤的需要而导致有活力的肿瘤乏氧细胞存在。研究表明[31],直径<1 mm的肿瘤是充分氧合的,超过这个大小便会出现乏氧。放射治疗过程中大多数放射敏感的氧合好的细胞被杀死,剩下的乏氧活细胞重新变成氧合细胞的现象称之为再氧合。乏氧可诱导肿瘤细胞表型的变化如p53基因的突变以及Bcl-2的扩增等,从而导致其生物学特性的改变,放射敏感性降低[32]。临床常用的放射治疗射线(X线或γ线)为低LET射线,对这类射线,乏氧状态下要得到有氧时的同等生物效应,剂量就需要增加2.5~3倍。因而乏氧细胞常成为肿瘤难以治愈、容易复发的重要原因。Tanaka等[33]发现乏氧标记物碳酸酐酶-9(CA-9)与食管癌生物学行为差,预后不良密切相关。Sohda等[34]发现乏氧标志物HIF-α在食管癌中高表达预测放疗不敏感。Tzao等[35]通过分析85例食管鳞癌肿瘤的HIF-α表达与预后关系,结果表明HIF-α表达与食管肿瘤分期相关,HIF-α高表达是独立的不良预后因素,与食管癌肿瘤进展相关。
3.1 18F-FETNIM PET检测肿瘤乏氧的可行性
目前存在着多种直接或间接测定组织氧水平的方法,但由于创伤性或技术上的难度,很难在临床上广泛应用。因此,怎样才能及时、准确地反映乏氧状况成为近年来影像医学和肿瘤学研究的热点。利用放射性核素如18F、3H、123I、125I等标记的乏氧组织显影剂进行单光子断层扫描(single positron emission tomography,SPECT)或PET显像可以对乏氧进行定性和定量检测,具有无创性、定量性、可重复性等特点,是目前乏氧检测研究最为集中的技术[36]。乏氧组织显像剂能被结构完整具有代谢功能的细胞摄取,选择性地滞留在乏氧组织和细胞中,在细胞内的代谢水平取决于组织氧水平。PET乏氧显像最常用的是18F-氟硝基咪唑(fluoromisonidazole,FMISO),体外细胞培养和动物体内试验都表明,18F-MISO在细胞内的滞留程度取决于O2浓度。多项动物实验均证实FMISO在肿瘤组织中的吸收明显高于正常组织[37~39]。目前FMISO-PET为临床应用最为广泛的乏氧显像技术,但是由于FMISO脂溶性高,其乏氧检测有几个缺点:a.组织吸收率相对低,肿瘤吸收和正常组织吸收的对比值小;b.正常组织洗脱慢,因此需要较长的时间才能达到理想的本底;c.具有一定的神经毒性。近年来,为提高显像剂的水溶性,以提高显像效果并减少其毒性,研究人员从FMISO的衍生物中开发了一种新型乏氧显像氟赤硝基咪唑(18F-fluoroerythronitromidazole,FETNIM),生物分布研究显示其周围组织代谢率、脱氟率、水溶性和乏氧组织代谢率均适用于PET乏氧显像。2 h肿瘤/血液吸收比达1.80±0.64,头颈部肿瘤患者3 h肿瘤/肌肉吸收在1~4,优于FMISO。Lehtio等[40]利用FETNIM检测头颈部肿瘤患者乏氧状态,3 h的肿瘤/肌肉吸收比在1~4,优于FMISO,FETNIM是一种极具前途的乏氧显像剂。山东省肿瘤医院研究人员与北京师范大学化学系正电子药物中心合作,对其自主合成标记的新型乏氧显像剂FETNIM与传统的显像剂FIMSO作了对比研究,在SPC-A-1人肺腺癌细胞和BALB/c裸鼠SPC-A-1人肺腺癌移植瘤模型中证明了FETNIM的安全性和有效性,并应用于非小细胞肺癌放疗过程中的乏氧检测,表明18F-FETNIM检测的乏氧水平直接与预后相关[41]。
3.2 18F-FETNIM PET检测食管癌乏氧研究
岳金波等[42]通过28例非手术局部晚期食管鳞癌患者接受同步放化疗,应用18F-FETNIM PET检测食管鳞癌放疗过程中的乏氧情况,确定食管癌乏氧阈值,研究食管鳞癌放疗前乏氧的空间和时间变化,评价18F-FETNIM PET能否预测食管癌同步放化疗的临床疗效。其中10例患者同步放化疗前给予2次18F-FETNIM PET检查,其余18例患者则在同步放化疗前只给予1次18F-FETNIM PET检查。计算336个正常组织包括心脏、脑、肌肉的最大SUV(SUVmax)与相应患者脾的平均SUV(SUVmean)的比值,确定乏氧阈值。行2次18F-FETNIM PET扫描患者,对比2次乏氧区域位置和乏氧SUVmax空间和时间变化。通过Logistic回归分析确定18F-FETNIM PET能否预测食管鳞癌同步放化疗临床疗效。
3.2.118F-FETNIM PET确定食管癌乏氧阈值
28例食管鳞癌患者,分析了包括心脏、肺、脑和肌肉共336个SUVmax-正常组织(心脏、肺、脑、肌肉)/SUVmean-脾脏值。平均和中位SUVmax-正常组织/SUVmean-脾脏几乎相同,95%可信区间上限值低于1.3(见图8)。因此乏氧阈值定义为SUVmax-组织/SUVmean-脾脏≥1.3,肿瘤乏氧区域则为SUVmax-肿瘤≥1.3×SUVmean-脾脏。
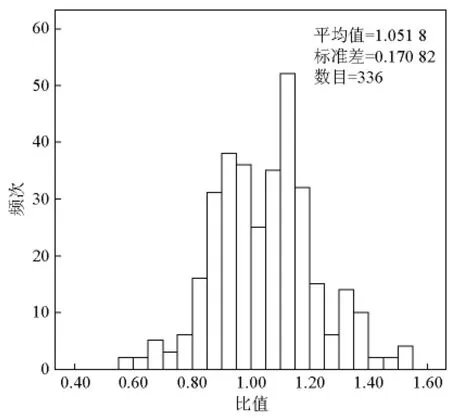
图8 18F-FETNIM PET上336个正常组织的SUVmax-正常组织/SUVmean-脾脏值Fig.8 SUVmax of tissue:SUVmean of spleen ratios from 336 normal tissue samples
3.2.218F-FETNIM PET确定食管癌乏氧空间和时间变化
共10例患者放疗前给予两次18F-FETNIM PET/CT扫描(见图9),两次PET上相同层面的乏氧区域图像的相似系数为 0.12(范围,0.05~0.21)。乏氧区域图像的几何中心平均变化为15 mm(范围,8~20 mm)。图10表明两次18F-FETNIM PET上食道肿瘤乏氧区域存在明显的空间位置变化。然而两次18F-FETNIM PET上食道肿瘤SUV-max和SUVmean值相近(见图10),配对T检验使无显著性差异(p=0.563,p=1)。从图10中可以看到两次PET上相同层面的乏氧区域图像的相似系数为0.16。乏氧区域图像的几何中心移动19 mm。
3.2.318F-FETNIM PET 判断治疗疗效价值
27/28 例患者达临床缓解(14例达CR,13例达PR,1例达SD),临床缓解率为96%。12/14达到CR患者治疗1年后复查仍示完全缓解,2/14达到CR患者分别在3个月和6个月复查仍示食道病变完全消失。14例达PR或SD患者中,有11例治疗后1年复查仍为PR,2例分别在治疗后6个月,1例在治疗后3个月复查,也仍然是PR。达到CR患者的 SUVmax和SUVmean分别为 3.2 和 2.1,达到 PR患者的SUVmax和SUVmean分别为5.9和3.2。应用Logistic回归分析治疗前食道肿瘤长度,最大肿瘤直径,SUVmax和SUVmean与临床完全缓解的关系,表明食道肿瘤SUVmax是预测食管癌同步放化疗后临床完全缓解的独立因素(p=0.0041)。然而因为病例数较少,无法通过ROC曲线确定预测食管癌同步放化疗后完全缓解的SUVmax阈值。
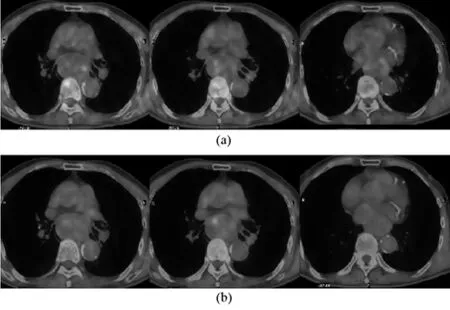
图9 同一患者治疗前隔日的两次18F-FETNIM PET/CT扫描Fig.9 Pretreatment18F - FETNIM PET/CT scans from a single patient on different days

图10 18F-FETNIM PET/CT扫描患者的食管肿瘤SUVmax and SUVmean变化Fig.10 SUVmax and SUVmean on different days before treatment for patients 1 through 10
3.2.418F-FETNIM PET的SUV参数与食管肿瘤参数关系
28例患者的食管肿瘤SUVmax和食管肿瘤长度(r=0.842,p<0.001)、食管最大直径(r=0.852,p<0.001)具有很好的相关性。食管肿瘤的SUVmean也发现与食管肿瘤长度(r=0.854,p<0.001)、食管最大直径(r=0.805,p<0.001)具有很好的相关性。图11表明食管肿瘤SUV参数与食管肿瘤参数之间的关系。图12显示 SUVmax和SUVmean随着肿瘤直径的增大而增大。从图12可看到三位原发食管鳞癌患者的病例,病例(a)中CT下肿瘤最大直径为 3.1 cm,SUVmax=2.9,SUVmean=2.1;病例(b)中CT下肿瘤最大直径为3.8 cm,SUVmax=3.3,SUVmean=2.8;病例(c)中,CT下肿瘤最大直径为5.8 cm,SUVmax=3.9,SUVmean=3.1。
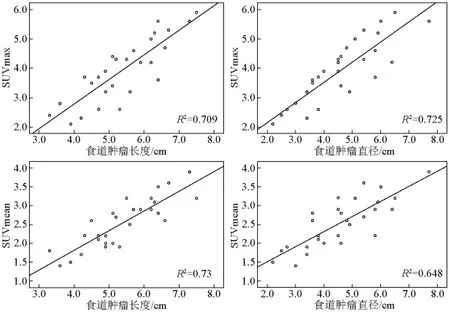
图11 食管SUVmax和SUVmean分别与食道肿瘤长度和食道肿瘤直径的关系Fig.11 Scatterplots demonstrating correlations between SUV and tumor dimensions

图12 SUVmax和SUVmean随着肿瘤直径的增大而增大Fig.12 SUVmax and SUVmean increase with tumor diameter
4 结语
18F-FLT PET能监测食管鳞癌放疗过程中肿瘤和正常组织的生物学变化,其较18F-FDG PET能更好区分炎症和肿瘤。放疗中断后肿瘤摄取高于基线值,而照射野内骨髓摄取下降。放疗中断后的18F-FLT摄取增高可能反映肿瘤加速再增殖。18FFETNIM PET能检测食管鳞癌的乏氧状态。18FFLT PET/CT能在治疗开始后一周预测食管癌同步放化疗的临床疗效,治疗前SUVmax能预测食管鳞癌同步放化疗疗效。18F-FLT PET和18F-FETNIM PET作为一种非创伤性的影像学技术,为肿瘤医生提供一个早期评价治疗反应,检测放疗过程中的再增殖克隆源细胞、乏氧和评价新辅助治疗疗效的手段。18F-FLT PET和18F-FETNIM PET能为放射治疗确定“再增殖”和“乏氧”生物学靶区,以通过剂量调强放疗提高再增殖和乏氧区域放疗剂量,提高肿瘤的局部控制率和远期生存。
[1] Minsky B D,Pajak T F,Ginsberg R J,et al.INT 0123(Radiation Therapy Oncology Group 94-05)phase III trial of combined-modality therapy for esophageal cancer:high-dose versus standard-dose radiation therapy[J] .J Clin Oncol,2002,20(5):1167-1174.
[2] Yamada S,Takai Y,Nemoto K,et al.Prognostic impact of the period between surgery and postoperative irradiation in esophageal carcinoma[J] .Tohoku J Exp Med,1994,172(3):275-282.
[3] Kajanti M,Kaleta R,Kankaanranta L,et al.Effect of overall treatment time on local control in radical radiotherapy for squamous cell carcinoma of esophagus[J] .Int J Radiat Oncol Biol Phys,1995,32(4):1017-1023.
[4] 施学辉,吴根娣,刘新伟,等.后程加速超分割放射治疗食管癌的长期疗效[J] .中华放射肿瘤学杂志,1997,1(6):12-5.
[5] Salskov A,Tammisetti V S,Grierson J,et al.FLT:measuring tumor cell proliferation in vivo with positron emission tomography and 7.3'-deoxy-3'-[18F] fluorothymidine[J] .Semin Nucl Med,2007,37(6):429-439.
[6] Yamamoto Y,Nishiyama Y,Ishikawa S,et al.Correlation of(18)FLT and(18)FDG uptake on PET with Ki-67 immunohistochemistry in non small lung cancer[J] .Eur J Nucl Med Mol Imag,2007,34(10):1610-1618.
[7] Yap C S,Czernin J,Fishbein M C,et al.Evaluation of thoracic tumours with18F-fluorothymidine and18F-fluorodeoxyglucosepositron emission tomography[J] .Chest,2006,129(2):393-401.
[8] Choi S J,Kim J S,Kim J H,et al.[18F] 3'-deoxy-3'-fluorothymidine PET for the diagnosis and grading of brain tumors[J] .Eur J Nucl Med Mol Imaging,2005,32(6):653-659.
[9] Chen W,Cloughesy T,Kamdar N,et al.Imaging proliferation in brain tumours with18F-FLT PET:comparison with 18F-FGD[J] .J Nucl Med,2005,46(6):945-952.
[10] Vesselle H,Grierson J,Muzi M,et al.In vivo validation of 30deoxy-30-[(18)F] fluorothymidine([(18)F] FLT)as a proliferation imaging tracer in humans:correlation of[(18)F] FLT uptake by positron emission tomography with Ki-67 immuno-histochemistry and flow cytometry in human lung tumours[J] .Clin Cancer Res,2002,8(11):3315-3323.
[11] Yue J,Chen L,Cabrera A R,et al.Measuring tumor cell proliferation with18F-FLT PET during radiotherapy of esophageal squamous cell carcinoma:a pilot clinical study[J] .J Nucl Med,2010,51(4):528-534.
[12] Baumann M,Liertz C,Baisch H,et al.Impact of overall treatment time of fractionated irradiation on local control of human FaDu squamous cell carcinoma in nude mice[J] .Radiother Oncol,1994,32(2):137-143.
[13] Petersen C,Zips D,Krause M,et al.Repopulation of FaDu human squamous cell carcinoma during fractionated radiotherapy correlates with reoxygenation[J] .Int J Radiat Oncol Biol Phys,2001,51(2):483-493.
[14] Petersen C,Eicheler W,Frömmel A,et al.Proliferation and micromilieu during fractionated irradiation of human FaDu squamous cell carcinoma in nude mice[J] .Int J Radiat Biol,2003,79(7):469-477.
[15] Ruol A,Rizzetto C,Castoro C,et al.Interval between neoadjuvant chemoradiotherapy and surgery for squamous cell carcinoma of the thoracic esophagus:does delayed surgery have an impact on outcome?[J] .Ann Surg,2010,252(5):788-796.
[16] Stahl M,Stuschke M,Lehmann N ,et al.Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus[J] .J Clin Oncol,2005,123(10):2310-2317.
[17] Bonnetain F,Bouché O,Michel P,et al.A comparative longitudinal quality of life study using the Spitzer quality of life index in a randomized multicenter phase III trial(FFCD 9102):chemoradiation followed by surgery compared with chemoradiation alone in locally advanced squamous resectable thoracic esophageal cancer[J] .Ann Oncol,2006,17(5):827-834.
[18] Swisher S G,Erasmus J,Maish M,et al.2-Fluoro-2-deoxy-D-glucose positron emission tomography imaging is predictive of pathologic response and survival after preoperative chemoradiation in patients with esophageal carcinoma[J] .Cancer,2004,101(8):1776-1785.
[19] Berger A C,Farma J,Scott W J,et al.Complete response to neoadjuvant chemoradiotherapy in esophageal carcinoma is associated with significantly improved survival[J] .J Clin Oncol,2005,23(19):4330-4337.
[20] Becker K,Mueller J D,Schulmacher C,et al.Histomorphology and grading of regression in gastric carcinoma treated with neoadjuvant chemotherapy[J] .Cancer,2003,98(7):1521-1530.
[21] Westerterp M,van Westreenen H L,Reitsma J B,et al.Esophageal cancer:CT,endoscopic US,and FDG PET for assessment of response to neoadjuvant therapy systematic review[J] .Radiology,2005,236(3):841-851.
[22] Kenny L,Coombes R C,Vigushin D M,et al.Imaging early changes in proliferation at 1 week post chemotherapy:a pilot study in breast cancer patients with 3'-deoxy-3'-[18F] fluorothymidine positron emission tomography[J] .Eur J Nucl Med Mol Imaging,2007,34(9):1339-1347.
[23] Apisarnthanarax S,Alauddin M M,Mourtada F,et al.Early detection of chemoradioresponse in esophageal carcinoma by by 3'-deoxy-3'-3H-fluorothymidine using preclinical tumor models[J] .Clin Cancer Res,2006,12(15):4590-4597.
[24] Yue J,Yu J,Cabrera A,et al.Measuring tumor cell proliferation and predicting clinical response with18F-FLT PET during radiotherapy of esophageal squamous cell carcinoma:a pilot clinical study[J] .Int J Radiat Oncol Biol Phys,2010,78(Suppl 1):S162.
[25] Arslan N,Miller T R,Dehdashti F,et al.Evaluation of Response to Neoadjuvant Therapy by Quantitative 2-Deoxy-2-[18F] Fluoro-D-Glucose with Positron Emission Tomography in Patients with Esophageal Cancer[J] .Mol Imaing Bio,2002,4(4):301-310.
[26] Nakamura R,Obara T,Katsuragawa S,et al.Failure in presumption of residual disease by quantification of FDG uptake in esophageal squamous cell carcinoma immediately after radiotherapy[J] .Radiat Med,2002,20(4):181-186.
[27] Van Westreenen H L,Heeren P A M,Jager P L,et al.Pitfalls of positive findings in staging esophageal cancer with F-18-fluorodeoxyglucose positron emission tomography[J] .Ann Surg Oncol,2003,10(9):1100-1105.
[28] Lee T S,Ahn S H,Moon B S.Comparison of18F-FDG,18FFET and18F-FLT for differentiation between tumor and inflammation in rats[J] .Nucl Med Biol,2009,36(6):681-686.
[29] van Waarde A,Jager P L,Ishiwata K,et al.Comparison of sigma-ligands and metabolic PET tracers for differentiating tumor from inflammation[J] .J Nucl Med,2006,47(1):150-154.
[30] van Waarde A,Cobben D C,Suurmeijer A J.Selectivity of18F-FLT and18F-FDG for differentiating tumor from inflammation in a rodent model.J Nucl Med,2004,45(4):695-700.
[31] Rasey J S,Grunbaum Z,Magee S,et al.Characterization of radiolabeled fluoromisonidazole as a probe for hypoxic cells[J] .Radiat Res,1987,111(2):292-304.
[32] Koumenis C,Alsrcon R,Hammond E,et al.Regulation of p53 by hypoxia dissociation of t ranscriptional repression and apoptosis from p532dependent t ransactivition [J] .Mol Cell Biol,2001,21(4):1297-1310.
[33] Tanaka N,Kato H,Inose T,et al.Expression of carbonic anhydrase 9,a potential intrinsic marker of hypoxia,is associated with poor prognosis in oesophageal squamous cell carcinoma[J] .Br J Cancer,2008,99(9):1468-1475.
[34] Sohda M,Ishikawa H,Masuda N,et al.Pretreatment evaluation of combined HIF-1alpha,p53 and p21 expression is a useful and sensitive indicator of response to radiation and chemotherapy in esophageal cancer[J] .Int J Cancer,2004,110(6):838-44.
[35] Tzao C,Lee S C,Tung H J,et al.Expression of hypoxiainducible factor(HIF)-1alpha and vascular endothelial growth factor(VEGF)-D as outcome predictors in resected esophageal squamous cell carcinoma[J] .Dis Markers,2008,25(3):141-148.
[36] Foo S S,Abbott D F,Lavrentschuk N,et al.Functional imaging of intratumoral hypoxia[J] .Mol Ima Bio,2004,6(5):291-305.
[37] Tochon-Danguy H J ,Sachinidis J I,Chan F,et al.Imaging and quantitation of the hypoxic cell fraction of viable tumor in an animal model of intracerebral high grade glioma using[18F] fluoromisonidazole(FMISO)[J] .Nucl Med Biol,2002,29(2):191-197.
[38] Rasey J S,Casciari J J,Hofstrand P D,et al.Determining hypoxic fraction in a rat glioma by uptake of radiolabeled fluoromisonidazole[J] .Radiat Res,2000,153(1):84-92.
[39] Rasey J S,Hofstrand P D,Chin L K,et al.Characterization of[18F] fluoroetanidazole,a new radiopharmaceutical for detecting tumor hypoxia[J] .J Nucl Med,1999,40(6):1072-1079.
[40] Lehtio K,Oikonen V,Gronroos T,et al.Imaging of blood flow and hypoxia in head and neck cancer:initial evaluation with[(15)O] H(2)O and [(18)F] fluoroerythronitroimidazole PET[J] .J Nucl Med,2001,42(11):1643-1652.
[41] Li L,Hu M,Zhu H,et al.Comparison of18F-Fluoroerythronitroimidazole and18F-fluorodeoxyglucose positron emission tomography and prognostic value in locally advanced non-small-cell lung cancer[J] .Clin Lung Cancer,2010,11(5):335-340.
[42] Yue J B,Yang Y,Cabrera A R,et al.Measuring tumor hypoxia with18F-FETNIM PET in esophageal squamous cell carcinoma:a pilot clinical study[J] .Dis Esophagus,2012,25(1):54-61.
