雷帕霉素对肾缺血再灌注大鼠肝脏功能和超微结构的保护作用
2012-08-17郑传东胡兴平
郑传东 苟 欣 张 力 胡兴平
1.成都市第五人民医院泌尿外科,四川成都 611130;2.重庆医科大学附属第一医院泌尿外科,重庆 400016
雷帕霉素(RPM)是放线菌培养液中分离出来的大环内酯类抗生素[1],近年证明它是一种强有力的免疫抑制剂,已广泛应用于肾移植中[2]。肾移植、肾部分切除、肾盂积水、肾切开取石手术等多见肾缺血再灌注损伤。肾缺血再灌注亦可损伤远隔脏器如心、肝、肺的功能[3-5];尤其对肝脏功能有明显的损害[6]。本试验建立大鼠肾损伤模型,观察肾损伤对大鼠肝脏功能和形态的影响,探讨雷帕霉素对肝脏功能和形态的影响及保护作用。
1 材料与方法
1.1 试验药物
雷帕霉素购自华北制药集团新药研究开发有限责任公司,批准文号2002HL0259,每毫升含RPM 1 mg。
1.2 实验动物及分组
24只Wistar雄性大鼠,购自重庆医科大学实验动物中心(合格证号:检动字2002A040)。随机分成假手术组(sham),手术组(IR),药物组(RPM+IR),每组 8只大鼠。
1.3 肾缺血再灌注模型的建立及处理
建立肾损伤模型[6]:给予10%水合氯醛(3 mL/kg)腹腔注射,皮肤消毒。腹部正切口,切除右肾,分离左肾动脉,无损伤动脉夹夹闭,肾脏血流阻断以肾脏颜色发白即可确认。假手术组只分离左肾动脉,不夹闭。假手术组、手术组以等量生理盐水代替药物,以做阴性对照,药物组于术前灌胃给药RPM[4 mg/(kg·d)×3 d,术前 2 h 灌胃 ]。缺血 2 h 后,松开动脉夹,肾脏血流恢复,肾脏由苍白变为红润可确认。各组再灌注4 h即为本试验的模型。
1.4 生化指标检测
从大鼠心脏取血3 mL,离心后予-20 ℃冻存,检测血清尿素氮(BUN)、肌酐(Scr)含量和谷草转氨酶(sAST)、谷丙转氨酶(sALT)活性。
1.5 肝、肾组织形态学观察
取肝、肾组织,于4%的多聚甲醛固定,用石蜡包埋,3μm厚切片,HE染色,光学显微镜观察。
1.6 统计学处理
2 结果
2.1 大鼠血清BUN、Scr含量、sALT、sAST活性的变化
表1显示,与假手术组比较,手术组血清BUN、Scr含量、sALT、sAST活性显著升高(P<0.05);与手术组比较,药物组血清BUN、Scr含量、sALT、sAST活性显著降低(P<0.05)。
2.2 肾组织HE染色结果
假手术组肾组织结构正常;手术组:部分近曲小管上皮细胞浊肿,肾皮质及髓质部充血,大量蛋白管型;药物组:病变较手术组明显减轻。
2.3 肝组织HE染色结果
假手术组正常;手术组:肝中央静脉淤血,中央静脉周围肝细胞有点状坏死,大量脂肪变性,炎症细胞侵润;药物组:病变较手术组明显减轻仅肝中央静脉扩张、淤血(见图1,2)。
表1 大鼠血清BUN、Scr含量、sALT、sAST活性的变化(n=8,± s,%)

表1 大鼠血清BUN、Scr含量、sALT、sAST活性的变化(n=8,± s,%)
注:与假手术组比较,*P<0.05;与手术组比较,#P<0.05
组别 尿素氮(mmol/L)肌酐(μmol/L)谷丙转氨酶(μmol/L)谷草转氨酶(μmol/L)假手术组 4 h 5.8±0.3 50.7±9.8 12.1±0.4 33.5±7.9手术组 4 h 17.7±1.3* 103.5±12.6* 40.2±3.7* 81.8±15.8*药物组 4 h 8.8±0.9# 71.6±10.2# 15.3±3.1# 41.3±8.6#
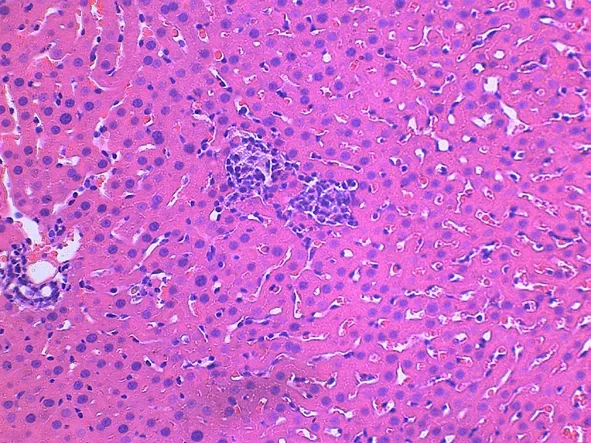
图1 手术组4 h的肝组织HE染色(HE×400)
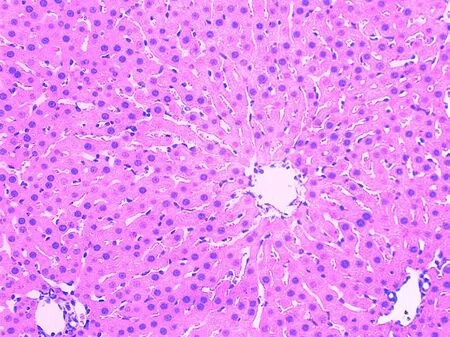
图2 药物组4 h的肾组织HE染色(HE×400)
3 讨论
有文献报道[3,7],家兔和大鼠肾缺血再灌注损伤可造成心肌细胞凋亡和心脏功能的改变。人体内最大的实质性脏器是肝脏,受双重血液供应的唯一器官,血流量大,血液循环中有害物质时极易被影响。肾缺血再灌注形成的血液中大量的毒性物质对肝脏有明显的损害。目前,临床对肾缺血再灌注损伤,主要是关注本身脏器的损伤,而忽略了对远隔关联脏器的损害。
本研究发现,与手术组比较,药物组血清BUN、Scr含量、sALT、sAST活性显著降低(P<0.01)。手术组:光镜下肝脏严重淤血,灶性坏死及大量细胞脂肪变性;电镜下细胞与细胞发生融合,细胞与细胞间连接消失,细胞膜结构消失,药物组损害轻微。雷帕霉素对肾缺血再灌注大鼠肝脏功能和形态均有明显的保护作用。
肾缺血再灌注致远隔脏器损伤与循环中细胞因子的增加有关[8],雷帕霉素对肾缺血再灌注导致大鼠肝脏损伤的保护作用机制未明。其可能作用机制是通过降低T细胞依赖性B细胞、T细胞本身及树突状细胞的活性,降低细胞因子的分泌,控制炎症,自由基的生成减少,而大大降低了血液中的毒性物质;控制内皮细胞和平滑肌细胞等血管相关细胞的增殖改善肾、肝的微循环;减少肾、肝细胞凋亡等多种途经来减轻肾、肝组织损伤的。其机制尚有待进一步研究。
[1]Sehgal SN,Baker H,Vezin A,et al.Rapamycin(AY-22,989),a new antifungal antibiotic.1I.Fermentation,isolation and characterization[J].J Antibiot,1975,28(10):727-732.
[2]Kuypers DR.Benefit-risk assessment of sirolimus in renal transplantation[J].Drug Saf,2005,28(2):153-181.
[3]Kelly KJ.Distant effects of experimental renal ischemia-reperfusion injury[J].J Am Soc Nephrol,2003,14(6):1549-1558.
[4]Kramer AA,Postler G,Salhab KF,et a1.Renal ischemia-reperfusion leads tomacrophage-mediated increase in pulmonary vascular permeability[J].Kidney Int, 1999,55(6):2362-2367.
[5]Mustafa S,Tulay K,Ahmet K,et a1.Changes in hepatic TNF-alevels,antioxidant status, and oxidation products after renal ischemia-reperfusion injury in mice[J].Surg Res,2002,107(2):234-240.
[6]汪保英,黎七雄.大鼠肾缺血再灌注损伤对肝脏功能和形态的影响[J].武汉大学学报,2006,27(2):188-191.
[7]潘景业,金可可,陈雷,等.急性肾缺血再灌注损伤对家兔心功能的影响[J].中华心血管病杂志,2004,32(1):74-75.
[8]Gurly BJ,Barone GW,Yamashita K.Extrahepatic ischemia-reperfusion injury reduces hepatic oxidative drug metabolism as determined by serial Antipyrine clearance[J].Pharma Res,1997,14(1):67-72.
