单个核细胞源性血管内皮生长因子在急性心肌梗死患者中的动态变化及意义
2012-08-17洪苍浩汤国法刘晓红
洪苍浩 汤国法 刘晓红
武钢集团鄂钢医院心内科,湖北鄂州 463002
血管内皮生长因子在缺血性心脏病发病机制中起着重要作用,动脉粥样硬化的形成,冠状动脉成形术后再狭窄都与生长因子参与的细胞增殖、迁移、分化与凋亡有密切关系。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种特异作用于血管内皮细胞(vascular endothelial cell,VEC)强有力的有丝分裂原,在缺血、缺氧及血管损伤时能促进VEC增殖、迁移及诱导血管生成,是迄今所发现最强的一种血管内皮生长因子。由于冠心病是以心肌缺血为主要特征,外源性VEGF已成为目前促血管生成、重建冠状动脉侧枝循环的研究热点。目前,在应用外源性VEGF基因转染治疗心肌缺血方面研究很多,而对不同来源的内源性VEGF在心肌缺血时所起的作用研究甚少。本研究通过观察AMI患者外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)分泌的VEGF水平的动态变化来探讨不同来源的内源性VEGF在AMI患者中的作用。
1 资料与方法
1.1 一般资料
患者为2010年1月~2011年6月笔者所在医院心血管内科住院确诊的急性心肌梗死患者28例,其中男20例,女8例,平均年龄(58.7±7.9)岁。12例正常体检者作对照,其中男9例,女3例,平均年龄(55.6±6.3)岁。28例AMI患者均进行了冠脉造影(coronary angiography,CAG),并实施经皮腔内冠状动脉球囊扩张和支架植入术(percutaneous transluminal coronary angioplasty and stent,PTCA+stent),所有患者均常规服用阿司匹林和氯吡格雷,并根据医生建议服用β-受体阻滞剂、血管紧张素转换酶抑制剂或血管紧张素Ⅱ受体拮抗剂等药。28例患者CAG检查结果:单支血管病变11例,2支血管病变9例,3支血管病变8例。合并高血压病的有15例(54%),高脂血症23例(82%),糖尿病7例(25%),18例患者有吸烟史(64%),8例有冠心病家族史(28%)。
1.2 急性心肌梗死的诊断
根据WHO标准持续典型的胸痛30 min以上;典型心电图动态变化;心肌酶(肌酸磷酸激酶及其同工酶MB或肌钙蛋白)动态变化。具有以上中任何2项即可确诊。
1.3 正常对照者入选条件
对照组与AMI组进行性别、年龄配对,经病史询问无心血管疾病史,体格检查无阳性体征,胸片、心电图、肝肾功能、生化常规检查无异常者。合并严重心衰、肝、肾功能衰竭、感染性疾病、肿瘤、外周血管病、脑卒中者予以剔除。
所有患者在发病2 d内进行床旁心脏彩色多普勒超声检测左室射血分数(left ventricular ejection fraction,LVEF),半月后(出院时)复查LVEF(由心脏彩超室专人质控检测)。
1.4 主要仪器和试剂
CO2培养箱:美国Formal Scientific公司;Lympus倒置显微镜:日本;酶联免疫检测仪:美国EL312eVEGF酶联免疫检测试剂盒:北京晶美生物工程有限公司(进口分装),检测灵敏度为30 pg/mL,批内、批间误差均<9.5%;淋巴细胞分离液:Ficoll-Hypaque液,中科院血液研究所;PBS液:新鲜配制;RPMI-1640:GIBCO,美国;小牛血清:笔者所在医院中心实验室制备;双抗:青霉素100 IU/mL,链霉素100μg/mL。
1.5 研究方法
1.5.1 外周血单个核细胞(PBMCs)的分离和培养及标本的提取
1.5.1.1 PBMCs的分离 (1)在AMI患者发病的第1、5、10、15天分别抽取20 mL静脉血放入肝素抗凝离心管内,摇匀,用PBS液稀释血液1倍,对照组仅抽1次静脉血。(2)取淋巴分离液4 mL,放入15 mL离心管中。(3)将稀释全血沿试管壁徐徐加入,使稀释血液重叠于淋巴分离液上,稀释血液与分离液体积之比约为2∶1。(4)用水平离心机以2 000 rpm离心20 min,离心后,单个核细胞位于血浆和淋巴分离液界面层。(5)吸取界面单个核细胞层,用PBS洗涤3次,每次1 500 rpm离心10 min,吸弃上清,加入1 mL RPMI 1640,混匀,细胞计数,用苔盼蓝染色,计算活细胞数,均>95%。
1.5.1.2 PBMCs的培养 (1)用含10%小牛血清的RPMI 1640培养液重悬单个核细胞,并将细胞浓度调节至5×106/mL。(2)取1 mL浓度为5×106/mL PBMCs悬液放入24孔培养板中,在37℃,5%CO2条件下于培养箱中进行细胞培养。
1.5.1.3 标本的提取 分别于6、12、24 h收取PBMCs培养的上清液,置-70℃冰箱保存待测。
1.5.2 血清肌酸磷酸激酶(CK)最大值的测定 AMI患者发病后每4 小时测1次CK直到最大值(由检验科专人质控检验)。
1.5.3 VEGF的测定 外周血单个核细胞培养分泌的VEGF量均采用双抗夹心酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定,浓度单位为pg/mL。按试剂盒说明进行操作。
1.6 统计学处理
应用SPSS17.0软件包进行统计分析,主要统计指标均进行正态性检验,对于偏态分布的计量资料,对数转换达到近似正态分布后,再进行比较。各统计指标均以(± s)表示。采用直线相关分析法分析相关指标间相关性,计量资料的组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PBMCs产生的VEGF水平的动态变化
PBMCs培养产生的VEGF水平在不同培养时间段呈动态变化,用“PBMC-VEGF”表示PBMCs培养产生的VEGF水平。为了便于观察,首先对AMI发病第1天分离的PBMCs培养产生的VEGF进行统计分析。见表1。从表中可见PBMCVEGF水平随着培养时间的延长而逐渐增加,在12 h和24 h时均显著高于对照组(P<0.05)。取培养24 h的PBMCs产生的VEGF量作为观察PBMCs分泌VEGF能力的统计指标。AMI患者从发病第1~15天,PBMC-VEGF水平呈动态变化。见表2。从表中可见,AMI组PBMC-VEGF水平从发病第1天开始升高,在第5天达峰值为(343.2±82.5)pg/mL,显著高于对照组的(143.3±24.2)pg/mL(P<0.05)。随后呈下降趋势,但仍显著高于对照组,到发病第15天PBMC-VEGF水平仍显著高于对照组(P<0.05)。
表1 AMI患者第1天PBMC-VEGF水平的变化(± s,pg/mL)

表1 AMI患者第1天PBMC-VEGF水平的变化(± s,pg/mL)
注:与对照组同时间比较,*P<0.05
组别 n 6 h 12 h 24 h对照组 12 78.5±22.1 95.3±27.0 143.3±24.2 AMI组 28 104.3±22.5 159.2±31.6* 206.0±43.7*
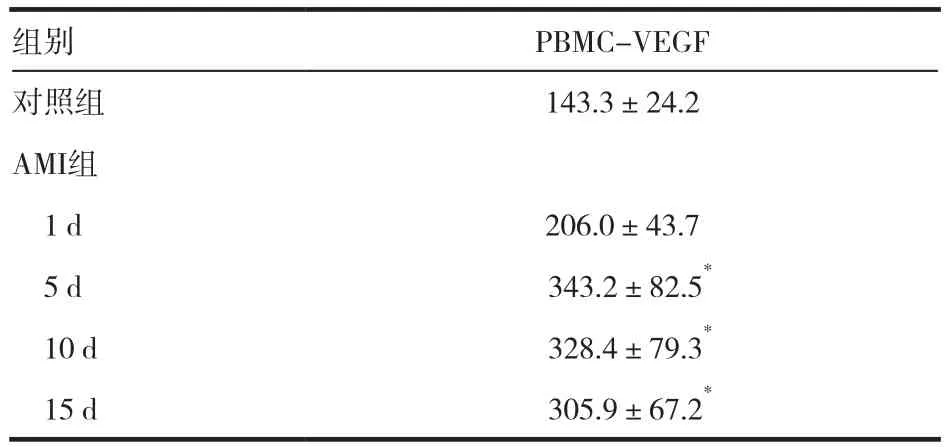
表2 AMI患者PBMC-VEGF水平的变化(n,pg/mL)
2.2 VEGF与心肌酶CK的相关性
AMI患者心肌酶峰值CK为929.8~3 827.2 IU/L,平均(2 185.9±320.3)IU/L。为了探讨VEGF水平与急性心肌梗死时心肌酶升高的关系,对外周血单个核细胞PBMC-VEGF水平与CK峰值进行线性相关分析,PBMC-VEGF峰值与CK无显著相关性。
2.3 VEGF水平与左室收缩功能的关系
为了探讨VEGF水平与左室收缩功能(LVEF)的关系,将入院时LVEF水平(52.3±2.6)%与半月后(出院时)复查的LVEF水平(52.7±2.8)%进行比较,结果两者之间差异无统计学意义(P>0.05)。将LVEF水平分成两组,A组为AMI患者半月后复查时LVEF水平不低于入院时LVEF水平,有12例,B组为AMI患者半月后复查时LVEF水平低于入院时LVEF水平,有16例,然后分别比较A、B两组PBMC-VEGF水平之间的关系。见表3。
表3 AMI患者VEGF水平与左室收缩功能的关系(± s)

表3 AMI患者VEGF水平与左室收缩功能的关系(± s)
注:与B组比较,*P<0.05
组别 n LVEF(%) PBMC-VEGF(pg/mL)A组 12 55.6±2.7* 867.6±113.1*B组 16 50.8±2.1 34.8±82.4
3 讨论
VEGF是现今发现的众多血管生长因子中最有力的血管生成因子,VEGF通过与细胞表面的特异受体结合而发挥作用,目前发现有3种特异受体分别为flt-1、flk-1/KDR和flt-4,属酪氨酸激酶受体家族第三亚型[1],其中flt-1和flt-1/KDR主要在血管内皮细胞表达,在人的冠状动脉内皮细胞和心肌细胞中均有高水平表达,提示VEGF在心血管系统的功能主要以旁分泌和自分泌的形式实现[2]。
本研究发现,从AMI患者外周静脉血中分离出的单个核细胞能分泌VEGF,PBMCs分泌的VEGF在AMI后即呈上升趋势,于心梗后第5天上升到最高峰,随后10 d内仍维持高值状态,且显著高于对照组,但PBMCs分泌VEGF的高峰值与心肌酶CK高峰值无显著相关性。从以上结果可见,AMI后,由PBMCs产生的VEGF水平迅速上升,目前,鲜有此类报道,其发生机制尚不清楚,可能与AMI发生后,产生VEGF的PBMCs的种类发生改变和(或)其分泌VEGF的功能得以加强有关,其发生机制有待进一步研究。Zhao等[3]发现,心肌梗死处VEGF mRNA基因表达在AMI后2 h就迅速增高,12 h达高峰。引起VEGF表达增加的原因是多方面的。以上结果显示,心肌缺血、缺氧可能是刺激心肌细胞VEGF迅速高表达并在特定时间内持续的主要始动因素,AMI后分泌的生物活性物质可能是AMI亚急性期VEGF持续高表达,并维持一定时间的原因之一[4]。
在研究VEGF水平与AMI患者左室收缩功能关系时发现,左室收缩功能有改善的AMI患者,其PBMC-VEGF水平显著高于左室收缩功能下降的AMI患者。推测AMI患者左室收缩功能的改善可能与PBMCs产生的内源性VEGF在参与修复损伤血管内皮和促进血管生成方面有密切关系。VEGF是迄今所发现最强的一种血管内皮生长因子,能特异地作用于靶细胞-VEC,促进其有丝分裂及血管形成。Zhao等[3]发现,梗死区有VEGF mRNA的表达,同时伴有血管密度高水平表达可持续7 d以上,提示VEGF可能参与心肌梗死的血管重建。Wu等[5]研究发现重组VEGF基因能改善AMI患者的左室收缩功能,局部梗死区心肌室壁异常运动也明显改善。以上结果显示,通过有效方法使特定部位的内源性VEGF基因和蛋白表达升高到一定程度,就能充分发挥其促血管生成,增加缺血心肌灌注,改善AMI患者左室收缩功能。
单个核细胞不但能分泌VEGF,且能介导VEGF对炎性细胞的趋化反应,与炎性细胞在血管生成中的作用有关[6]。Ripa等[7]发现,冠心病患者建立侧支循环以改善进行性冠脉狭窄的能力与单核细胞缺氧时产生的VEGF mRNA的能力有关,建立侧支循环的患者与没有建立侧支循环的患者相比,单核细胞缺氧时VEGF mRNA表达水平有显著差异。以上结果提示,急性心肌梗死时,单个核细胞趋化、粘附在损伤的血管内皮部位,促使内源性VEGFm RNA高表达及VEGF蛋白大量生成,发挥VEGF促内皮细胞分裂、增殖、修复血管内皮和促进缺血区侧枝循环的建立等作用,增加缺血区血流灌注,抑制缺血、梗死范围的进一步扩大,达到改善心脏收缩功能的作用。推测在AMI发生时,通过促进粘附在冠状动脉内皮损伤处PBMCs产生的VEG FmRNA高表达,可达到改善AMI患者心功能目的,详细的机制有待更深入的研究。
在AMI患者急性期,由PBMCs产生的VEGF在改善左室收缩功能方面可能起重要作用。
[1]Miura S,Matsuo Y,Saku K.Transactivation of KDR/Flk-1 by the B2 receptor induces tube formation in human coronary endothelial cells[J].Hypertension,2003,41(5):1118-1123.
[2]Korpisalo P,Yl-Herttuala S.Stimulation of functional vessel growth by gene therapy[J].Integr Biol (Camb),2010,2(2):102-112.
[3]Zhao T,Zhao W,Chen Y,et al.Vascular endothelial growth factor (VEGF)-A:role on cardiac angiogenesis following myocardial infarction[J].Microvasc Res,2010,80(2):188-194.
[4]Dremina NN,Shurygina IA,Lushnikova EL,et al.Effect of endothelial growth factor on postinfarction remodeling of rat myocardium[J].Bull Exp Biol Med,2009,148(3):441-446.
[5]Wu G,Rana JS,Wykrzykowska J,et al. Exercise-induced expression of VEGF and salvation of myocardium in the early stage of myocardial infarction[J]. Am J Physiol Heart Circ Physiol,2009,296(2):H389-H395.
[6]Koch S, Tugues S, Li X, et al. Signal transduction by vascular endothelial growth factor receptors[J]. Biochem J,2011,437(2):169-183.
[7]Ripa RS,Jrgensen E,Baldazzi F,et al.The influence of genotype on vascular endothelialgrowth factor and regulation of myocardial collateral blood flow in patients with acute and chronic coronary heart disease[J]. Scand J Clin Lab Invest,2009,69(6):722-728.
