同步硝化反硝化细菌的鉴定与脱氮特性研究
2012-08-11张巍
张 巍
(辽宁省环境科学研究院 国家环境保护村镇污水处理与资源化工程研究中心,沈阳110031)
近年来,中国广泛开展了脱氮方面的研究,并且取得了阶段性的进展。在已经开发的废水脱氮方法中,生物脱氮法是目前公认的最为经济有效的方法之一。在硝化 反硝化生物脱氮过程中,参与硝化的主要微生物硝化菌为自养菌,生长缓慢,世代时间长,需要较长的污泥龄,使得硝化成为城市污水处理厂的制约因素[1]。
不少研究和报道[2-4]已充分证明,反硝化可发生在有氧条件下,使得有关好氧硝化 反硝化生物脱氮的研究日趋活跃。目前已知的好氧硝化 反硝化菌有:粪产碱菌[5](Alcaligenesfaecalis),泛养硫球菌[6](Thiosphaerapantotropha),现更名为脱氮副球菌[7](Paracoccusdenitrificans)和赤红红球菌[8](Rhodococcusruber)等,它们能同时利用氧和硝酸作为电子受体以获得高生长率。已有报道[9]Pseudomonasmendocina是典型的反硝化细菌,具有较强的反硝化活性,当硝酸盐浓度为88.5mg/L时,反硝化速率最大,为26.2mg/(L·d),显现出较强的厌氧氨氧化能力。利用好氧同时硝化-反硝化菌发展好氧脱氮技术具有以下优点:1)使硝化/反硝化反应在同1个反应器中进行,可以大大减少占地面积和建设资金;2)使用好氧反硝化细菌可以减少处理过程中加入调节系统pH的化学物质,降低成本;3)在处理过程中好氧反硝化菌更容易控制[10]。因此新型好氧反硝化微生物的筛选和好氧同时硝化反硝化生物脱氮技术已经成了生物脱氮领域新的研究和发展趋势。同时,污水处理中微生物的代谢情况与温度有关,随着温度降低微生物活性下降,当温度低于4℃时,微生物的生理活动几乎停止。北方冬季的低温条件会对微生物的生存造成很大影响,水温过低,会影响细菌的增殖速率和生理活性,同样会使硝化 反硝化作用停止。少数微生物会因为基因突变而产生抗寒性,因此可以通过人工选择的方式来培养耐低温优势菌种,使其在低温下仍有较强的脱氮能力[11]。
笔者依据好氧硝化 反硝化脱氮的原理,采用低温摇床富集、筛选具有硝化作用的反硝化脱氮菌,利用传统与现代分子生物学相结合手段进行同步硝化 反硝化短程脱氮菌分离并鉴定确定其分类地位。为富集高效硝化 反硝化短程脱氮菌,提高硝化 反硝化脱氮过程的效率,开发高效节能低耗的硝化反硝化短程脱氮工艺提供理论依据。
1 材料和方法
1.1 实验材料
实验所用菌种来源于辽宁省昌图污水处理厂A/O装置中的好氧活性污泥。其他化学试剂均为市售分析纯。基因组DNA抽提试剂盒,宝生物工程(大连)有限公司。
1.2 分析仪器
分光光度计(UNICO UVTU-1901);电子天平(LP502A);pH 计(上海雷磁,pHs-3c),离心机(TDZ5-WS);生化培养箱(SPX-100B-Z);高压灭菌锅(HVE-50AUTOCLAVE);电子显微镜(OLYMPUS CX41KF);BIOLOG微生物鉴定系统(美国microLog);恒温水浴摇床(英国 OLS200)。
1.3 分析方法
菌体浓度测定采用分光光度法测定[12]。CODCr测定采用重铬酸钾法,NH4+-N采用纳氏分光光度计法[13]。
1.4 培养基
用于富集培养降解同步硝化反硝化细菌的培养基配方为:NaNO20.5g、牛肉膏3.0g、蛋白胨10.0g、NaCl 5.0g、pH 7.0[14]。
用于分离纯化同步硝化反硝化菌的培养基配方为:NaNO21.0g、Na2CO31.0g、NaH2PO40.25g、CaCO31.0g、K2HPO40.75g、MnSO40.01g、MgSO4·4H2O 0.03g、H2O 1 000mL、琼脂15g。
1.5 菌株的富集与分离
将好氧污泥接种于4瓶250mL富集培养基中,每瓶污泥接种1.0mL,摇床培养,摇床温度为15℃,转速120r·min-1。4d后,将富集好的菌液稀释后涂布于20个装有分离培养基的平板上。将平板置于温度为15℃的培养箱中培养,定期观察菌体的生长情况。用接种环将平板上生长良好的菌落挑出,划线培养于分离培养基中,翻接8~10次,将菌株分离。将分离出的菌株,划线于普通肉汁斜面,4℃冰箱保藏。
1.6 菌株的生理生化鉴定
参照《菌种保藏手册》[15]和《伯杰细菌鉴定手册》[16],对SNDB-5进行生理生化实验。
1.7 BIOLOG鉴定
BIOLOG鉴定系统由浊读仪、读数仪、数据库、软件、微孔鉴定板组成,其实验方法参照文献[17]。
1.8 细菌的基因组DNA提取
采用宝生物工程(大连)有限公司的基因组DNA抽提试剂盒提取。
1.9 16SrDNA扩增与测序
以SNDB-5总DNA为模板,以用DNASTAR软件分析设计的引物P1(188bp左右有一段21bp片断:5′-CGCTAATACCGCAT ACGTCCT-3′)和P2(1 128bp左右有1段20bp片断:5′-CCATGCAGCACCTGTGTCTG-3′)进行扩增,反应液为50μL,含有ddH2O 40μL,dNTP 1μL,10×buffer 5μL,TaqE 1μL,模板DNA 1μL,50pmol·μL-1引物2μL。PCR反应条件为94℃预变性5min,94℃1min,53℃40s,72℃40s,35个循环,最后72℃保温6min。测序由宝生物工程(大连)有限公司完成,将测序结果用Blast软件与Genbank中16SrDNA序列进行同源性比较。
1.10 菌株SNDB-5脱氮效能实验(以下实验均在好氧条件下进行)
将SNDB-5以10%的接菌量分别接种到经高压灭菌的同步硝化反硝化培养基和NaNO2模拟废水中,在15℃下,120r/min进行摇瓶培养,实验装置如图1。每12h监测同步硝化反硝化培养基中NO2--N、NO3--N、菌体生长吸光度(OD600)的变化;硝化培养基及NaNO2模拟废水中NO3--N、NO2--N、菌体生长吸光度(OD600)的变化。

图1 菌株实验装置
2 结果与讨论
2.1 菌株的分离与鉴定
2.1.1 菌株分离纯化 经过富集分离,筛选出一株同步硝化反硝化脱氮效果好的菌株SNDB-5,其在肉汁琼脂平板上生长旺盛,菌落较大,呈乳白色。光滑,湿润,中间隆起,不透明,无核,边缘整齐。通过革兰氏染色,鉴定为革兰氏阴性菌,在显微镜下观察菌株,发现该菌均为杆状菌,大小为(1.5~1.8)μm×(0.4~0.6)μm(如图2所示)。
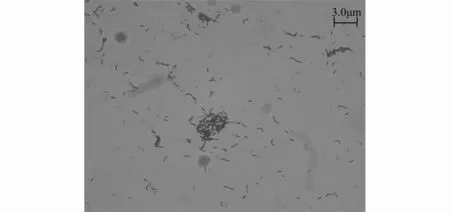
图2 菌株SNDB-5的显微照片(1000×)
2.1.2 BIOLOG鉴定结果 使用Biolog自动菌种鉴定系统对该株菌进行鉴定,该菌株鉴定种属为Pseudomonasmendocina(如图3所示)。

图3 SNDB-5菌的代谢指纹特征和鉴定结果
2.1.3 SNDB-5菌株的16SrDNA基因序列、基因克隆分析 在以16SForward、16SInternal和16S Reverse为引物进行DNA测序时,发现测序结果均出现连续套峰,怀疑是菌种不纯所致,因此采取了克隆测序。
质粒CTD445-XT1-2测序结果符合实验要求。登陆NCBI网站,将质粒进行序列比对,分别筛选出10余种与其相似的菌种,利用MEGA4软件,采取邻近法对质粒构建系统进化树。
将测得的CTD445-XT1-2的16SrDNA序列在GenBank中进行BLAST比对,所获得的同源序列均为Pseudomonas属的16SrDNA序列。
将 CTD445-XT1-2 的 16SrDNA 序 列 与 Gen-Bank中相似的14种已知菌的序列进行多序列比对,运用MEGA4软件做出进化树,如图4所示。
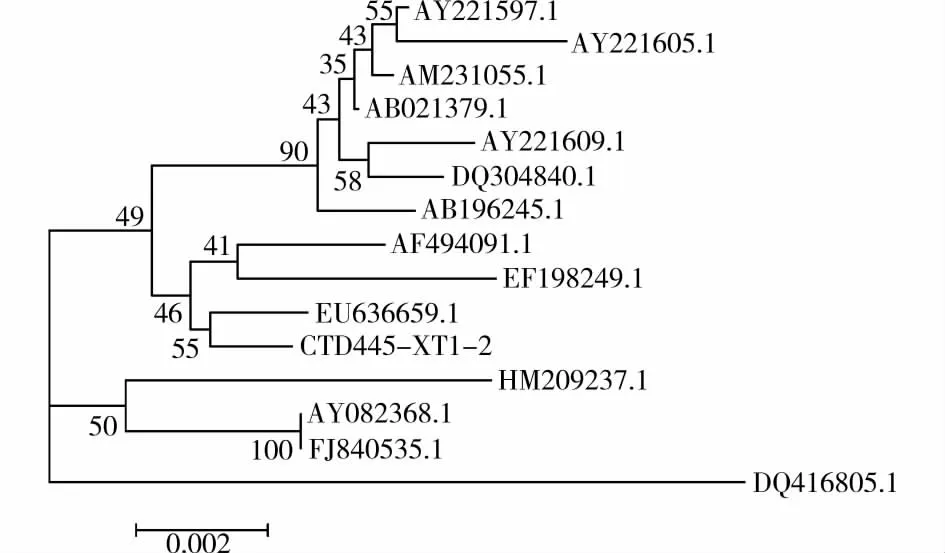
图4 依据16SrDNA序列构建的SNDB-5及相关种的系统发育树
由 图3可知CTD445-XT1-2 与 EU636659.1(Pseudomonasmendocina)同源性最近,相似性高达99%。
通过BIOLOG和分子生物学鉴定,结合菌株的形态学和生理学特性,可基本确定分离的菌株为Pseudomonasmendocina。菌株SNDB-5与现已报道的好氧同步硝化反硝化菌均不相同。目前已报道的Pseudomonasmendocina具有反硝化作用,而关于硝化作用尚无报道。
2.2 菌株SNDB-5的硝化作用
以NaNO2(浓度为0.1%)为惟一的氮源,培养基在121℃灭菌20min后,取20mL放入120mL的培养瓶中,菌株活化后接种于该液体培养基中,菌株在以NaNO2为氮源的培养基上生长时,菌体生长曲线及溶液中NO3-浓度的变化曲线如图5示。由图4可知,菌体的硝化主要是在菌体的对数生长期发生的,而在菌体进入衰亡期后,溶液中的NO3-的浓度一直处于很低的浓度水平。碳酸钠在好氧硝化过程中起着非常重要的作用,它不但作为细菌Pseudomonasmendocina生长所需的碳源,也是菌株进行硝化过程中能量的来源,在C/N比为2~3时,硝化速率达到最大[18]。本实验中C/N 约为1.6,可能尚未达到该菌株最佳C/N比,需要进一步研究,以确定此时它的最大硝化速率。
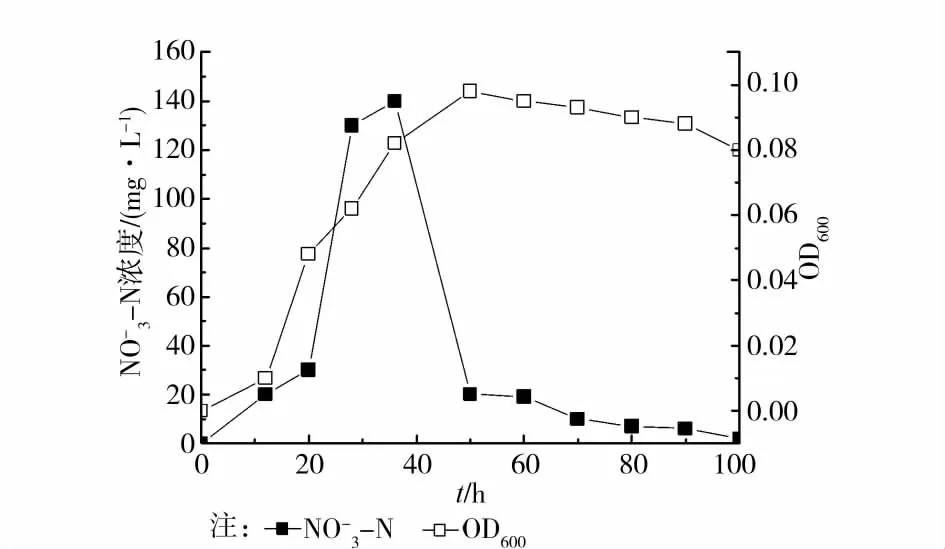
图5 菌株SNDB-5的硝化作用
2.3 不同亚硝酸盐负荷对菌株SNDB-5的硝化作用的影响
以不同浓度 NaNO2(25、50、100、150mg/L)为惟一的氮源,培养基在121℃灭菌20min后,取20 mL放入120mL的培养瓶中,菌株活化后接种于该液体培养基中,菌株在以不同浓度NaNO2为氮源的培养基上生长时,溶液中NO2-浓度的变化曲线如图6示。由图6可知,菌株SNDB-5在亚硝酸盐负荷为50mg/L时,亚硝酸盐去除效率最高为66%。在亚硝酸盐负荷为25mg/L时,亚硝酸盐去除率只有19%。当亚硝酸盐负荷大于50mg/L时,亚硝酸盐去除率随之下降,在亚硝酸盐负荷为100mg/L时,亚硝酸盐去除率为64%,亚硝酸盐负荷为150 mg/L时,亚硝酸盐去除率为48%。
随着亚硝酸盐负荷的提高,亚硝酸盐去除率降低,可以推断出随着水中的亚硝酸盐的浓度加大,菌株SNDB-5的活性受到了抑制。

图6 亚硝酸盐负荷对SNDB-5生长的影响
3 结 语
1)分离的菌株SNDB-5经鉴定为Pseudomonas mendocina,它与目前所报道的好氧硝化反硝化菌均不相同,表明了自然界中好氧硝化反硝化菌的生物多样性,对揭示好氧硝化反硝化菌群的生态学有重要的意义。
2)菌株SNDB-5能分别适应不同的亚硝酸盐浓度,当亚硝酸盐负荷大于50mg/L时,亚硝酸盐去除率随之下降,在亚硝酸盐负荷为100mg/L时,亚硝酸盐去除率为64%,亚硝酸盐负荷为150mg/L时,亚硝酸盐去除率为48%。使得该菌株适应力较强,可能存在于含有高氮素浓度的活性污泥中,有应用于污水好氧硝化反硝化脱氮处理的潜力。随着亚硝酸盐负荷的提高,菌株SNDB-5的活性受到了抑制。
3)低温条件下硝化反硝化脱氮菌的分离成功为后续高效工程菌的构建及工程应用研究提供了理论支撑和前提条件,使低温地区污水处理厂在冬季运行时提高脱氮率成为可能。
[1]Blum D J W,Speece R E.A database of chemical toxicity to environmental bacteria and its use in interspecies comparisions and correlations[J].Research Journal of the Water Pollution Control Federation,1991,63(3):198-207.
[2]Ding A Z,Fu J M,Sheng G Y.Evidence of aerobic denitrification[J].Chinese Science Bulletin,2000,45(3):2779-2782.
[3]Xie S G,Zhang X J,Wang Z S.Integrated study on biochemical mechanism in biofilter system [J].Acta Scientiae Circumstantiae,2002,22(5):557-561.
[4]Robertson L A,Kuenen J G.Aerobic denitrification:a controversy revived [J].Archives of Microbiology,1984,139:351-354.
[5]Sckalk O J,Kuenen J G.Hydeoxylamine oxidation and subsequent nitrous oxide production by the heterotrophic ammonia oxidizer a lcaligenes faecalis[J].Applied Microbiology and Biotechnology,1999,51(2):255-261.
[6]Robertson L A,van Niel E W J,Torremans R A M,et al.Simultaneous nitrification and denitrification in aerobic chemostst cultures ofThiosphaerapantotropha[J].Applied and Environmental Microbiology,1988,54:2812-2818.
[7]Lukow T,Diekmann H.Aerobic denitrification by a newly isolated heterotrophic bacterium strain TL1[J].Biotechnology Letters,1997,11(19):1157-1159.
[8]张光亚,方柏山,闵航,等.好氧同时硝化-反硝化菌的分离鉴定及系统发育分析[J].应用与环境生物学报,2005,11(2):226-228.ZHANG Guangya,FANG Baishan,MIN Hang,et al.Identification and phylogenetic analysis of an isolated aerobic simultaneous nitrifier-denitrifier [J].Chinese Journal of Applied and Environmental Biology,2005,11(2):226-228.
[9]胡宝兰,郑平,徐向阳,等.一株反硝化细菌的鉴定及其厌氧氨氧化能力的证明[J].中国科学C辑:生命科学,2006,36(6):493-499.HU Baolan,ZHENG Ping,XU Xiangyang,et al.Identification of a denitrifying bacterium and the anaerobic ammonia oxidation proof of ability [J].Science in China Series C:Life Sciences,2006,36(6):493-499.
[10]Artan N,Wilderer P,Orhon D,et al.The mechanism and design of sequencing batch reactor systems for nutrient removal the state of the art[J].Water Science and Technology,2001,43(3):53-60.
[11]Pochana K,Keller J.Study of factors affecting simultaneous nitrification and denitrification(SND)[J].Water Science and Technology,1999,39(6):61-68.
[12]周德庆.微生物学教程[M].北京:高等教育出版社,1993.
[13]国家环保总局.水和废水监测分析方法[M].北京:中国环境科学出版社,2002.
[14]Halling S B,Hjuler H.Simultaneous nitrification and denitrification with and upflow fixed bed reactor applying clinoptilolite as media[J].Water Treatment,1992,7:77-88.
[15]中国科学院微生物研究所.菌种保藏手册[M].北京:科学出版社,1980:293-294.
[16]Buchanan R E,Gibbons N E.Bergey’s manual of determinative bacteriology [M].8th ed.Baltimore:Williams and Wilikins Company,1974.
[17]李运,盛慧,赵荣华.Biolog微生物鉴定系统在菌种鉴定中的应用[J].酿酒科技,2005,7:84-85.LI Yun,SHENG Hui,ZHAO Ronghua.Utilization of biolog microbes identification system in the identification of microbial species [J].Liquor-making Science & Technology,2005,7:84-85.
[18]Huang H K,Tseng S K.Nitrate reduction by Citrobacter diversus under aerobic environment[J].Applied Microbiology and Biotechnology,2001,55:90-94.
