特异性激活SHH通路对急性脑缺血大鼠血管再生影响
2012-08-11朱美霖白宏英曾志磊张沛琳
朱美霖, 白宏英, 曾志磊, 张沛琳
脑缺血后血管再生正在受到越来越多的关注,研究表明脑缺血后血管再生能够尽快恢复缺血区的血供,挽救濒临死亡的神经元[1,2]。脑缺血后,缺血组织释放细胞因子动员内皮祖细胞,使其归巢并通过自身的分化、增殖形成新生血管。新生血管可以为组织细胞提供营养物质和氧,进而改善局部血供,缩小梗死灶[3],有助于脑缺血患者缺损的神经功能恢复。Sonic hedgehog信号通路(SHH)与血管再生有着密切的联系,Kusano[4]等发现糖尿病大鼠外周神经病变中加入外源性SHH可以诱导神经血管生成。SHH信号通路可影响众多血管新生因子,如VEGF和CD105等,从而调控血管生成。VEGF是血管生成的主要调控因子,CD105是血管再生所必需的,其表达与新生血管内皮细胞相关。既往对SHH信号通路对脑缺血后血管再生的研究甚少,本实验拟用purmorphamine激活SHH信号通路,以探究SHH信号通路激活对脑缺血后血管再生因子的影响,为脑缺血治疗提供新的方向。
1 材料与方法
1.1 动物分组及给药方法 健康成年雄性SD大鼠108只,清洁级,体重280~350g(由河南省实验动物中心提供),给予标准的饲料,自由进食进水。SD大鼠随机分为3组,即A组:假手术组(n=12);B组:模型组(n=48);C组:给药组(n=48)。其中B组和C组按时间分为4个亚组即6h、12h、24h、48h,每亚组12 只。C 组于术后按0.69/mg给予purmorphamine溶液腹腔注射,A组和B组于术后给予等剂量的DMF溶液注射。
1.2 药品与试剂 purmorphamine粉剂(T.R.C,CAS:483367-10-8)购自上海凯试公司。使用前先用DMF溶解,再用PBS溶液稀释。VEGF兔抗鼠多克隆抗体、CD105兔抗鼠多克隆抗体购自美国SANTA CRUZ。SP9000试剂盒、DAB试剂盒购自北京中杉生物工程公司。PCR试剂盒、内参β-actin、DEPC水、逆转录试剂盒、Trizol均购于北京全式金生物技术有限公司。
1.3 缺血模型的制备 参照Zea longa[5]等报道的线栓法制作SD大鼠永久性大脑中动脉缺血模型。假手术组仅分离颈总动脉及其分支,并不插入线栓和结扎。术中大鼠体温保持37℃。于大鼠清醒1h后进行神经功能评分,评分标准参照Zea longa 5分制评分标准。0分,无任何神经缺损症状;1分,不能完全伸直对侧前爪;2分,向对侧转圈;3分,向对侧倾倒;4分,不能自由行走;5分,死亡。其中评分1~4分入选后续试验,如在实验过程中有死亡或者不符合要求的大鼠,取同批次大鼠补足数量。
1.4 标本制备 10%水合氯醛麻醉,4%多聚甲醛心脏灌洗固定24h备用。石蜡包埋后连续切片,制备成4μm厚度切片。
1.5 免疫组化测定缺血半暗带区域VEGF和CD105的表达 采用SP法,按照说明书操作。每张切片随机选取10×40视野5个,应用图像分析系统进行光密度分析。
1.6 RT-PCR检测缺血半暗带内PTCH-1 mRNA的表达情况 10%水合氯醛麻醉大鼠,断头取脑,液氮冷冻后放置-80℃冰箱保存。按试剂盒说明书提取出脑组织总RNA,逆转录合成cDNA后进行扩增。扩增上游引物为5’-AAATGCTGAATAAAGCCGAAGT-3’,下游引物为 5’-GTGCCACCCACAATCAACTC-3’,扩增条件如下:94℃预变性2min,1 个循环;94℃变性 30s,58℃退火 30s,72℃延伸2min,共计35个循环;72℃延伸6min。实验中以β-actin作为内参。PTCH长度为199bp,扩增后得到所需目的基因经过电泳鉴定后采用图像分析系统进行半定量分析,目的基因PTCH-1的表达量与β-actin的DNA条带灰度比值进行计算。
1.7 统计学分析 采用SPSS17.0统计软件,实验数据以均数±标准差()表示。组间比较采用单因素方差分析,两两比较采用LSD检验,取α=0.05为检验水准。
2 结果
2.1 PTCH-1 mRNA表达情况 与A组比较,B组和C组PTCH-1 mRNA表达增高。差异具有统计学意义(P﹤0.05)。B组和C组缺血半暗带区域的PTCH-1 mRNA表达于脑缺血6h后开始升高,24h达高峰,之后有所下降但仍维持在较高水平。但与C组各时间点PTCH-1 mRNA与B组相比较表达显著增高,组间比较差异具有统计学意义(P<0.05)(见表1)。
2.2 VEGF表达情况 A组中大鼠脑组织中VEGF存在少量阳性细胞表达,B组和C组6h表达量开始增加,于48h表达最为显著。阳性表达区域主要存在于皮层下区和海马区的梗死灶周围。C组与A组、B组相比较各时间点阳性细胞数表达明显增多,差异具有统计学意义(P<0.05)(见表2、图1)。
2.3 CD105测定结果 A组CD105弱表达,B组于脑缺血后6h表达开始增高,且随着时间增加表达逐渐增高,C组与B组各时间点相比较CD105表达明显增多,差异具有统计学意义(P<0.05)(见表3)。
表1 大鼠脑组织中各个时间点PTCH-1mRNA表达(n=6,)

表1 大鼠脑组织中各个时间点PTCH-1mRNA表达(n=6,)
与A组相比*P<0.05;与B组相比△P<0.05
组别/时间点6h 12h 24h 48h A组B组C组0.085 ±0.006 0.102 ±0.007*0.116 ±0.009*△0.097 ±0.008 0.376 ±0.019*0.549 ±0.032*△0.093 ±0.007 0.537 ±0.024*0.7411 ±0.444*△0.0927 ±0.005 0.409 ±0.0140*0.550 ±0.020*△
表2 大鼠脑组织各时间点VEGF表达(平均光密度)(n=6,)

表2 大鼠脑组织各时间点VEGF表达(平均光密度)(n=6,)
与A组相比*P<0.05;与B组相比△P<0.05
组别/时间点6h 12h 24h 48h A组B组C组99.36 ±3.29 107.04 ±4.59*116.69 ±7.14*△99.37 ±3.29 130.71 ±6.72*132.73 ±10.55*△105.27 ±5.18 136.20 ±10.00*148.04 ±13.17*△99.37 ±3.29 145.47 ±7.85*159.24 ±9.91*△
表3 大鼠脑组织各时间点CD105表达(平均光密度)(n=6,)

表3 大鼠脑组织各时间点CD105表达(平均光密度)(n=6,)
与A组相比*P<0.05;与B组相比△P<0.05
组别/时间点6h 12h 24h 48h A组B组C组58.94 ±3.02 87.03 ±6.012*118.24 ±6.85*△58.94 ±3.02 114.03 ±7.36*143.93 ±7.18*△66.95 ±2.84 121.60 ±7.23*163.85 ±5.08*△68.58 ±2.78 137.49 ±6.53*162.25 ±4.4*△
3 讨论
脑缺血后,缺血区血管再生范围和程度影响了缺血区的血流灌注,增加缺血区血供或者促进血管再生可加快脑缺血后损伤脑组织的修复。近些年研究发现SHH信号通路与血管再生有着密切关系。Kusano等[6]研究发现SHH通路可以诱导局部缺血组织血管再生,且SHH诱导血管新生的能力强于VEGF。Pola R等[7]在研究SHH通路时指出SHH通路可以通过上调VEGF和ANG诱导形成较大直径的血管。SHH信号通路诱导血管再生可能是通过SHH/GLI/SMO通路实现的,SHH信号通路通过PTCH和SMO两个转录因子对靶细胞进行调控。当SHH信号通路处于静止期时,PTCH与SMO结合抑制SMO活性。当SHH通路被激活时,SHH蛋白与PTCH结合,PTC/SMO复合物释放SMO活性,SMO激活下游GLI从而诱导目的基因的表达。SHH不足时,PTCH-1表达降低,SHH通路激活时,PTCH-1表达增加。因此PTCH-1常作为检测SHH信号通路活化的标志分子[8]。本课题通过PCR测定PTCH-1反映SHH信号是否处于激活状态。
purmorphamine是一种小分子嘌呤衍生物,分子量为520.62,可透过血脑屏障。purmorphamine与SMO结合后SMO蛋白空间构象发生改变从而激活SHH通路下游分子。本研究发现PTCH-1在脑缺血后6h表达有所增加,提示脑缺血后存在内源性的SHH信号通路激活,这与既往研究结果一致。加入purmorphamine溶液后,PTCH-1表达明显增加,24h升高最为显著,48h有所降低,与模型组相比有统计学意义,提示给予外源性SHH信号通路激活剂purmorphamine可以有效激活SHH信号通路,但具有时效性,随着时间推移,这种效应逐渐减弱,难以持续激活SHH信号通路。
VEGF是血管生长的重要调节物质,在内皮细胞分化和神经形成过程中参与早期血管生成,促进血管内皮细胞存活和增殖,加速形成新生血管。CD105(endoglin)通过对TGF-β调控影响血管再生,也是血管再生中必需的因子。CD105在正常组织几乎不表达,但是在新生血管强表达,可以作为新生血管内皮细胞特异标志物。有研究表明CD105测定的血管密度是一个独立的指标,能定量区别新生血管和已存在的血管[9]。本研究结果发现在脑缺血后6h促血管再生因子VEGF和新生血管标志物CD105表达开始增多,于48h升高最为显著,提示脑缺血可刺激体内的内源性VEGF和CD105表达,应用purmorphamine后,VEGF和CD105的表达均明显增加,提示激活SHH通路后可上调VEGF和CD105表达,促进血管再生。另外,应用purmorphamine后,PTCH-1的表达高峰在24h,而VEGF和CD105表达高峰有一定延迟,提示SHH信号通路激活促进血管再生的效应不是即刻的,这可能与SHH信号通路下游分子较多有关,也可能与相关蛋白的分泌表达时间有关。
可否连续应用外源性激活剂purmorphamine激活SHH通路而形成对血管再生的持续效应有待于进一步研究。
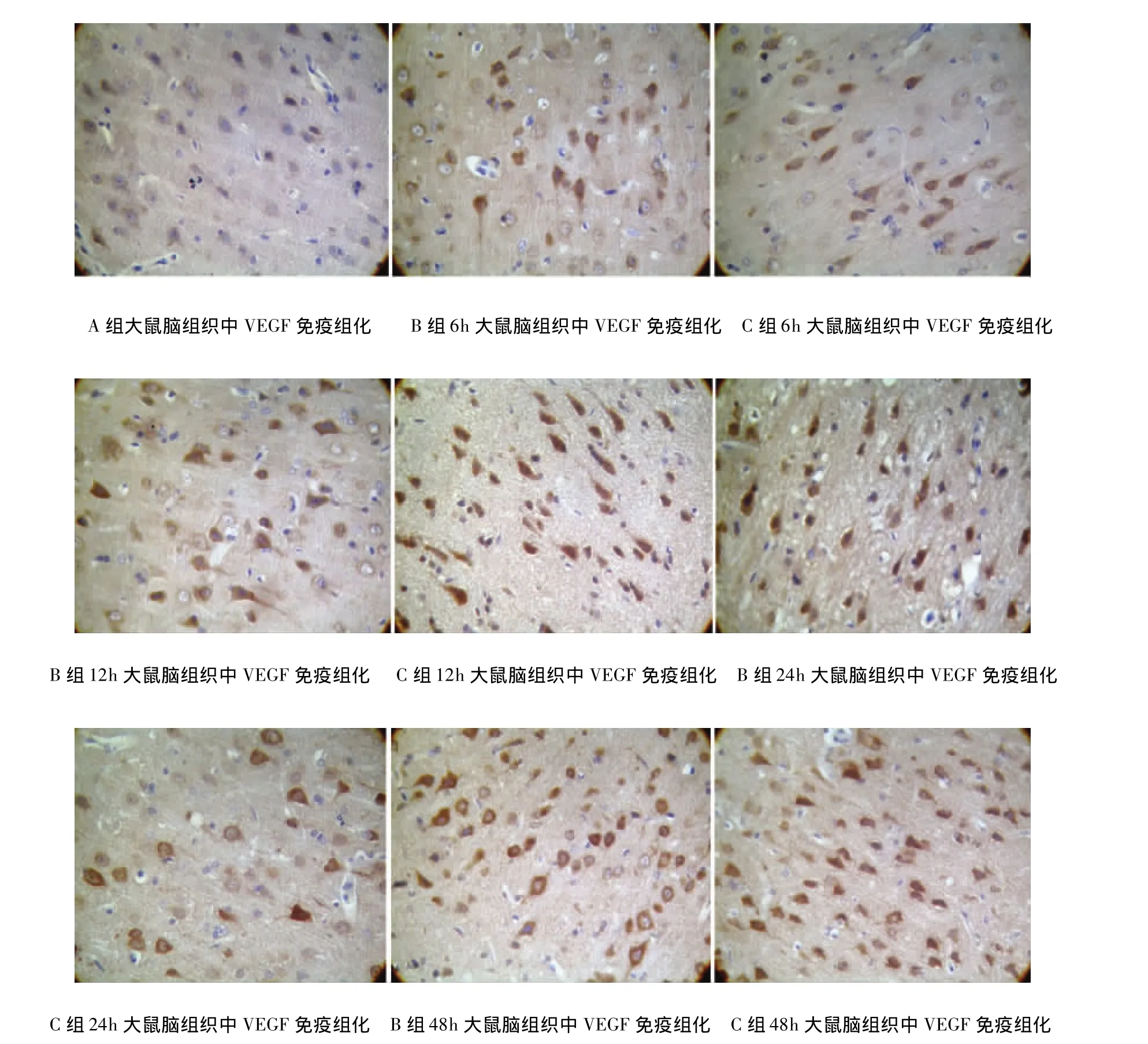
图1 免疫组化测定各时间点VEGF表达情况(A:假手术组;B:模型组;C:给药组)
[1]Rosell-novel A,Montaner J,Alvarez-Sabin J.Angiogenesis in human cerebral ischemia[J].Rev Neurol,2004,38(11):1076-1082.
[2]Hayashi T,Deguchi K,Nagotani S,et al.Cerebral ischemia and angiogenesis[J].Curr Neurovasc Res,2006,3(2):119-129.
[3]Chen J,Zhang ZG,Li Y,et al.Intravenous administration of human bone marrow stromal cells induces angiogenesis in the ischemic boundary zone after stroke in rats[J].Circ Res,2003,92(6):692-699.
[4]Kusano KF,Allendoerfer KL,Munger W,et al.Sonic hedgehog induces arteriogenesis in diabetic vasa nervorum and restores function in diabetic neuropathy[J].Arterioscler Thromb Vasc Biol,2004,24(11):2102-2107.
[5]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6]Kusano KF,Allendolerfer KL,Munger W,et al.Sonic hedgehog induces arteriogenesis in diabetic vasa nervorum and restores function in diabetic neyropathy[J].Arterioscler Thromb Vasc Biol,2004,24:2102-2107.
[7]Pola R,Ling LE,Siliver M,et al.The morphogen Sonic hedgehog is an indirect angiogenic agent upregulating two families of angiogenic growth factors[J].Nat Med,2001,7(6):706-711.
[8]Tuncer MC,Ozturk H,Buyukbayram H,et al.Interaction of L-Arginine-methylester and sonic hedgehog in liver ischemia-reperfusion injury in the rats[J].World J Gastroenterol,2007,13(28):3841-3846.
[9]Kumar S,Ghellal A,Li C,et al.Breast carcinoma:vascular density determined using CD105 antibody correlates with tumor prognosis[J].Cancer Res,1999,59(4):856-861.
