蛇床子素对癫痫大鼠电压门控钾通道Kv1.2表达的影响
2012-08-11李志强邹飒枫曾常茜崔家辉李晓燕段春梅
李志强, 邹飒枫, 曾常茜, 崔家辉, 李晓燕, 潘 心, 段春梅
癫痫(epilepsy)是一组由多种病因引起的,以脑部神经元高度同步放电为特征的,发作性、短暂性和刻板性的中枢神经系统慢性临床综合征。目前癫痫的发病机制仍不完全清楚,离子通道学说受到研究者的广泛关注,钾离子通道特别是电压门控钾离子通道(Kv)在促进细胞膜恢复静息状态,调节兴奋性方面发挥重要的作用。有研究表明蛇床子素(osthole,OST)可以通过抗炎、抗氧化及抗凋亡作用对脑缺血及再灌注引起的神经元功能损伤起到保护作用[1];OST对帕金森病和阿尔兹海默病的神经元也有保护作用[2,3]。但是OST对癫痫神经元损伤的作用尚不清楚。
本实验通过检测OST对钾离子通道Kv1.2蛋白表达的影响,探讨OST对癫痫的作用及机制,旨在为癫痫的治疗提供一种新的途径。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级SD雄性大鼠60只(10周龄、体重220±20克),由大连医科大学实验动物中心提供。实验条件下适应性喂养1w后,随机均分为3组(n=20)即空白对照组、模型组、OST组(50mg/kg)。
1.1.2 实验试剂 蛇床子素(纯度 >99.8%)购于成都曼斯特生物科技有限公司;KA购于Sigma公司;抗鼠Kv1.2单克隆抗体购于alomone公司;免疫组化SP试剂盒、DAB显色剂、辣根过氧化物酶标记的羊抗兔IgG购于北京中杉金桥;结晶紫、二甲基亚砜、NaOH购于大连绿竹;水合氯醛、考马斯亮蓝试剂盒、牛血清白蛋白(BSA)购于上海生物工程有限公司;预染 Marker、β-actin购自 Cell Signal Technology公司;RIPA裂解液、PMSF购于江苏碧云天生物技术有限公司;丙烯酰胺、SDS、甘氨酸、Tris碱、溴酚蓝、Tween-20、TEMED、PVDF膜等均为Sigma公司产品。
1.1.3 实验主要仪器 POWERLAB电生理记录仪(ADinstruments/澳大利亚);DU640紫外分光光度计(Beckman/美国);显微镜及自动照相系统(Olympus/日本);蛋白电转仪、垂直电泳仪、凝胶成像系统(Bio-Rad公司/美国)。
1.2 方法
1.2.1 癫痫模型的制作 每天在同一时间点给予OST(50mg/kg)大鼠灌胃[2],空白对照组和模型组给予等时等量生理盐水灌胃,连续10d。第11天OST组与模型组均通过颈内皮下注射KA10mg/kg,浓度为 5mg/ml致痫[4],空白对照组经颈内皮下注射等量的生理盐水,然后观察各组大鼠的行为和脑电的变化。大鼠惊厥的行为表现采用Racine六级评价标准。Racine分级标准[5]为:0级:无任何反应;Ⅰ级:面部阵挛,包括眨眼、动须、节奏性咀嚼、湿狗样抖动等;Ⅱ级:Ⅰ级加节律性点头和(或)甩头;Ⅲ级:Ⅱ级加前肢阵挛;Ⅳ级:Ⅲ级加后肢站立;Ⅴ级:Ⅳ级加双侧前、后肢强直、身体背屈强直、跌倒,持续站立和倾倒,失平衡和四肢抽动。注射KA后观察大鼠的行为学变化并记录,当大鼠达Ⅳ~V级且重复的惊厥发作达10min以上或者脑电监测为尖波、慢波、尖慢复合波时认定大鼠致痫成功,72h后处死3组大鼠,并取脑组织进行以下实验。
1.2.2 大鼠行为学观察 观察并记录各组大鼠癫痫发作的潜伏期,发作持续时间和缓解时间及大鼠癫痫发作Racine等级。
1.2.3 脑电的引导与分析 每组大鼠各取两只行脑电监测。应用脑立体定位仪确定电极安装位置:右额及右枕(右额坐标为:前囟前3.0mm,中线旁2.0mm,硬膜下 0.5mm;右枕坐标为:前囟后5.8 mm,中线旁 3.0mm,硬膜下 0.5mm)。用 powerlab生理记录仪对大鼠的脑电图进行记录,参数为:高通0.03S,低通 30Hz,量程 500μv ~ 3mv。分别在注射的前后监测大鼠的EEG,每5min记录一次,直至150min。通过脑电图的形态、频率以及波幅对癫痫大鼠的大脑进行痫样放电的判断。
1.2.4 脑片制作 3组大鼠在10%水合氯醛(350mg/kg)腹腔麻醉下经左心室灌注生理盐250ml,随后灌注4%多聚甲醛0.0lmol/L PBS(pH 7.4,4℃)250ml。将大鼠断头取脑,切开大脑左右半球,分别取海马部。其中一半球用4%多聚甲醛固定24h,4℃保存。常规脱水、透明、石蜡包埋。从约位于海马区层面连续冠状切片,脑切片每隔5片取2片,行免疫组织化学染色。将另一半球海马迅速置于液氮罐中低温储存,以备行Western blot检测。
1.2.5 免疫组化染色检测电压门控钾通道Kv1.2蛋白水平 钾通道Kv1.2表达检测采用ABC染色方法。各组大鼠海马做石蜡切片后常规脱蜡,微波修复抗原,自然凉至室温。抑制内源性过氧化物酶活性后,用山羊免疫正常血清封闭非特异性结合位点,室温孵育30min。加兔抗鼠Kv1.2单克隆抗体(1∶200),4℃过夜。PBS洗涤5min,重复3次。加生物素标记的羊抗兔IgG抗体,37℃孵育1h后,PBS洗涤5min,重复3次。滴加SP试剂,室温作用20min,PBS洗涤5min,重复3次。加DAB显色2min后,用苏木素复染1min。脱水、透明,中性树胶封片。显微镜下(×40和×400)观察结果。用Image proplus图像分析软件测定海马CA3区Kv1.2蛋白表达的平均光密度(IOD/area),并进行统计分析。
1.2.6 Western blot检测电压门控钾通道 K v1.2蛋白水平 用RIPA裂解液提取脑组织全细胞蛋白、紫外光分光光度计测定蛋白浓度及计算上样量;在100℃水浴中煮5min使蛋白充分变性;用蛋白电转仪装置进行转膜;NC膜放入封闭液中4℃过夜;在NC膜上均匀加入羊抗鼠Kv1.2单克隆抗体(1∶200),37℃孵育1h,TTBS 洗涤10min,重复 3 次;加入辣根酶标记的链霉亲和素工作液,37℃孵育1h,TTBS洗涤10min,重复3次;滴加DAB液,避光显色。用Lannch Doc-Itis软件对图片条带行光密度测定,取各条带累积光密度(IOD)与相对应的β-actin内参蛋白IOD之比即Kv1.2蛋白的相对量作统计分析。
1.3 统计学方法 用SPSS13.1软件对免疫组化检测电压门控钾通道Kv1.2蛋白表达的平均光密度进行方差分析和LSD检验。Kv1.2蛋白表达的IOD与β-actin蛋白的IOD比值作为蛋白表达相对量,对此进行方差分析和LSD检验。
2 结果
2.1 各组大鼠的行为学表现 空白对照组大鼠颈内皮下注射生理盐水后与前未见行为学变化。模型组大鼠颈内皮下注射KA后,15min左右开始出现动须、湿狗样抖动等Ⅰ级反应;30min左右出现颈部肌肉痉挛、节律性点头、一侧前肢阵挛等Ⅱ、Ⅲ级表现;60min出现双侧前、后肢强直、身体背屈强直、跌倒、站立和倾倒、失平衡和四肢抽动等Ⅳ、Ⅴ级表现,说明大鼠达到癫痫持续状态,并持续约30~60min,随后抽搐、痉挛等行为减少,变安静。OST组大鼠注射KA后,30min后出现呼吸急促、躁动不安、节律性咀嚼、偶发湿狗样抖动等Ⅰ级反应;约90min后出现湿狗样抖动的频率和幅度均增加、点头、一侧前肢出现痉挛等Ⅱ、Ⅲ级表现;180min后大鼠四肢痉挛、直立、跌倒、翻转、口吐白沫、持续约1~5min等Ⅳ、Ⅴ级表现,但发作的程度较模型组大鼠轻;大约240min后大鼠的抽搐及痉挛行为明显减少;24h后大鼠偶有湿狗样抖动发作。蛇床子素各组大鼠癫痫发作的潜伏期较模型组时间长,发作程度较模型组轻,发作时间以及持续时间较模型组短。空白对照组大鼠未发现异常。
2.2 脑电图检测结果 空白对照组大鼠脑电图(EEG)示弥漫α波,波幅均匀一致;模型组大鼠癫痫发作时,EEG示大量的棘波、尖波、棘-慢波和尖-慢波,节律不规则。OST组大鼠癫痫发作时,EEG示棘波、尖波的频率和波幅较癫痫组大鼠明显降低 (见图1)。
2.3 大鼠 Kv1.2蛋白表达的检测结果 Kv 1.2蛋白在各组大鼠海马均有表达,并以锥体细胞层和齿状回颗粒细胞层表达最为明显。高倍镜下可见阳性细胞,表现在胞浆与胞膜上为棕黄色颗粒而胞核为蓝色,以CA3区较明显(见图2、图3)。模型组大鼠的阳性细胞数较空白对照组和蛇床子素组少,且阳性细胞着色浅,少有突起。模型组的平均光密度值(0.053 ±0.012)分别较对照组(0.089 ±0.009)和蛇床子素组(0.084 ±0.017)显著减少(P<0.05);对照组与蛇床子素组的平均光密度值无显著性差异(P >0.05)。
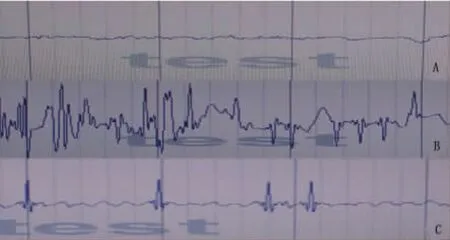
图1 各组大鼠脑电图检测结果
2.4 大鼠Kv1.2蛋白相对浓度的检测结果Western blot蛋白免疫印迹检测显示,在分子量为57kD处有明显的蛋白条带,对照组与蛇床子素组较模型组蛋白条带明显增宽,且蛇床子素组与对照组之间差异不明显。结果提示:各组大鼠海马神经元CA3区均有Kv1.2蛋白表达;模型组大鼠海马神经元CA3区Kv1.2蛋白相对浓度减少,蛇床子素组大鼠Kv1.2蛋白相对浓度较模型组多,这与免疫组化检测结果相一致。模型组(0.794)与蛇床子素组(0.997)、对照组(1.027)大鼠海马CA3区Kv1.2蛋白相对浓度有明显差异。模型组与对照组和蛇床子素组比较均P<0.05;对照组与蛇床子素组比较P>0.05。
3 讨论
癫痫的病变基础是神经元高度同步化异常放电,而异常放电是由离子异常跨膜运动所致,后者的发生与离子通道的结构和功能异常有关。癫痫的发病机制仍不完全清楚,但一些发病关键环节已经为人类所知,离子通道学说受到研究者的广泛认同,钾离子通道特别是电压门控钾离子通道(Kv)在促进细胞膜恢复静息状态、调节兴奋性方面发挥重要的作用[6]。
调控离子通道的神经递质和调质功能障碍又是引起离子通道功能异常的主要原因。神经递质分为兴奋性神经递质和抑制性神经递质。KA是人工合成的脑内兴奋性神经递质谷氨酸的类似物,主要作用于离子型谷氨酸受体。给予大鼠系统注射KA可以选择性地激活边缘系统特别是海马锥体神经元,并伴随一系列病理学变化如神经细胞丢失、锥体细胞轴突侧枝芽生新的谷氨酸突触联系等,引起急性癫痫发作[7]。用KA制作的大鼠癫痫模型,海马结构的形态变化主要在于CA3区,且在注射KA后72h达高峰,可以很好地模拟人类颞叶癫痫的发作行为学和病理学改变。
蛇床子素又名甲氧基欧芹酚或欧芹酚甲醚(osthole,OST),其化学名称为7-甲氧基-8-异戊烯基香豆素,是1909年首先从伞形科植物蛇床成熟果实蛇床子(frucrus cnidii)中提取分离出的天然香豆素类单体(C15H16O3)。OST能很好地通过血脑屏障,且在中枢神经系统具有抗缺血性脑损伤、抗痴呆、镇静、镇痛、抗帕金森病等药理作用[8]。Luszczki等[9]应用最大电休克诱导小鼠制作癫痫发作模型,观发现OST具有明确的抗电休克所致的发作效应,但其机制未阐明。
本实验通过颈内皮下注射KA建立实验性癫痫大鼠动物模型,将大鼠分为空白对照组、模型组、OST干预组,对大鼠海马CA3区瞬时外向钾离子通道Kv1.2蛋白进行免疫组化和Western blot检测。经过OST预处理的KA致痫大鼠CA3区Kv1.2蛋白表达明显增加,且与空白对照组比较未见明显差异。实验结果显示,OST可通过降低癫痫大鼠Kv 1.2蛋白的减少程度而减少大鼠的神经元凋亡,进而对神经元起到保护作用。最近研究发现,钾通道Kv1.2蛋白表达减少与全身强直-阵挛发作性癫痫发病机制密切相关[10],主要原因为Kv1.2蛋白表达减少或活性减低可以导致神经元高度兴奋,进而导致神经细胞凋亡。Kv1.2蛋白表达减少主要是由于Kv1.2蛋白磷酸化所致,而这种磷酸化主要通过PI3-K凋亡信号通路调节[11]。有研究显示,Kv1.2蛋白表达同时也受到炎症因子IL-1β和TNF-α以及活性氧(ROS)的影响[12]。这与蛇床子素在帕金森和阿尔茨海默中的作用机制类似。所以OST可能通过PI3-K通路减少对Kv1.2蛋白的磷酸化,以及发挥OST抗炎抗氧化的作用,共同增加Kv1.2蛋白表达来实现对神经元的保护作用。因此,OST可能为钾离子通道开放剂;通过增加Kv1.2蛋白表达从而减少对神经元的损伤,这为癫痫的治疗开辟了新的道路。

图2 大鼠海马CA3区Kv1.2表达的免疫组化染色(DAB染色,苏木素复染,×40),A:对照组;B:模型组;C:蛇床子素组
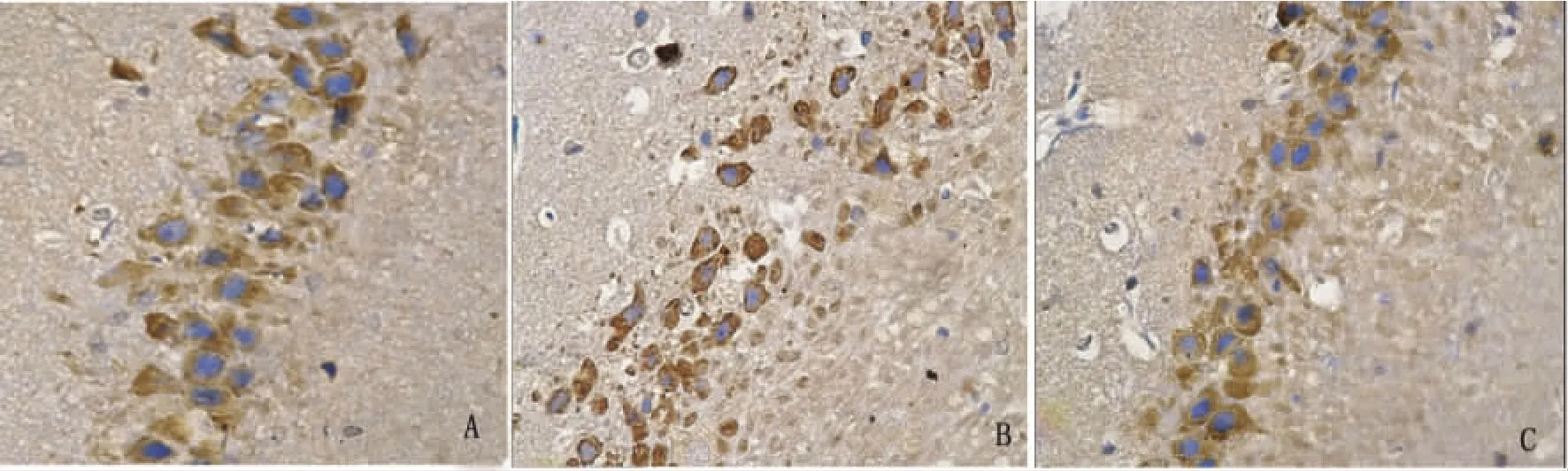
图3 大鼠海马CA3区Kv1.2表达的免疫组化染色(DAB染色,苏木素复染,×400),A:对照组;B:模型组;C:蛇床子素组
[1]Chao X,Zhou J,Chen T,et al.Neuroprotective effect of osthole against acute ischemic stroke on middle cerebral ischemia occlusion in rats[J].Brain Res,2010,1363:206-211.
[2]周 军,孙晓莉,王四旺.蛇床子素对帕金森病防治作用的基础研究[D].西安:第四军医大学,2009,11.
[3]程淑意,陈云波,王 奇,等.蛇床子素对Aβ诱导的星形胶质细胞 NF-κB 活化机制的影响[J].广州中医药大学学报,2010,27(1):36-39.
[4]Ben-Ari Y,Tremblay E,Ottersen OP,et al.The role of epileptic activity in hippocampal and“remote”cerebral lesions induced by kainic acid[J].Brain Res,1980,191(1):79-97.
[5]Lv Y,Ma D,Meng H,et al.Habenula regulates cardiovascular activities in the insula cortex in a rat model of epilepsy[J].Int J Neurosci,2012,122(6):314-323.
[6]李亚伟,邹飒枫,曾常茜.电压门控钾离子通道与癫痫[J].中风与神经疾病杂志,2010,27(6):575-576.
[7]隋鸿锦,张万琴,洪昭雄.海仁酸诱导癫痫模型海马的形态学改变[J].解剖科学进展,1997,3(2):103-108.
[8]龚其海,杨丹莉,李 菲,等.蛇床子素:防治中枢神经系统疾病的新希望[J].遵义医学院学报,2011,34(1):83-87.
[9]Luszczki JJ,Andres-Mach M,Cisowski W,et al.Osthole suppresses seizures in the mouse maximal electroshock seizure model[J].Eur J Pharmacol,2009,607(1 ~3):107-109.
[10]曾常茜,李冬平,唐 伟,等.钾通道Kv1.2与致痫大鼠发病相关性的研究[J].国际神经病学神经外科学杂志,2010,27(8):700-703.
[11]Qiu MH,Zhang R,Sun FY.Enhancement of ischemia-induced tyrosine phosphorylation of Kv1.2 by vascular endothelial growth factor via activation of phosphatidylinositol 3-kinase[J].J Neurochem,2003,87(6):1509-1517.
[12]Li F,Lu J,Wu CY,et al.Expression of Kv1.2 in microglia and its putative roles in modulating production of proinflammatory cytokines and reactive oxygen species[J].J Neurochem,2008,106(5):2093-2105.
